組蛋白去乙酰化酶5在非小細胞肺癌遷移中的作用研究
洪偉俊 寧允葉 胥武劍 邵艷 李強
第二軍醫大學長海醫院呼吸內科,上海 200433
肺癌是死亡率極高的惡性腫瘤,其中80%為非小細胞肺癌(non-small cell lung cancer,NSCLC),只有20%~30%的患者有手術機會,但是即使是在手術切除的早期NSCLC患者中,也有三分之二的患者存在復發和轉移的危險,5年生存率仍然較低(8%~14%)。叢蕾等[1]研究發現,晚期NSCLC患者單純化療后中位生存期僅為12.2個月,1年生存率只有52.9%,復發和轉移仍是導致死亡的主要因素。目前針對肺癌的主要治療手段——放療、化療等對提高肺癌患者的生存率已達到一個平臺期,深入探討肺癌發生、發展的分子生物學機制,以尋找新的安全有效的治療途徑、改善預后成為腫瘤研究的熱點。
組蛋白乙酰化狀態是調控基因轉錄的關鍵,而組蛋白乙酰化水平受組蛋白去乙酰化酶(histone deacetylases,HDACs)和組蛋白乙酰化酶(histone acetyltransferases,HATs)調節,HDACs和HATs失衡是腫瘤發生、發展的重要分子機制。組蛋白去乙酰化酶5(histone deacetylase 5,HDAC5)是Verdel等[2]于1999年在小鼠基因組中發現的。人HDAC5基因定位于染色體17q21,廣泛表達于肺、腦、心肌、骨骼肌、胎盤等多種組織。HDAC5在多種腫瘤中表達降低,但其在肺癌細胞遷移中的作用尚未見報道。本研究旨在檢測肺癌組織及其相對應的癌旁組織中HDAC5基因表達情況;體外利用HDAC5基因過表達質粒,研究HDAC5對肺腺癌細胞NCI-H1299遷移的影響。
1 資料和方法
1.1 患者一般資料
所有標本均來自我院2009年4月—2009年11月間手術的NSCLC患者,其中男性15例,女性13例;腺癌20例,鱗癌8例;年齡41~70歲,平均年齡為57.8歲。在手術切除病灶后用鋒利刀片迅速切取原發腫瘤和距離切緣2 cm處癌旁組織各1塊,組織標本凍存于液氮中。
1.2 主要試劑
NCI-H1299細胞(購自中國科學院上海細胞所);胎牛血清(Hyclone);高糖DMEM培養基(Hyclone)、OPTI-MEMⅠ培養基(Gibco);兔抗人-HDAC5(SAB);辣根過氧化酶(HRP)標記的兔抗人GAPDH抗體(康成生物);HRP標記的山羊抗兔IgG(Abcam);RNA提取試劑盒(TRIzol)(Invitrogen),RT-PCR試劑盒(Takara),real time-PCR試劑盒(Takara);HDAC5野生型基因質粒(pDEST26-HDAC5wt)由澳大利亞迪肯大學Sean L.McGee教授惠贈。
1.3 方法
1.3.1 細胞培養
NCI-H1299細胞貼壁生長于含10%胎牛血清、100 U/mL青霉素、100 μg/mL鏈霉素的DMEM高糖培養基中,37 ℃、CO2體積分數為5%、相對濕度為90%的溫箱(Heraus)內培養,當細胞融合達80%以上時0.25%胰酶消化傳代。
1.3.2HDAC5基因轉染及篩選
將NCI-H1299細胞接種于24孔板中,每孔為5×105個細胞,細胞融合至80%以上,用Fugene HD試劑盒進行轉染。實驗分組:轉染HDAC5wt基因的實驗組(HDAC5wt)、未轉染任何質粒的正常對照組(control)、轉染空質粒的陰性對照組(vector)。用OPTI-MEMⅠ培養基稀釋質粒DNA至濃度為:2 μg DNA/100 μL OPTIMEMⅠ培養基,分別以Fugene HD轉染試劑:DNA比例為2∶2、4∶2、6∶2配制轉染復合物,室溫下溫育15 min,將轉染復合物加入到培養細胞中,OPTI-MEM Ⅰ培養6~8 h后換成含10%胎牛血清的DMEM培養基繼續培養,48 h后收集細胞提取蛋白。再以選定的最佳轉染比例轉染NCI-H1299細胞,36 h時加入含1 000 μg/mL G418和10%胎牛血清的DMEM培養基進行選擇性培養,3周后篩選出陽性克隆擴增培養,并用500 μg/mL的G418維持篩選。
1.3.3 凍存組織處理
于液氮中取出標本,剪取少許組織并加入液氮后快速研磨,收集于2 mL EP管,分別加入TRIzol及RIPA蛋白裂解液后勻漿,提取mRNA、蛋白質,分別進行real time RT-PCR、Western blot實驗。
1.3.4 Real time RT-PCR檢測HDAC5 mRNA表達
用TRIzol法抽提總mRNA,測定其濃度和純度,用RT-PCR逆轉錄試劑盒逆轉錄為cDNA后進行PCR擴增。HDAC5上游引物:5’-CCATCAGCCAGAAGATGTATGC-3’,下游引物: 5’-ATTCCTCGGCGTGGTGTCCT-3’,PCR產物201 bp;β-actin上游引物:5’-GGACTTCGAGCAAGAGATGG-3’,下游引物: 5’-AGCACTGTGTTGGCGTACAG-3’,PCR產物 234 bp。PCR條件:94 ℃預變性2 min,94 ℃變性30 s,60 ℃退火延伸40 s,30個循環;72 ℃終延伸5 min。
1.3.5 Western blot檢測HDAC5蛋白
RIPA蛋白裂解液裂解細胞及組織,4 ℃、134 000×g離心20 min,取上清液即為蛋白提取物。用BCA法測定蛋白濃度,30 μg變性蛋白聚丙烯酰胺(PAGE,10%)凝膠電泳,轉膜,5% BSA封閉,1∶1 000一抗4 ℃過夜,1∶2 000山羊抗兔HRP標記二抗室溫反應1 h ,ECL顯色,成像。
1.3.6 MTT比色法測定細胞增殖
穩定轉染的H1299細胞(HDAC5wt)、空白質粒轉染細胞(vector)、未轉染細胞(control)融合達80%以上時,胰酶消化后形成單細胞懸液,以每孔5 000個細胞接種于 96孔板中,每組設10個復孔,分別于第1~5天時檢測細胞增殖情況。細胞貼壁后進行初始490 nm波長光下的吸光度(D490)測定,之后分別于第1~5天分別測定各組細胞的D490值:每孔加入100 μL MTT液培養4 h后,去除培養基,加入DMSO 150 μL,室溫下充分震蕩10 min,用酶標儀測定D490。重復3次。
1.3.7 Transwell實驗
分別將已融合至80%以上的3組細胞進行胰酶消化,形成單細胞懸液,872×g離心5 min后以無血清培養基重懸細胞,取200 μL無血清單細胞懸液(2×105個細胞)接種至置于24孔板內的8 μm PET膜的transwell 小室中,外室中加入含10%胎牛血清的DMEM高糖培養基,溫箱中溫育8 h取出,中性甲醛固定30 min,用棉簽小心擦去上層未遷移細胞,用瑞氏染色、拍照,鏡下計數6個視野中已跨膜遷移的細胞數目。
1.3.8 劃痕實驗
以每孔2×106個細胞接種于6孔板中,當細胞融合達90%~100%時,棄去培養基,以無菌PBS清洗細胞1次后,用200 μL槍頭沿孔直徑筆直劃痕,用無菌PBS洗細胞3次,去除劃下的細胞,加入無血清培養基,常規培養,分別在0、12、24 h觀察、拍照。
1.4 統計學處理
所得數據用表示,應用SPSS 11.5軟件包進行統計學分析,兩樣本均數間比較采用配對t檢驗,組間差異采用單因素方差分析(One Way ANOVA),差異顯著者采用LSD-t檢驗進行兩組間比較,P<0.05為差異有統計學意義。
2 結 果
2.1 HDAC5在肺癌組織標本中的表達
Real-time RT-PCR結果顯示,28例組織標本中有20例肺癌組織中HDAC5 mRNA表達低于癌旁組織,其余8例HDAC5 mRNA表達稍微升高或無明顯差異(圖1)。Western blot檢測NSCLC及癌旁組織HDAC5蛋白表達情況,結果顯示,與癌旁組織相比,肺癌組織中HDAC5的蛋白表達明顯降低(圖2),其表達趨勢與mRNA表達一致,提示HDAC5在NSCLC中的低表達可能與NSCLC的發生、發展相關。
2.2 體外細胞轉染中轉染試劑與質粒的轉染比例篩選
分別以Fugene HD轉染試劑與質粒比例為 2∶2、4∶2、6∶2配制轉染復合物,轉染NCI-H1299細胞,如圖3所示,3種比例的轉染試劑都成功將HDAC5wt基因轉入目的細胞,其中4∶2組轉染效率明顯高于2∶2組,即前者HDAC5蛋白表達量高于后者;而6∶2組質粒轉染后,HDAC5蛋白表達量與4∶2組相近。因此,采用Fugene HD轉染試劑∶質粒=4∶2的轉染比例進行后續相關研究。

2.3 基因過表達鑒定
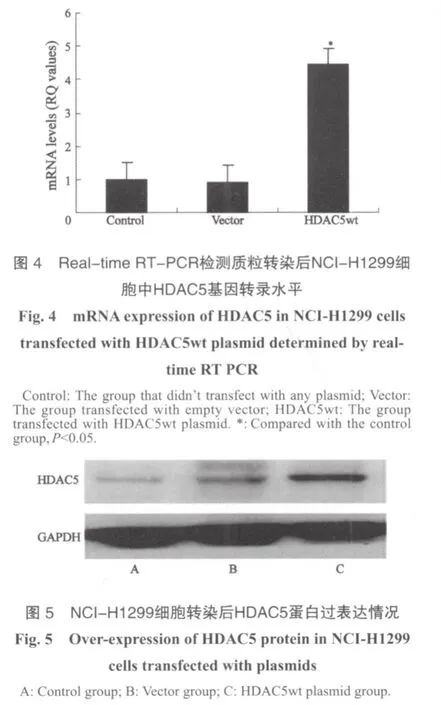
分別將HDAC5wt質粒及空質粒轉染入NCI-H1299細胞后,用G418進行篩選,形成穩定表達株。與未轉染組及空質粒組相比,HDAC5wt組細胞中HDAC5的轉錄水平顯著提高(圖4),蛋白表達量明顯增加(圖5)。
2.4 HDAC5基因對H1299細胞增殖的影響
采用MTT法檢測control、vector、HDAC5wt質粒轉染3組細胞增殖情況,細胞貼壁后3組細胞初始D490值無統計學差異,表明3組細胞接種數量一致。在24 h時,3組間D490無統計學差異;在第2~5 天對數生長期內實驗組細胞D490值較正常對照組及陰性對照組顯著降低,而正常對照組與陰性對照組之間D490在同一檢測時間點無顯著性差異(圖6)。

2.5 HDAC5過表達對H1299細胞遷移的影響
我們采用Transwell檢測HDAC5基因對H1299細胞跨膜遷移能力的影響。結果顯示,實驗組(158.3±19.4)跨膜遷移細胞數顯著低于正常對照組(247.0±12.1)及陰性對照組(236.0±14.9,P均<0.05),而正常對照組與陰性對照組間穿膜細胞數無顯著差異,提示HDAC5過表達抑制了NCI-H1299細胞跨膜遷移能力。
同時,我們采用劃痕實驗直觀地觀察HDAC5基因對H1299細胞遷移能力的影響。結果如圖7所示,與初始劃痕寬度相比,在24 h內3組細胞的劃痕都有不同程度的愈合。HDAC5組細胞在24 h時劃痕愈合程度明顯低于其他兩組,表明該組細胞的遷移能力低于其他兩組,從另一個角度證實了HDAC5基因過表達抑制NCI-H1299細胞遷移。
3 討 論
HDACs和HATs在腫瘤細胞基因轉錄調控中起重要作用。HDACs使組蛋白去乙酰化后恢復帶正電荷的特性,并與帶負電的DNA緊密結合,染色質呈致密卷曲的阻抑結構,從而抑制基因轉錄;HATs通過在組蛋白的N-端賴氨酸殘基上引入乙酰基,促進基因轉錄。兩者在體內處于一個動態平衡,共同參與基因的表達調控。一旦這種平衡破壞,細胞便異常增殖、分化,最終導致腫瘤的發生發展。HDACs在不同腫瘤中存在差異性表達,其中大多數亞型在多種腫瘤中呈高表達狀態:HDAC1在肺癌、前列腺癌、胃癌、結腸癌和乳腺癌中高表達[3],HDAC2在胃癌、結直腸癌和宮頸癌中高表達[4-5];目前僅發現HDAC5在多種腫瘤中低表達。Osada等[6]報道HDAC5基因表達與NSCLC預后顯著相關,HDAC5表達降低的患者其預后較差。本研究檢測了HDAC5在28例NSCLC組織及相應癌旁組織中的表達,結果證實HDAC5在癌組織較對應的癌旁組織表達明顯降低,提示HDAC5基因的低表達可能在NSCLC的發生、發展中起重要作用。Urbich等[7]的研究表明HDAC5抑制血管形成,因此推測HDAC5可能與肺癌的轉移相關。

將HDAC5質粒轉染至人肺腺癌細胞NCI-H1299,分別采用Transwell方法研究細胞跨膜遷移能力、采用劃痕方法研究細胞側向遷移能力,結果表明,HDAC5基因過表達抑制H1299細胞遷移。由于在24 h時過表達HDAC5基因并未影響H1299細胞的增殖能力,因此排除了細胞遷移研究中因過表達HDAC5基因后細胞增殖差異對跨膜遷移細胞量及劃痕愈合能力的影響,從而證實HDAC5基因抑制H1299細胞遷移。
HDAC5蛋白上有多個基序:核定位信號基序(NLS)、出核信號基序(NES)、C-末端結合蛋白基序(CtBP)、肌增強子2結合基序(MEF2)、14-3-3伴侶蛋白結合基序、酶活性區域(DAC)等,HDAC5在不同的生理病理過程中發揮不同作用,參與這一過程的基序有所差異。HDAC5被磷酸化后可以在細胞核和細胞質之間穿梭運動。Urbich、Roy等[7-8]研究表明,HDAC5及其磷酸化后的核定位在腫瘤細胞的增殖、血管內皮細胞的遷移過程中起重要作用。而多種因素參與或影響HDAC5的磷酸化及其核質轉運過程,如血管內皮生長因子(VEGF)、Ga13蛋白、血管緊張素Ⅱ(AngⅡ)、流體剪切力等[9-11]。然而HDAC5抑制NCI-H1299細胞遷移是否與其磷酸化后的核定位或核質轉運相關尚需進一步探討。
綜上,本研究結果顯示HDAC5基因在NSCLC中低表達;HDAC5基因過表達后抑制H1299細胞遷移,提示HDAC5基因可能參與NSCLC的轉移,為NSCLC患者晚期轉移的防治提供一種新的思路,為抑制腫瘤細胞轉移提供一個新的靶點。
[1]叢蕾, 崔言剛, 王濰博.晚期非小細胞肺癌化療預后因素的COX回歸分析[J].中國癌癥雜志, 2009, 19(4): 280-283.
[2]Verdel A, Khochbin S.Identification of a new family of higher eukaryotic histone deacetylases.Coordinate expression of differentiation dependent chromatin modifiers [J].J Biol Chem, 1999, 274(4): 2440-2445.
[3]Halkidou K, Gaughan L, Cook S, et al.Upregulation and nuclear recruitment of HDAC1 in hormone refractory prostate cancer [J].The Prostate, 2004, 59(2): 177-189.
[4]Huang BH, Laban M, Leung CH, et al.Inhibition of histone deacetylase 2 increases apoptosis and p21Cip1/WAF1 expression,independent of histone deacetylase 1 [J].Cell death and differentiation, 2005, 12(4): 395-404.
[5]Hrzenjak A, Moinfar F, Kremser ML, et al.Valproate inhibition of histone deacetylase 2 affects differentiation and decreases proliferation of endometrial stromal sarcoma cells[J].Molecular cancer therapeutics, 2006, 5(9): 2003-2010.
[6]Osada H, Tatematsu Y, Saito H, et al.Reduced expression of class II histone deacetylase genes is associated with poor prognosis in lung cancer patients [J].Int J Cancer, 2004,112(1): 26-32.
[7]Urbich C, R?ssig L, Kaluza D, et al.HDAC5 is a repressor of angiogenesis and determines the angiogenic gene expression pattern of endothelial cells [J].Blood, 2009, 113(22):5669-5679.
[8]Roy S, Shor AC, Bagui TK, et al.Histone Deacetylase 5 Represses the Transcription of Cyclin D3 [J].J Cell Biochem, 2008, 104(6): 2143-2154.
[9]Ha CH, Wang W, Jhun BS, et al.Protein kinase D-dependent phosphorylation and nuclear export of histone deacetylase 5 mediates vascular endothelial growth factor induced gene expression and angiogenesis [J].J Biol Chem, 2008,283(21): 14590-14599.
[10]Liu G, Han J, Profirovic J, et al.Galpha13 regulates MEF2-dependent gene transcription in endothelial cells: role in angiogenesis [J].Angiogenesis, 2009, 12(1): 1-15.
[11]Wang W, Ha CH, Jhun BS, et al.Fluid shear stress stimulates phosphorylation dependent nuclear export of HDAC5 and mediates expression of KLF2 and eNOS [J].Blood, 2010,115(14): 2971-2979.

