乳腺癌保乳術后切線野照射與瘤床同步整合補量調強放射治療的劑量學區別
李楠,李光,趙欣宇,張碩,夏兵,王志宇
(中國醫科大學1.附屬第一醫院放療科,沈陽 110001;2.94期七年制臨床醫學專業,沈陽 110001)
近年來,調強放射治療(intensity modulated radiation therapy,IMRT)技術被越來越多的應用于乳腺癌保乳術后放射治療中,許多研究表明IMRT可以降低心、肺、對側乳腺的受照射體積及劑量,并能夠提高靶區內劑量分布均勻性。但以往國內外對IMRT如何進行瘤床補量研究的報道較少,而在早期浸潤性乳腺癌的治療中,瘤床補量有助于提高腫瘤的局部控制率[1]。本研究利用三維治療計劃系統比較保乳術后瘤床同步整合補量的調強放射治療(simultaneous integrated boost intensity-modulated radiation therapy,SIB-IMRT)技術,與切線野照射后程電子束補量技術在靶區劑量學方面的差異,評估SIB-IMRT在乳腺癌保乳術后放射治療中的意義。
1 材料與方法
1.1 病例選擇
2007年3 月~2009年1月間中國醫科大學附屬第一醫院放療科收治的45例乳腺癌保乳術后患者。年齡42~68歲,中位年齡54歲。病理類型:導管內癌3例,浸潤性導管癌39例,粘液腺癌3例。根據2002年AJCC(第6版)乳腺癌分期標準,Tis3例,T1 30例,T2 12例。腫瘤原發部位:24例患者位于左側乳房,其中6例位于外上象限,6例位于內上象限,11例位于外下象限,1例位于內下象限;21例患者位于右側,其中13例位于外上象限,2例位于外下象限,6例位于內上象限。所有病例均于術后一個月內1~2個周期化療后開始放療。
1.2 放射治療定位和圖像采集
患者仰臥位固定于乳腺托架及真空墊上,兩臂180°上舉,握住乳腺托架。體表用金屬標記定位點、患側乳腺范圍及手術疤痕范圍。平靜呼吸狀態下使用螺旋CT進行掃描,層厚5 mm,掃描范圍包括雙側全肺和乳腺,上界包含鎖骨上區,通過網絡傳輸到ADACpinnacle3治療計劃系統。
1.3 臨床靶區、計劃靶區及危及器官的定義
將術后完整乳腺組織、胸肌間淋巴結和乳房下的胸壁淋巴引流區定義為低危臨床靶區(CTV1),前界在皮膚表面下0.5 cm,后界包括腺體下胸壁;將瘤床區定義為高危臨床靶區(CTV2),即CT掃描時所顯示的銀夾標記的瘤床范圍,對于術中未行銀夾標記瘤床區的患者,按術前腫瘤解剖位置、CT掃描顯示的術后殘腔及手術疤痕來確定CTV2。PTV1為CTV1在頭腳方向、乳腺內側向胸骨方向、外側向腋窩方向各外放1 cm,胸壁內側向肺方向外放0.5 cm,皮膚方向不進行外放獲得;PTV2為CTV2在各方向外放1 cm獲得。將同側肺、對側乳腺及左側乳腺癌患者的心臟作為危及器官(OARs),勾畫出對側乳腺及心臟的外輪廓,利用系統軟件自動生成雙肺輪廓。
1.4 治療計劃的制定
利用ADAC公司pinnacle3治療計劃系統,進行切線野后程電子線補量治療計劃和逆向SIB-IMRT治療計劃的設計。在2種計劃中,CTV1處方劑量為50 Gy,單次 2.0 Gy;CTV2 處方劑量為 60 Gy,單次劑量2.4 Gy。切線野治療計劃采用乳腺對穿切線野源皮距方式照射:旋轉機架找到最合適的切線野入射角度,調整準直器角度,使PTV1在射野方向觀上投射的體積最小,調整射野大小,使射野在PTV1上下及后方各擴大1 cm,前界在乳腺皮膚表面外再露空1.5 cm,外加15°楔形板,使靶區內劑量均勻,兩射野中心點連線的中點定義為劑量參考點;后程電子線補量采用單野照射,機架角垂直于瘤床,使射線束通過乳腺的路徑最小,射野中心軸與瘤床后界的交點定義為電子線補量的劑量參考點,根據病人瘤床深度選擇9~12MeV電子線照射。SIB-IMRT計劃設計采用非共面的三野等中心照射,轉換后的子野數約30個。切線野計劃中的兩切線野及SIB-IMRT計劃均使用Siemens Primus-M直線加速器的6MV-X線,SIB-IMRT采用MLC靜態調強技術。
1.5 評估指標與統計學方法
分別在2種計劃的劑量體積直方圖上獲得以下數據:(1)PTV1:95%處方劑量覆蓋的靶區體積(V95%-PTV1),最大劑量(Dmax),最小劑量(Dmin)。(2)PTV2:95%處方劑量覆蓋的靶區體積(V95%-PTV2)。(3)心臟(左乳癌患者):平均劑量(Dmean),最大劑量(Dmax),10%體積所受到照射的劑量D10。(4)同側肺:平均劑量(Dmean),受到大于等于20Gy劑量的體積百分比V20。5)對側乳腺:平均劑量(Dmean)。利用SPSS14.0統計軟件對2種照射方法得出的數據進行配對t檢驗。
2 結果
2.1 PTV1、PTV2的劑量分布
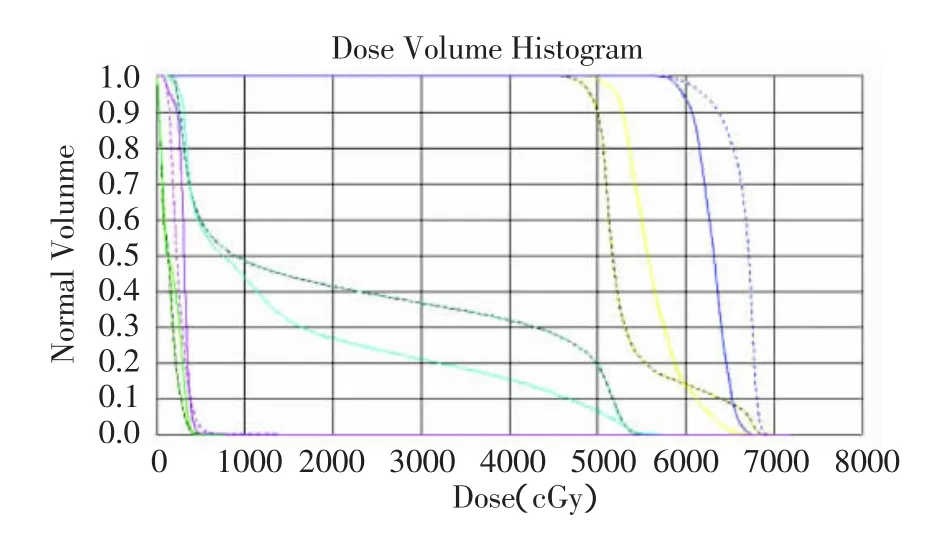
圖1 切線野照射與SIB-IMRT計劃DVH圖比較Fig.1 Comparison of conventional wedged tangential plan and IMRTplan of DVH
在 2種計劃中,PTV1、PTV2的靶區覆蓋率V95%相似,無統計學差異(P>0.05),均達到了至少95%的處方劑量包繞95%靶體積的要求。SIB-IMRT計劃中Dmax-PTV1平均劑量為7046.240 cGy,未明顯高于切線野計劃,且45例患者的最大劑量點均位于瘤床區內。Dmin-PTV1在2種計劃中相似,無明顯差異。見圖1及表1。
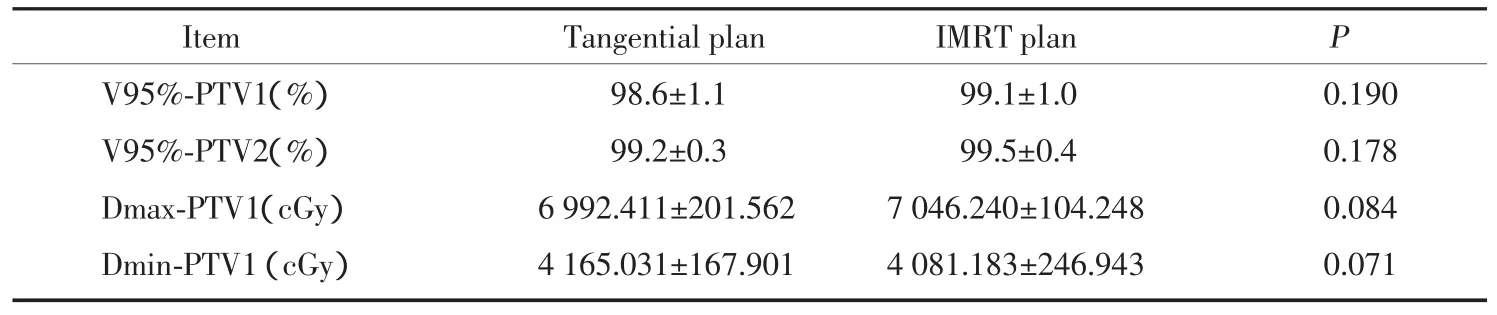
表1 切線野照射與SIB-IMRT計劃的PTV劑量學比較Tab.1 Comparison of conventional wedged tangential plan and IMRT plan of Dosimetry
2.2 OARs的劑量分布
與切線野計劃相比,SIB-IMRT技術中左側乳腺癌患者心臟Dmean減少了344cGy,10%體積所受到照射的劑量D10減少了1006cGy;同側肺Dmean減少了461cGy,V20降低了21.5%;對側乳腺Dmean減少了52.3 cGy。差異有統計學意義(P<0.05),見表2。
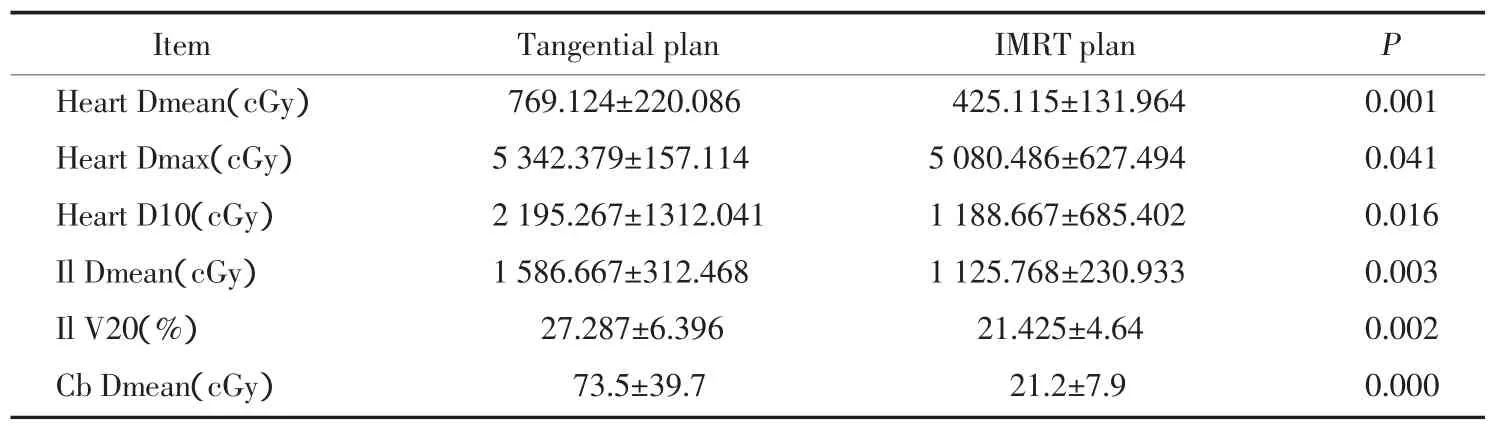
表2 切線野照射與IMRT的OARs劑量學比較Tab.2 Comparison of conventional wedged tangential plan and IMRT plan of OARs in Dosimetry
3 討論
經過許多前瞻性和回顧性的研究結論證實,保乳治療已經成為早期乳腺癌的一種標準治療方式[2,3]。目前保乳術后放射治療研究的熱點在于如何降低放射治療相關并發癥,特別是如何改善全乳靶區劑量分布的不均勻性,和降低心臟、肺、軟組織及對側乳腺等重要器官和組織的受照射劑量。劑量學研究結果顯示,在靶區覆蓋率(V95%)相似的前提下,IMRT技術無論是在提高靶區劑量分布均勻性方面,還是降低靶區內熱點劑量及體積方面,都明顯優于傳統切線野照射技術[4~7]。保乳術后的IMRT技術可采用2種模式:常規劑量分割的IMRT技術和瘤床同步整合補量的IMRT技術(SIB-IMRT)。前者是在全乳調強放療之后,再進行瘤床的補量,后者則是在全乳放療的同時實現瘤床加量減少了總的治療時間。SIB-IMRT技術已在治療其他部位腫瘤(如頭頸部腫瘤,前列腺癌等)中廣泛的應用,但在保乳術后放射治療中的應用報道較少見。
本研究中SIB-IMRT治療計劃的制定采用了三野照射的簡易調強技術,其理論優勢在于子野數少,單次放射治療時間短,提高了生物劑量,及可進一步減少因擺位誤差和呼吸運動引起的正常組織受量。有研究證明[8],乳腺靶區內的劑量分布均勻性差與乳腺組織纖維化有關,可直接影響到保乳治療后長期的美容效果。本研究通過對SIB-IMRT與切線野照射后程電子束補量技術進行劑量學上的比較,發現在保證了全乳靶區和瘤床區的覆蓋率同時,采取三野照射的SIB-IMRT計劃中全乳靶區的Dmax和Dmin,與切線野計劃比較沒有明顯差別,且最大劑量點均位于瘤床區內,與常規切線野照射技術相比,SIB-IMRT技術保持了與其相同的劑量均勻性。調強放射治療技術的另一主要目的是減少靶區周圍正常組織及重要器官的受照射劑量與容積,從而減少其放射損傷。保乳術后放射治療的一個并發癥是心血管系統疾病的損傷,有文獻報道采用呼吸門控結合IMRT技術,可進一步減少左側乳腺癌保乳術后放射治療患者心臟的受照射劑量與容積[9]。而本研究結果顯示,SIB-IMRT技術不需要使用呼吸門控技術,就可以有效地降低左側乳腺癌患者心臟Dmean、Dmax及D10,顯示出SIB-IMRT技術保護心臟方面的優越性。放射性肺損傷是乳腺癌保乳術后放射治療中另一主要的非致死性放射并發癥。本研究結果顯示,SIB-IMRT技術能減少同側肺的Dmean,及接受≥20 Gy照射的體積百分數V20。理論上可降低放射性肺炎,放射性肺纖維化的發生。目前研究對放射誘發對側乳腺第二腫瘤的發生率尚無定論。本研究顯示SIB-IMRT技術與切線野照射技術相比,SIB-IMRT技術的對側乳腺Dmean明顯減小,可能對減少放射誘發對側乳腺第二腫瘤的發生率有潛在意義。
臨床劑量學研究表明,乳腺癌保乳術后使用三野照射SIB-IMRT技術,在保證了靶區覆蓋率的同時,可降低心臟、肺、對側乳腺受照射劑量和容積,并減少了總的治療時間,在理論上可以期望減少OARs放射損傷發生率,從而進一步提高乳腺癌保乳治療患者的生活質量。但因受內臟運動、單次劑量和劑量率等因素的影響,SIB-IMRT技術的劑量學優勢有待體模及動物實驗研究證實。在劑量率相同的情況下,與切線野照射相比,SIB-IMRT增加了單次放療時間,其對于胸廓運動的影響導致的誤差,有待檢驗。SIB-IMRT技術的應用對于保乳術后患側乳房遠期美容效果的影響,尚需長期隨訪證實。
[1]Poortmans PM,Collette L,Bartelink H,et al.The addition of a boost dose on the primary tumour bed after lumpectomy in breast conserving treatment for breast cancer.A summary of the results of EORTC 22881-10882"boost versus no boost"trial[J].Cancer Radiother,2008,12(6-7):565-570.
[2]Fisher B,Anderson S,Bryant J,et al.Twenty-year follow-up of a randomized trial comparing total mastectomy,lumpectomy,and lumpectomy plusirradiation for the treatment of invasivebreast cancer[J].N Engl JMed,2002,347(16):1233-1241.
[3]Veronesi U,Cascinelli N,Mariani L,et al.Twenty-year follow-up of a randomized study comparing breast-conserving surgery with radical mastectomy for early breast cancer[J].N Engl J Med,2002,347(16):1227-1232.
[4]Vicini FA,Sharpe M,Kestin L,et al.Optimizing breast cancer treatment efficacy with intensity-modulated radiotherapy[J].Int JRadiat Oncol Biol Phys,2002,54(5):1336-1344.
[5]Donovan E,Bleakley N,Denholm E,et al.Randomised trial of standard 2Dradiotherapy(RT)versusintensity modulated radiotherapy(IMRT) in patients prescribed breast radiotherapy[J].Radiother Oncol,2007,82(3):254-264.
[6]Kestin LL,Sharpe MB,Frazier RC,et a1.Intensity modulation to improve dose uniformity with tangential breast radiotherapy:initial clinical experience [J].Int JRadiat Oncol Biol Phys,2000,48(5):1559-1568.
[7]Formenti SC,Gidea-Addeo D,Goldberg JD,et a1.Phase I-II trial of prone accelerated intensity modulated radiation therapy to the breast to optimally spare normal tissue [J].J Clin Oncol,2007,25(16):2236-2242.
[8]Freedman GM,Anderson PR,Li J,et al.Intensity modulated radiation therapy(IMRT)decreases acute skin toxicity for women receiving radiation for breast cancer[J].Am JClin Oncol,2006,29(1):66-70.
[9]Vingent MR,Vicini FA,Michael BS,et a1.Significant reduction in heart and lung doses using deep inspiration breath hold with active breathing control an d intensity modulated radiation therapy for patients treated with locoregional breast irradiation [J].Int JRadiat Oncol Biol Phys,2003,55(2):392-406.

