ERK1/2在AngⅡ誘導的血管內皮細胞凋亡中的表達及意義
單海燕,白小涓,李效麗
(中國醫科大學第一附屬醫院老年心血管科,沈陽 110001)
血管內皮功能受損是動脈粥樣硬化早期事件的始動環節,該損傷很可能是細胞凋亡增高所致[1,2]。細胞凋亡的信號轉導通路研究是凋亡研究最關鍵的領域之一[3],因此本研究旨在觀察血管緊張素Ⅱ(angiotensinⅡ,AngⅡ)誘導的內皮細胞中凋亡調控基因Bcl-2、Bax mRNA及細胞外信號調節激酶1/2(extracellar signal-regulated protein kinase,ERK1/2)在不同時點的表達變化,揭示血管內皮細胞凋亡的分子調控機制,從而為延緩內皮細胞凋亡、防治動脈粥樣硬化開辟新途徑。
1 材料與方法
1.1 材料
RPMI 1640培養基、胰蛋白酶﹑HEPES、L-谷氨酰胺(Gibco公司,美國),人臍靜脈內皮細胞株(human umbilical vein endothelial cell,HUVEC)(ATCC,美國),AngⅡ、二甲基亞砜(dimethyl sulphoxide,DMSO)﹑Hochest33258(Sigma公司,美國),兔抗人Bcl-2、Bax單克隆抗體非免疫血清、兔抗人ERK1/2單克隆抗體非免疫血清、生物素二抗、辣根酶標記的鏈霉親和素(HRP-Streptaridin)試劑(Santa Cruz公司,美國),流式細胞儀 FACScan(BD 公司,美國),熒光顯微鏡(Olympus公司,日本),Biophotometer分光光度儀(Eppendort公司,德國),GeneAmpPCR System9700擴增儀(PE公司,美國),UVP凝膠成像及分析系統(UVP公司,英國)。
1.2 方法
1.2.1 HUVEC培養:使用含10%胎牛血清的RPMI 1640培養基培養HUVEC貼壁生長,置于5%CO2、37℃、完全飽和濕度的培養箱中,每2~3 d換液1次。用0.25%胰蛋白酶進行消化﹑傳代。2%臺盼藍染色判斷細胞活性,活細胞數占細胞總數98%以上者用于實驗。
1.2.2 四甲基偶氮唑藍比色(MTT)法測定細胞活性:將細胞接種于每孔含100μL培養液的96孔培養板中(1×104/孔),培養過夜;棄培養液,對照組(6孔)每孔加入100μL培養液,實驗組(6孔/組)加入含不同濃度(10-8﹑10-7﹑10-6﹑10-5﹑10-4mol/L)AngⅡ的100μL 培養液,培養 24 h;加入 MTT 10μL/孔,培養4 h;棄培養液,加入DMSO 150μL/孔,振蕩搖勻,使結晶充分溶解;酶聯免疫檢測儀在570 nm下測定各孔光吸收值,以實驗組與對照組光吸收值的百分比代表存活細胞的百分數。
1.2.3 內皮細胞凋亡形態學觀察:細胞長至亞融合后,無血清同步6 h,加入AngⅡ(終濃度為10-6mol/L),持續刺激24 h。將細胞分為對照組(不含AngⅡ的培養液培養24 h)和AngⅡ組(含AngⅡ的培養液培養24 h)。收集細胞,常規涂片固定,Hoechst33258染色后封片。熒光顯微鏡觀察,照相。鏡下隨機選取6個視野,計數凋亡細胞和總細胞數,計算凋亡百分率=凋亡細胞數/總細胞數×100%。
1.2.4 內皮細胞凋亡定量:收集1×106個細胞,1 000 r/min離心,PBS洗2次,重懸細胞于200μL的1×結合緩沖液,加入10μLAnnexin V-FITC和5μL PI混勻,室溫避光15 min。加入300μL 1×結合緩沖液,1 h內流式細胞儀檢測早期凋亡細胞數,用Cell Quest軟件分析結果。
1.2.5 Bcl-2、Bax細胞免疫化學染色:將細胞接種于6孔培養板中的潔凈蓋玻片上,分組干預后,PBS洗細胞,采用SP法進行免疫組化染色,DAB顯色,常規脫水、透明、封固。在200倍的光鏡視野下觀察到胞質或胞核有棕色顆粒者為陽性細胞,計數每個高倍視野中100個細胞中Bcl-2、Bax陽性細胞個數,每張切片中采集5個視野并求均值,得出陽性細胞百分率及Bcl-2/Bax值(BB值)[4]。
1.2.6 Western blot檢測ERK1/2蛋白水平:收集細胞,冷PBS洗2次,加入預冷細胞裂解液,超聲破碎,冰上孵育提取物30 min,4℃、12 000 r/min離心10 min,取上清液至新試管中,再離心1次,取上清分裝,-20℃保存待用。考馬斯亮藍法測蛋白濃度。參照文獻[13]進行Western blot,蛋白電泳分離膠濃度為 12%(pH8.8),濃縮膠濃度 4%(pH6.8),抽提純化的蛋白(每個樣品20μL)行SDS-PAGE電泳,轉移至PVDF膜,5%脫脂奶粉的TBST 4℃封閉過夜,加入兔抗人ERK1/2一抗(1︰100)室溫孵育3 h,TBST洗滌,加入二抗室溫孵育0.5 h,洗膜,化學發光試劑顯色。AlphaImager圖像處理系統進行定量分析,設對照組顯影帶灰度值為1,各不同時間組與其灰度值之比即為該組的相對活性。
1.3 統計學分析
采用SPSS13.0軟件進行統計學分析,計量資料以x±s表示,采用單因素方差分析(ANOVA)進行比較,P<0.05為差異有統計學意義。
2 結果
2.1 細胞存活率
MTT法檢測結果示,培養HUVEC 24 h后,10-7mol/L與10-8mol/L AngⅡ組細胞存活率與對照組相比無統計學差異,10-6mol/L組存活細胞數降至對照組的(87.6±0.09)% (P<0.01),10-5mol/L 和 10-4mol/L組存活細胞數降至(45.6±0.08)%(P<0.01)。本實驗選用10-6mol/L的AngⅡ建立了HUVEC的凋亡模型。
2.2 凋亡HUVECs的細胞核形態學變化
Hochest33258熒光染色顯示,正常HUVEC細胞核邊界整齊,染色質分布均勻,呈現體積較大的淺染核形態(圖1A);AngⅡ誘導HUVEC則表現為細胞核呈濃染致密顆粒狀、塊狀熒光,出現不同程度的核固縮,呈現體積明顯縮小的深染核形態(圖1B)。
2.3 AngⅡ對細胞凋亡率的影響

圖1 正常組與AngⅡ誘導組HUVECs的形態學變化Hoechst33258染色×400Fig.1 HUVECs stained with Hoechst33258×400
流式細胞儀檢測結果表明,AngⅡ誘導HUVEC平均凋亡率為(37.4±1.6)%,較正常對照組[(10.2±1.8)%]顯著升高,差異有統計學意義(P<0.01),但2組間的細胞壞死率無統計學差異。
2.4 AngⅡ作用時間對Bcl-2、Bax表達的影響
細胞免疫化學染色法結果顯示,HUVEC在AngⅡ作用下,12 h時Bcl-2表達開始減少,隨著時間的延長其表達呈遞減趨勢,24 h時減少41.9%(P<0.01);而Bax的表達則于12 h時開始增加,隨著時間的延長呈遞增趨勢,24 h增加68.2% (P<0.01);Bcl-2/Bax比值于12 h時開始呈明顯下降趨勢(P均<0.01)。見表 1。
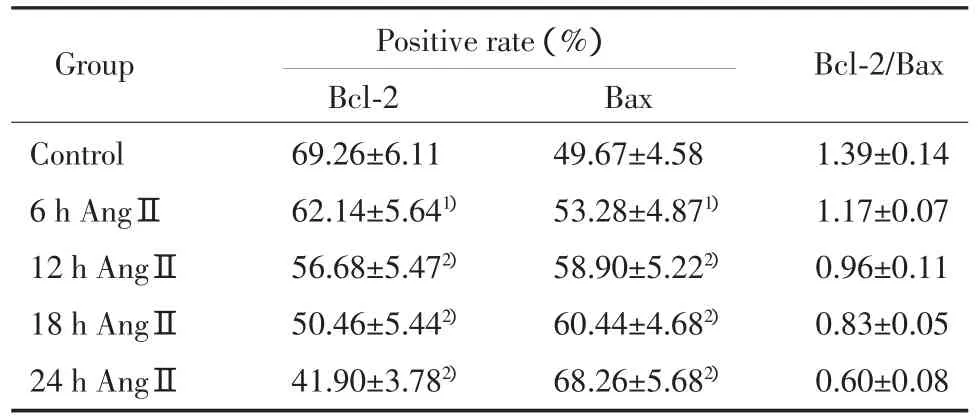
表1 各組HUVECs的Bcl-2、Bax的表達及Bcl-2/Bax的比較Tab.1 Expression of Bcl-2,Bax protein in immunocytochemistry staining and Bcl-2/Bax of HUVEC in each group
2.5 AngⅡ對ERK1/2表達的影響
Western blot結果顯示,隨著AngⅡ作用時間的延長,HUVEC內ERK蛋白質磷酸化水平逐漸升高,12 h時達對照組的1.42倍(P<0.05),18 h時ERK蛋白磷酸化水平達高峰,為對照組的3.68倍(P<0.01),之后逐漸下降,但仍高于對照組,24 h時磷酸化水平為對照組的1.79倍(P<0.05)。2組內皮細胞中總ERK1/2蛋白表達差異無統計學意義。見圖2。

圖2 各組HUVECs ERK1/2蛋白表達的Western blot結果Fig.2 Western blot analysis of ERK1/2 protein expressions of HUVECs in each group
3 討論
細胞外對外界刺激的調節反應是通過細胞內信號轉導通路對信號的快速傳遞來實現的。絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號轉導通路是生物體內重要的信號轉導系統之一[5,6],其中 ERK1/2 信號轉導通路屬于 MAPK 家族[7,8],它在炎性細胞應激、凋亡、細胞周期和生長等多種生理和病理過程中起重要作用。大量研究證實,當各種因素(如壓力負荷、腎上腺素、AngⅡ等)激活后,ERK1/2將信號從細胞外傳遞至細胞內,并發生磷酸化,迅速穿過核膜作用于下游的信號分子[9~11],引起特定蛋白的表達或活性改變,從而參與細胞的基因表達、遷移、分化、凋亡和增殖調控作用[6,8,12]。本研究發現,AngⅡ能顯著增加 HUVEC 內ERK1/2磷酸化,提示AngⅡ可激活HUVEC的pERK1/2通路,但該途徑通過哪些蛋白發揮凋亡作用尚未知。
凋亡相關基因Bcl-2能夠抑制細胞凋亡,Bax基因是Bcl-2家族的一員,其產物是一種與Bcl-2同源的相關蛋白,能夠拮抗后者的生物學活性[13]。Bax的主要作用是加速細胞凋亡,并與Bcl-2一起調節細胞凋亡。Bax不僅能和Bcl-2形成異源二聚體抑制凋亡,而且其自身還能形成同源二聚體誘導凋亡[9,13,14]。研究表明,Bcl-2 及 Bax 二者間的比例對于細胞、組織的影響較絕對量更為重要,是決定細胞凋亡與否的關鍵因素。Bcl-2、Bcl-xl等抗凋亡蛋白和Bax、Bad等促進凋亡的蛋白的相對比率決定了細胞多種凋亡刺激信號的最終敏感性和抵抗性。本研究結果發現,隨著AngⅡ誘導HUVEC時間的延長,Bcl-2表達水平下降,Bcl-2/Bax比值顯著降低,同時還發現Bcl-2降低與p-ERK1/2表達增加呈相關性,且Bcl-2/Bax比值與p-ERK1/2表達呈相反趨勢,提示p-ERK1/2與Bcl-2之間可能存在相互調節關系。由此我們推測在AngⅡ誘導HUVEC的早、中期(6、12 h)顯著激活了ERK1/2信號轉導通路,且ERK1/2的表達隨誘導時間延長,于12 h時明顯上升,18 h達高峰,24 h下降至穩定,表明隨著AngⅡ持續作用于血管內皮細胞時間延長,其對已發生表型改變HUVEC中ERK信號通路的激活作用已開始增強,同時研究進一步顯示,磷酸化ERK1/2表達呈持續增加時,Bcl-2及Bcl-2/Bax比值呈顯著下降趨勢,表明ERK1/2信號途徑可能通過調控Bcl-2/Bax參與HUVEC凋亡。雖然發現ERK1/2可作為上游信號參與調節Bcl-2,但是p-ERK如何調節Bcl-2目前尚不清楚,其作用環節仍有待進一步研究。
[1]Mannarino E,Pirro M.Endothelial injury and repair:a novel theory for atherosclerosis[J].Angiology,2008,59(2 Suppl):69S-72S.
[2]Eriksson EE.Atherosclerosis:cell biology and lipoproteins[J].Curr Opin Lipidol,2007,18(4):476-478.
[3]Liu J,Mao W,Ding B,et al.ERKs/p53 signal transduction pathways is involved in doxorubicin-induced apoptosis in H9c2 cells and cardiomyocytes [J].Am Jphysical Heart Cir physical,2008,295(5):H1956-H1965.
[4]Boda K,Kalman J,Janka Z.Application of repeated measurement ANOVA modelsusing SASand SPSS:examination of the effect of intravenous lacate infusion in Alzheimer’s disease [J].Stud Health Inform,2002,90(11):437-438.
[5]Lawrence MC,Jivan A,Shao C.The roles of MAPKs in disease[J].Cel Res,2008,18(4):436-442.
[6]Heo K,Park KA,Kim YH,et al.Sphingosine 1-phosphate induces vascular endothelial growth factor expression in endothelial cells[J].BMBRep,2009,42(10):685-690.
[7]Shepherd RD,Kos SM,Rinker KD.Long term shear stress leads to increased phosphorylation of multiple MAPK species in cultured human aortic endothelial cells[J].Biorheology,2009,46(6):529-538.
[8]Kim JY,Kim WJ,Kim H,et al.The Stimulation of CD147 Induces MMP-9 expression through ERK and NF-kappaB in macrophages:implication for atherosclerosis [J].Immune Netw,2009,9(3):90-97.
[9]Yan L,Tang Q,Shen Q,et al.SOCSinhibits TNF-alpha-induced cardiomyocyte apoptosisvia ERK1/2 pathway activation[J].Inflammation,2008,31(3):180-188.
[10]Shan HY,Bai XJ,Chen XM.Apoptosis is involved in the senescenceof endothelial cells induced by angiotensin[J].Cell Biol Int,2008,32(4):264-270.
[11]Lee YH,Marquez AP,Mungunsukh O,et al.Hepatocyte growth factor inhibits apoptosis by the profibrotic factor angiotensin IIvia extracellular signal-regulated kinase 1/2 in endothelial cells and tissueexplants[J].Mol Biol Cell,2010,21(23):4240-4250.
[12]Kim MK,Park HJ,Kim SR,et al.Angiogenic role of orexin-A via the activation of extracellular signal-regulated kinase in endothelial cells[J].Biochem Biophys Res Commun,2010,403(1):59-65.
[13]單海燕,白小涓,陳香美.衰老大鼠動脈順應性與凋亡相關指標變化及纈紗坦對其影響[J].中國動脈硬化雜志,2007,15(9):657-660.

