胃腸間質瘤CT表現及預測腫瘤惡性程度的分析
李玉林于 昭程亞寶廖志東吳海軍
胃腸間質瘤 (gastrointestinal stromal tumor,GIST)是一類獨立來源于胃腸道間葉組織的非定向分化腫瘤,部分伴有平滑肌或神經鞘細胞的不完全分化[1],以酪氨酸激酶CD117和CD34過度表達為其特點,臨床發病率較低,術后復發率高,對放化療敏感性不強。CT是目前公認的診斷GIST的主要影像學方法,對腫瘤定位、定性較明確,能指導臨床治療及隨訪[2-4]。筆者回顧分析我院2006年3月至2010年6月手術病理證實45例GIST的16層CT資料,旨在探討胃腸道間質瘤的多層螺旋CT表現與惡性程度間的相關性,指導臨床實踐。
方 法
1.臨床資料
回顧分析45例經手術、病理和免疫組織化學證實的G IST完整臨床及16層CT平掃、增強資料。男性28例 、女性17例,年齡 28~75歲 ,平均 60.2歲。主要臨床表現為腹痛 21例,黑便 12例,腹部包塊 4例,體檢發現8例。
2.檢查方法
患者檢查前禁食6h,掃描前口服1000m l水。采用德國Siemens Sensation 16CT機。患者仰臥位,平掃:電壓120kV、電流160mAs,準直器寬度1.5cm,螺距1,分別以2mm層厚/1mm層距,6mm層厚/6mm層距軸位及MPR重建。增強:高壓注射器自肘動脈推注碘海醇350mg/ml注射液100m l,速度3m l/s,延遲30s、60s、3min 掃描,電壓 120kV 、電流 160mAs,準直器寬度0.75cm,螺距1~1.5,分別以0.75mm層厚、0.27mm層距,6mm層厚、6mm層距軸位重建、MPR。由兩名高年資主治醫師分析觀察CT征象,二者意見一致時確認結果,二者意見不一致時由第三位主治醫師裁決。三者均對患者的病理診斷結果不知情。
3.CT征象評價指標
本組病例根據N IH提出的惡性程度分級標準(2008版)[5],分為高度惡性、中度惡性、低度惡性和極低惡性。CT表現主要觀察腫瘤部位、大小、形態、輪廓、強化方式、壞死情況、生長方式、轉移灶。增強掃描同部位同層面CT值變化小于10Hu,認為壞死,增強峰值CT值 <20Hu為輕度強化,>20Hu為中度或明顯強化。
4.統計學處理
采用SPSS13.0統計軟件進行Fishers-exact test檢驗,P<0.05差異有統計學意義。
結 果
1.GIST的CT表現

圖 1 胃體部極低惡性間質瘤。直徑約 1.8cm,均勻中等強化,門脈期強化明顯、邊界清晰,無壞死、分葉,腔內生長。

圖 2 胃底部低度惡性間質瘤。明顯強化,密度均勻,邊界清晰,無分葉,大小約 2.5cm,跨壁生長。圖3小腸中度惡性間質瘤。大小約7.5cm,不均勻中等程度強化,可見壞死,邊界清晰,無明顯分葉,外生性。
胃部間質瘤 25例、小腸13例、直腸1例、腹腔腸系膜4例、部位不明確2例,有1例胃間質瘤見腸系膜轉移,有1例小腸間質瘤見肝轉移。45例中極低惡性組(圖 1)8例,來源于胃5例、小腸 3例,最大者直徑約2.0cm,最小者約1.1cm,平均直徑1.6cm,均呈類圓形腫物,輪廓均清晰,2例可見淺分葉改變,3例輕度強化,其余均為中度以上強化,1例可見中心輕度壞死,內生3例、外生4例、跨壁生長1例。低度惡性組(圖2)10例中各4例來源于胃及小腸,2例來源于腹腔腸系膜,最大者直徑約7.3cm,最小者直徑2.2cm,平均直徑4.7cm,一半可見分葉,8例輪廓清晰,有2例和胃腸道壁邊界欠清,絕大多數(80%)呈中等程度以上強化,有5例可見輕度壞死,1例中度壞死,有5例為內生。中度惡性組(圖3)13例中9例來源于胃、3例來源于小腸、1例來源于腹腔腸系膜,最小的約4.6cm,最大10cm,平均 7.1cm,9例可見分葉(占69.2%),有6例邊界不清晰,大多數中度以上強化(占76.9%),10例出現壞死(76.9%),以外生和跨壁生長為主,有1例出現腸系膜轉移灶。高度惡性組(圖4,5)14例中7例來源于胃、3例來源于小腸、1例來源于腹腔腸系膜、1例來源于直腸、2例因腫物大并周邊侵犯明顯而不能明確來源,最小的約 4.9cm,最大 16.5cm,平均12.7cm,12例可見分葉(占85.7%),有10例邊界不清晰,其中4例周圍侵犯,絕大多數中度以上強化(占92.9%),均出現壞死,以外生和跨壁生長為主(85.7%),有1例出現肝轉移灶(圖6)。本組45例病例中可見有2例出現腹水,均伴有轉移或明顯周邊侵犯,增強掃描,36例病例多期掃描均可見呈逐漸強化特點,門靜脈期及延遲期強化明顯。
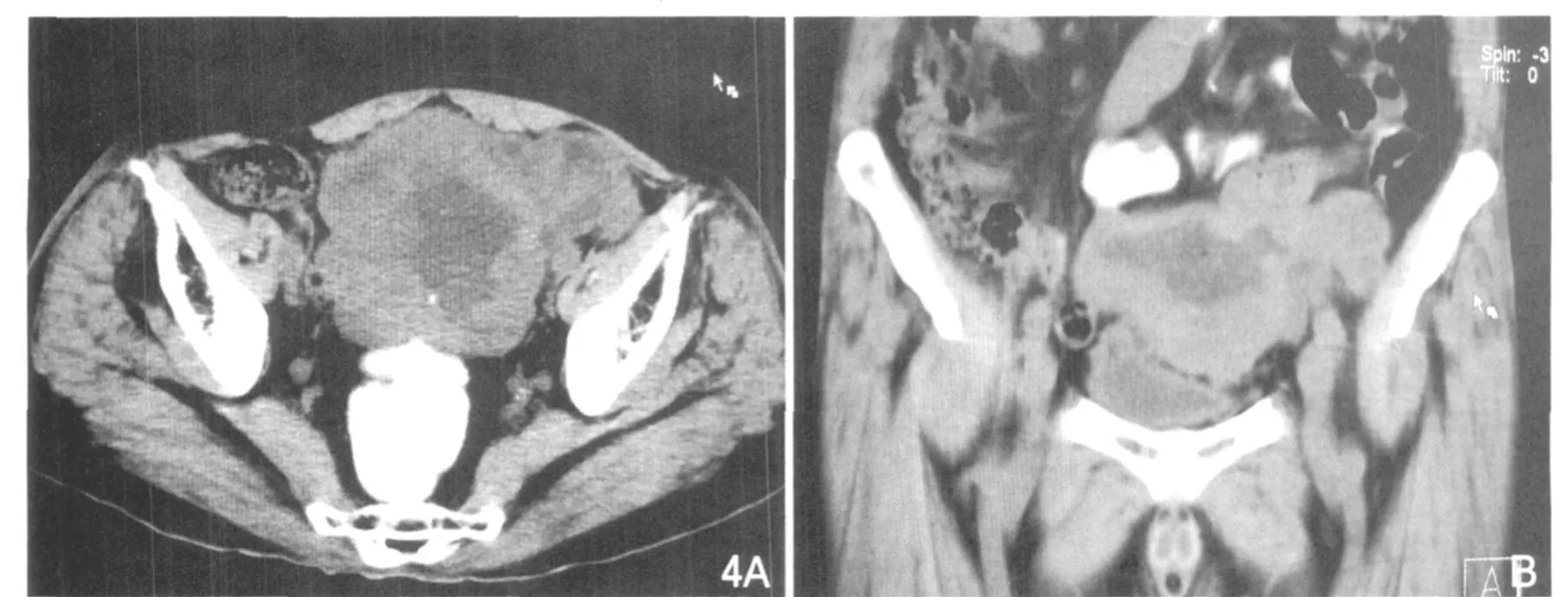
圖4 小腸高度惡性間質瘤。A.大小10.5cm,可見分葉、壞死明顯,外生性,部分邊界不清。B.為MPR圖像。

圖5 直腸高度惡性間質瘤。大小約8.3cm,中等程度強化,可見壞死、邊界清晰,呈跨壁生長。圖6小腸高度惡性間質瘤肝轉移。
2.CT表現與病理分級的關系
CT表現與病理對照統計見表1。45例中極低惡性8例,低度惡性10例、中度惡性13例、高度惡性14例。病理 45例中CD117陽性 43例(95.6%),CD 34陽性39例(86.7%)。CT術前正確診斷43例,2例可疑診斷,在腫瘤部位、大小、形態輪廓、血供情況、壞死情況、生長方式、轉移灶方面均與手術相符。采用SPSS13.0統計軟件進行 Fisher′s exact test分析(P值見表1),腫瘤大小、形態、輪廓、生長方式、壞死情況與惡性程度差異有統計學意義(P<0.05),腫瘤部位、強化方式與惡性程度差異無統計學意義。
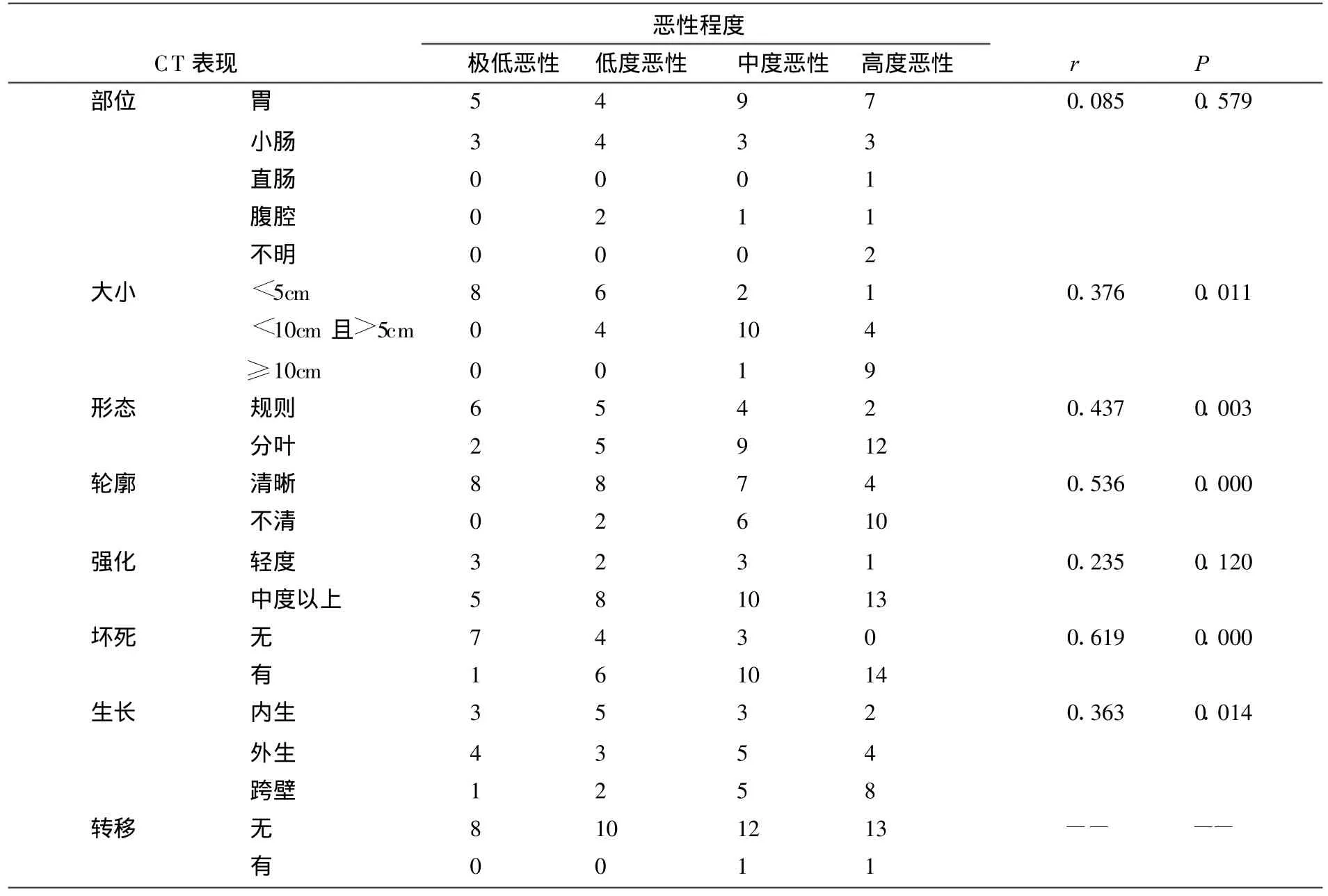
表1 CT表現與病理對照
討 論
198 3年M azur及Clark根據腫瘤分化特征首先提出胃腸間質瘤(GIST)這一概念。臨床不常見,占胃腸道腫瘤的1%~3%,主要發病于中老年人,男性略多于女性。本組病例中50歲以上者占33例(73.3%),男女比例約1.65。GIST可發生于消化道任何部位及消化道以外的部位。G IST患者臨床以腹痛、黑便、腹部包塊為主,部分無明顯臨床癥狀。GIST的診斷主要依靠病理免疫組化CD117、CD34陽性,Actin及S-100陰性或弱陽性確定。本組45例病理中CD 117陽性43例(95.6%),CD34陽性39例(86.7%)。
1.GIST的MSCT征象特點
腫瘤表現為軟組織腫塊,絕大多數可明確胃腸道來源,腫瘤最常見的部位是胃和小腸[6],其中胃最常見占全部G IST發病率的50%~70%,小腸來源占25%~35%,結直腸及食管少見[7]。本組胃來源占55.6%,小腸來源占28.9%。腫物較小時,邊緣清晰,較少出現壞死。腫物較大時多出現壞死,密度不均勻,常有分葉。腫物均可見不同程度強化改變以中度以上強化為主,腫物可多方式生長,外生多見,文獻也有同樣報道[8,9]。腫瘤可出現轉移,有轉移灶者可提示惡性程度較高(圖6),但轉移瘤出現較少,本組僅有2例轉移。MSCT可清晰顯示腫瘤大小、部位、邊緣、強化程度、壞死及生長情況,可通過多平面重組(MPR)多角度觀察腫瘤形態及周邊關系及供血情況,對診斷G IST的來源非常有價值,尤其是胃底部的腫瘤。G IST有時需要和其他疾病進行鑒別,主要與胃及小腸癌、淋巴瘤及平滑肌和神經纖維瘤等鑒別。胃部G IST主要位于胃底和胃體,相鄰胃壁結構一般較清晰,常較少引起梗阻,淋巴結轉移罕見,胃癌多位于胃體及胃竇部,梗阻常見,相鄰胃壁常受侵犯層次不清,常出現胃周淋巴結轉移。胃淋巴瘤多為繼發性,胃周及全身淋巴結多可腫大,胃壁廣泛增厚,壞死少見。平滑肌和神經纖維瘤與G IST鑒別較困難,平滑肌瘤多常見于食管,G IST則較少見。
2.CT表現與惡性程度相關性
目前普遍認為GIST均為惡性或潛在惡性腫瘤,臨床上多采用惡性程度分級來評估。GIST惡性程度越高死亡率越高,復發和轉移也就越常見。有資料表明腫瘤惡性程度與CT表現之間存在一定相關性[10,11]。有學者[12]認為直徑大和壞死程度高提示惡性程度高,有學者[13]認為腫瘤大小可提示惡性程度。本組研究顯示,腫物大小與惡性程度有顯著統計學意義(P=0.011),本組資料顯示腫瘤越大越提示惡性程度越高,本組大于10cm者均為高度惡性。腫瘤惡性程度與腫瘤的形態差異有顯著統計學意義(P=0.003),本組有28例可見分葉,且惡性程度越高分葉越常見。本組資料顯示極低惡性者輪廓均清晰,惡性程度越高,輪廓越是不清,輪廓清晰程度與惡性程度差異有明顯相關性(P=0.000)。本組腫瘤增強掃描多為中等程度以上強化,與惡性程度差異無統計學意義(P=0.120)。本組資料腫瘤生長以外生和跨壁生長為主(71.1%),惡性程度越高跨壁生長約常見,生長方式與惡性程度有明顯相關性(P=0.014)。腫瘤可出現壞死,本組極低者僅有1例出現壞死,低度者有6例、中度者有10例、高度者有14例,惡性程度越高者壞死明顯增加,壞死越明顯提示惡性程度越高,壞死與惡性程度統計學意義顯著(P=0.000)。腫物轉移可提示為較高惡性程度,這是惡性腫瘤的生物學性質,本組轉移率約4.4%,轉移在GIST中較不常見,主要以肝和網膜轉移為主。本組資料顯示中、高度惡性占60%,這與Burkill等[12]認為的大多呈良性不符,這可能與本組較高惡性程度占主要及分型標準有關。統計顯示惡性程度與部位無相關性(P=0.579)。有報道[14]顯示間質瘤常伴發其他腫瘤如上皮樣腫瘤、神經纖維瘤病、Carney三聯征,本組未發現,但觀察伴發腫瘤情況,對提示GIST有一定價值。
本研究表明G IST的CT表現有一定特征性,尤其是MSCT更好顯示腫瘤及其周邊關系特點。凡具有以下特點者應考慮胃腸間質瘤:①胃腸道來源腫瘤,腫瘤多位于胃底、胃體、小腸;②腫物內生、外生或跨壁生長以腔外生長為主;③腫瘤較大者可出現壞死,強化以中等程度以上強化多見;④腫瘤較少出現梗阻;⑤腫瘤轉移以肝和腸系膜轉移為主,無淋巴結轉移。本組研究表明腫瘤大小、形態、輪廓、壞死情況、生長方式與惡性程度有顯著統計學意義(P<0.05),轉移即提示惡性程度較高。惡性程度較高也預示著復發率高,預后較差。CT表現能真實反映上述情況,有助于判斷腫瘤惡性程度,對腫瘤的診斷、分期和治療有顯著的價值。
1.Grady WM.GISTs:the revolution continues.Gastroenterology,2003,125:967-996
2.Rimon-dini A,Belgrano M,Favretto G,et al.Contribution-of CT to treatment pianning in patients with GIST.Radiol Med,2007,112:691-702
3.廖玉珍,張志強,王秋良,等.胃腸道間質瘤的CT診斷價值 .中國醫學影像技術,2005,21:90-92
4.唐光健,朱月香 .胃腸道間質瘤的CT診斷.中華放射學雜志,2006,40:843-845
5.Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor.Hum Pathol,2008,39:1411-1419
6.Boraschi P,Cappelli C,Bachini R,et al.Integrated imaging of gastrointestinal stromal tumor(GIST)of the Jejunum:a case report.Radiol Med,2001,102:406-408
7.中國胃腸道間質瘤病理專家組.中國胃腸道間質瘤共識意見.中華病理學雜志,2007,36:704-707
8.Levy AD,Remotti HE,Thompson WM,et al.Gastrointestinal stromal tumors:radiologic features with pathological correlation.Radio Graphies,2003,23:283-304
9.張龍江,楊可英,祁 吉,等.胃腸道間質瘤的影像學表現 .放射學實踐,2006,21:362-365
10.Da Ronch T,Modesto A,Bazzocchi M.Gastro intestinal stromal tumor:spiral computed tomography features and pathologic correlation.Radiol Med,2006,111:661-673
11.Ahmed I,Welch NT,Parsons SL.Gastrointestinal stromal tumours(GIST)-17 years experience from Mid Trent Region.Eur JSurg Oncol,2008,34:445-449
12.Burk ill G J,Badran M,AI-Muderis O,et al.Malignant gastroin testinal stromal tumor:distribution,imaging features,and pattern of metastatic spread.Radiology,2003,226:527-532
13.Kim H C,Lee JM,Kim KW,et al.Gastrointestinal stromal tumors of the stomach:CT findings and prediction of malignancy.AJR,2004,183:893-898
14.趙艷萍,文 智,劉文亞,等.胃腸道間質瘤多層螺旋CT特點與惡性分級相關性研究.新疆醫科大學學報,2009,32:1728-1731

