兔肝缺血/再灌注損傷DWI及與肝損傷關系的研究
郭成偉 沈三弟 劉再毅梁長虹曹希明鄭君惠
肝缺血/再灌注損傷 (ischemia reperfusion injury,I/R)預防和治療一直是肝臟外科領域中的難點,其機制復雜,是多因素、多種介質共同發揮作用的病理過程。因此,對肝臟缺血再灌注損傷的早期診斷準確尤為重要[1-3]。磁共振擴散加權成像 (diffusion weighted imaging,DWI)作為組織形態與運動狀態的“活體探針”技術具有簡單、無創等優點,尤其近年來高場強3.0T的應用,其成像速度快、信噪比高等優點,在腹部臟器逐漸廣泛應用[4,5]。本實驗旨在分析肝酶ALT、ALP與ADC值關系,并結合病理學檢查,探討3.0T DWI-ADC作為檢測I/R指標的可行性。
方 法
1.動物模型制作及分組
健康成年、雄性新西蘭大白兔18只,體重2.5~3kg,由南方醫科大學實驗動物中心提供(SCXK 2006-0015)。參照Taha等[6]I/R模型制作方法,術前禁食12h,耳緣靜脈留置24G留置針,3%戊巴比妥鈉靜脈麻醉(1ml/kg),無菌操作,經腹白線進腹,切口10cm。將胃向左提取,用濕紗布遮蓋。暴露第一肝門,剪開小網膜囊,于肝尾狀葉上方沿門靜脈與上腔靜脈間隙游離肝左葉入肝血管,采用無創性動脈夾結扎入肝左葉的管道結構(肝左動脈、門靜脈左支及肝左膽管),阻斷血供60min后,松開動脈夾,肝左葉由暗紅色變為鮮紅,表示再灌注成功,關閉腹腔,按照再灌注時間,分為6h、12hI/R組。假手術對照組(sham組):除不夾閉入左肝管道結構外,余操作同模型組。術后適量補液(5m l/kg·h,氯化鈉葡萄糖平衡液)
2.MRI及DWI檢查
應用GE 3.0T Signa Excite掃描儀,8通道正交頭線圈,仰臥位;頭先進,軸位掃描。用自制腹帶捆綁兔腹部。T2WI:TR/TE3200m s/85ms,矩陣 288×224,層厚4mm,NEX 3.00,FOV 18mm,Phase FOV 0.75。T1WI:TR/TE8.5m s/4ms,翻轉角20°,NEX 3.00;FOV 22mm;Phase FOV 1.0,NEX 3.00。EPI-DWI:TR/TE2000m s/49.3m s,矩陣128×128,層厚4mm,NEX:4,b=20s/mm2、50s/mm2、100s/mm2、300s/mm2、600s/mm2,b施加在 X 、Y 、Z 三個方向上;掃描層數8~10,掃描時間32s,NEX 4.00;FOV 20cm×10cm,Phase FOV 0.5。
3.組織學和生化檢查
實驗兔于MRI檢查結束時經上腔靜脈抽血,離心取血清,用于測定ALT、ALP含量。而后,實驗兔立即經空氣栓塞法處死,切取肝左葉,用4%多聚甲醛經門靜脈沖洗后放入4%多聚甲醛溶液中固定2h,再放入含有1/1000二乙基焦磷酰胺 (diethyl pyrocarbonate,DEPC)的蒸餾水中過夜。用梯度乙醇脫水后石蠟包埋,常規切片,HE染色,制作病理標本,在光學顯微鏡下觀察、照相。
4.圖像后處理
圖像后處理:GE AW 4.3 Func Tool Performance后處理工作站。分析指標:ADC。感興趣區 (ROI):15~18mm2。ROI采用復制、黏貼的方法在不同b值圖像,分別置于壞死區與未發生明顯壞死的區域,避開血管、膽管結構及扭曲變形區域,連續測量三個層面,計算其平均值。
5.統計學分析
應用SPSS13.0統計學軟件分析。多組均數差異的比較采用單因素方差分析(oneway ANOVA),組間均數差異的比較采用LSD-t法;A LT、A LP與ADC 相關性分析采用Pearson相關。所有結果都采用均數±標準差(±s)表示,P<0.05為差異有統計學意義。
結 果
1.I/R組左肝左MRI影像表現及ADC值測量
在I/R6h組,T2WI及DWI表現為上多位于肝臟邊緣的不均勻性點片狀稍高信號。12h組,點片狀高信號在T2WI、DWI表現更為明顯,范圍增大,部分肝臟組織信號恢復正常(圖1,2)。
各I/R組ADC低于sham組,其中在b=20s/mm2、50s/mm2、100s/mm2時 ,6h 組ADC 明顯低于sham 組(P<0.05),雖 12h組ADC低于sham組,但其差異無統計學意義;在b=300s/mm2、600s/mm2時,6h、12h I/R組與sham組之間均不存在統計學差異(P>0.05),見表1。
2.A LT、ALP以及與ADC相關性
各I/R組血清AST、A LT、ALP明顯高于sham組(P <0.05)。b=20s/mm2、50s/mm2、100s/mm2時 ,ALT與ADC顯著負相關 (r=-0.497,P<0.05;r=-0.623,P<0.05;r=-0.671,P<0.01);b=20s/mm2、100s/mm2,ALT與ADC分別呈顯著負相關(r=-0.578,P<0.05;r=-0.489,P<0.05),而b=300s/mm2、600s/mm2時 ,ADC 與 ALT 、ALP 間相關性差異均無統計學意義(P>0.05)。
3.組織學檢查
6h I/R組鏡下表現為壞死區肝竇排列紊亂,出現固縮紅染的凋亡細胞及大量中性粒細胞,“殘影結構”出現;12h I/R組,肝臟微循環內中性粒細胞進一步聚集,肝實質大量中性粒細胞浸潤,細胞凋亡壞死加重,出現局灶性壞死的征象(圖3,4)。
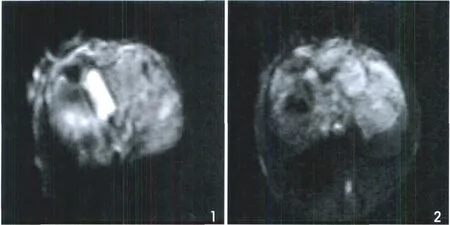
圖1 6h I/R組在肝臟邊緣表現小片狀高信號(DWI b=300s/mm2)。圖2 12h I/R組梗死 (DWI高信號,b=300s/mm 2)的范圍明顯擴大。
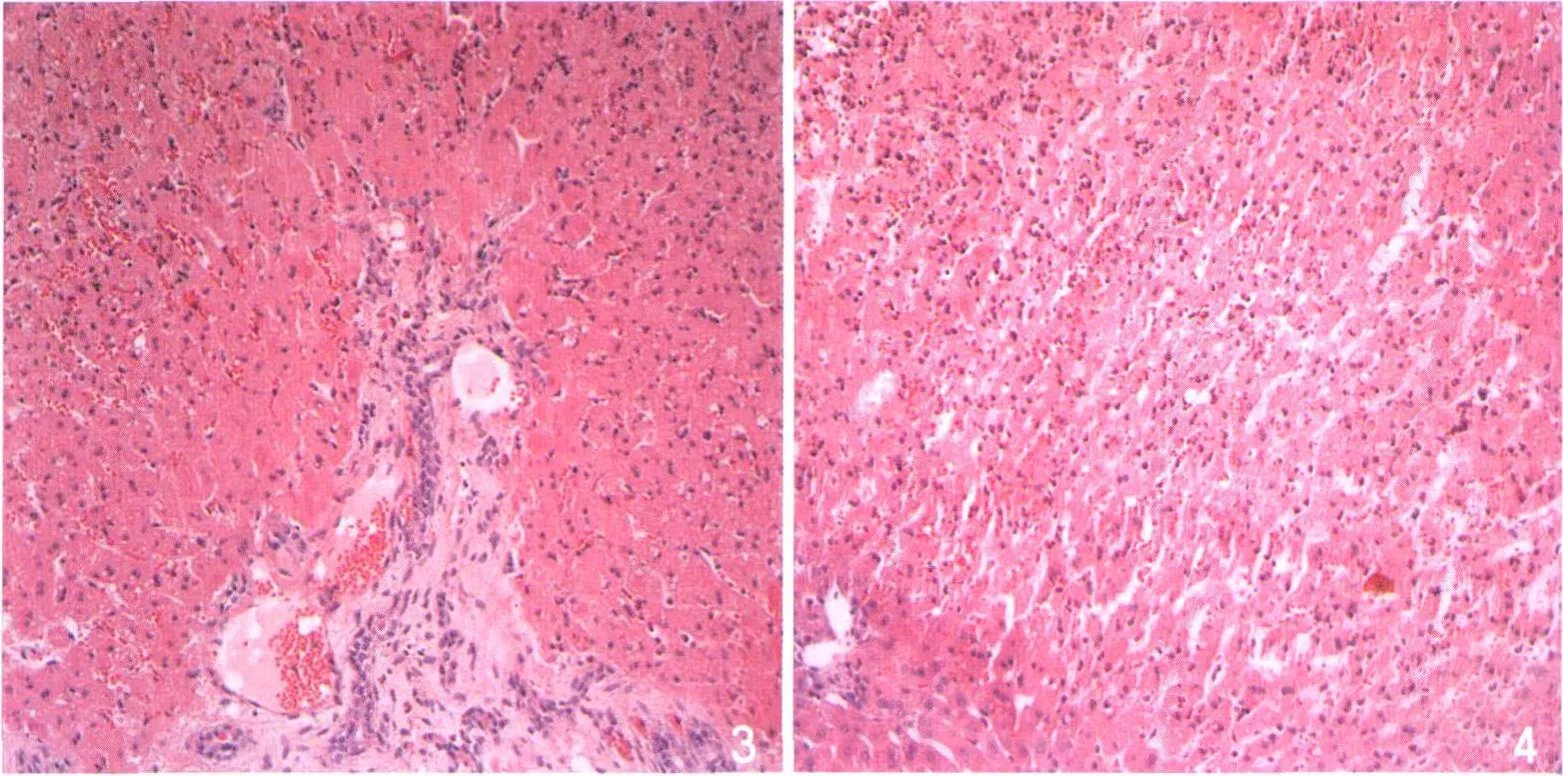
圖3 6h I/R鏡下表現為肝細胞明顯腫脹,肝竇狹窄,肝竇內淤血,匯管區及肝實質內大量中性粒細胞聚集,膽管上皮細胞腫脹(HE×200)。圖4 12h I/R組肝實質、肝竇內中心粒細胞明顯增多,部分肝細胞核固縮紅染(HE×200)。
表1 sham組與I/R組ADC×10-3mm 2/s比較(±s)

表1 sham組與I/R組ADC×10-3mm 2/s比較(±s)
討 論
1.肝I/R機制及DWI應用于肝I/R檢測的可行性
肝臟微循環的障礙、肝細胞內外水腫以及不斷加重的肝細胞壞死等是肝I/R基本病理生理過程,其中肝I/R微循環灌注改變以及伴隨灌注量的減少是促進I/R病理過程發生、發展關鍵因素[1]。而DWI作為一種利用組織間彌散系數不同而產生的組織間對比來進行成像的方法,能在分子水平上對活體組織結構及功能狀態進行無創性檢查,但是b值較小時 (b<300 s/mm2)微循環血流灌注對ADC值的影響在諸多影響因素中占主導作用,在血容量豐富的肝臟顯得尤為嚴重[5]。故本研究分別采用 b=20s/mm2、50s/mm2、100s/mm2較小梯度因子與較大的梯度因子b=300s/mm2、600s/mm2成像,觀察ADC值變化規律,與肝酶作相關性分析,探討小b值DWI能否更準確地反映肝臟缺血再灌注損傷病理變化過程。
2.肝I/R后DWI-ADC變化規律及機制探討
本研究結果顯示在缺血再灌注6h后,與sham相比,ADC顯著下降,而在12h出現緩慢上升。肝左葉T2WI及DWI表現為高信號,這意味肝臟損傷的持續、加重。其主要原因I/R后肝臟毛細血管網內血流狀態發生改變,出現肝血流顯著的差異性分布,即肝細胞的生理狀態出現差異性。所以,肝細胞對損傷因素敏感性出現差異性反應[1,2]。其發生機制:首先,在I/R的(>6h)后期階段,各種有害物質破壞了肝臟的微循或肝臟的微血管床或者肝血竇被大量功能喪失的紅細胞充填。同時,由于肝血竇功能障礙致使肝動脈介導的血管緩沖效應喪失,使肝臟的血供減少;末端小動靜脈間通路的開放使肝血竇的灌注量進一步減少[7]。其次,肝臟微循環灌注量的減少使得肝細胞濃度相對增高,抑制水分子的運動能力。總之,肝臟微循環灌注量的減少,導致肝細胞萎縮、肝竇解離、內皮細胞脫落、中央靜脈和小門靜脈束萎縮。綜上以上因素,由于抑制水分子的運動因素增多而使ADC下降。再者,各種炎性介質、超氧化物介導肝實質損害也是重要原因[2]。研究表明,肝竇及肝實質內大量聚集的中性粒細胞不僅阻礙肝臟微循環的血流,而且誘導炎性反應對肝實質造成損傷(圖3,4)。肝酶ALT、ALP是評價肝功能丟失非常敏感的指標,其中ALT的升高代表了肝細胞膜的損害或者通透性增高,而本研究結果顯示ALT與較小的梯度因子b值的ADC呈顯著負相關,也說明了選用較小b值DWI不但對肝I/R后微循環障礙具有較高的敏感性,而且能準確地反映肝細胞的功能、形態等。至于ALP顯著升高,筆者認為是其主要原因是在本實驗中I/R模型的制作中不但阻斷了左半肝血液供應,同時阻斷了左肝管,在一定程度上具有部分急性梗阻性黃疸模型的特點。門靜脈與肝膽管同處于一Glisson鞘內,當膽管上皮由于缺血發生腫脹時,門靜脈便首先受壓,肝臟的血液灌流量減少,增加了微循環的阻力。另外,膽道損傷或梗阻易導致細菌感染和腸源性內毒素血癥,可直接導致肝細胞的壞死。壞死的肝細胞又可引起炎癥細胞的集聚, 促進了肝血竇內微血栓形成,加重微循環障礙。這些致使肝I/R發展因素疊加使血清ALT和ALP逐漸上升而ADC逐漸下降。值得注意的是,在12h下降是暫時的,在筆者的后續研究中發現在24~48h(限于篇幅,筆者另文發表),ADC又明顯上升。所以,筆者認為肝臟缺血再灌注損傷的復雜性和多因素的病理生理過程以及肝臟的兩套血供特點決定DWI成像ADC的多變性,這也是有別于腦的缺血再灌注損傷ADC變化特點[7,8]。
同時,本實驗也存在DWI-ADC監測時間短以及選用兔作為研究對象受其呼吸頻率較快影響易產生磁敏感偽影,致使肝臟的邊緣易發生扭曲變形,影響ADC值的準確性等缺點。
總之,3.0T DWI成像作為一種簡單、方便、無需對比劑的成像方法,是對以往采用肝酶等方法來評估肝臟損傷程度的一個很好補充。因此,DWI在肝臟移植、肝臟腫瘤切除等易引起I/R的手術中具有很高的臨床使用價值,值得深入研究。
1.Ramalho FS,Fernandez-Mon teiro I,Rosello-Catafau J,et al.Hepatic microcirculatory failure.Acta Cir Bras,2006,21:48-53
2.Okaya T,Len tsch AB.Cytokine cascades and the hepatic inflammatory response to ischemia and reperfusion.J Invest Surg,2003,16:141-147
3.包維民,郭永章,李 立,等.熱缺血再灌注損傷對大鼠肝臟細胞能量狀態、凋亡和脹亡的影響.中華實驗外科雜志,2005,3:302-304
4.Chan JH,Tsui EY,Luk SH,et al.Diffusion-weighted MR imaging of the liver:distingu ishing hepatic abscess from cystic or necrotic tum or.Abdom Imaging,2001,26:161-165
5.Taha MO,Goncalves PF,Vidigal RO,et al.Protective effects of heparin on hepatic ischemia and reperfusion lesions in rabbits.Transplant Proc,2009,41:812-815
6.Ayuse T,Brienza N,O'Donnell CP,et al.Pressure-flow analysis of portal vein andhepatic artery interactions in porcine liver.Am JPhysiol,1994,267:1233-1242
7.吳利忠,李 梅,丁小龍 .急性缺血性卒中的CT、常規MRI和DWI影像診斷.中國醫學計算機成像雜志,2008,14:17-22
8.Hirai T,Sasaki M,Maeda M,et al.Diffusion-weighted imaging in ischemic stroke:effect of display method on observers' diagnostic performance.Acad Radiol,2009,16:305-312

