大鼠恐懼應激模型的建立及指標篩選
劉佳佳,潘 霄,嚴 進,唐云翔
多種形式的應激刺激可引起動物行為、認知以及機體多項功能障礙,已引起許多學者的關注。恐懼應激動物模型是模擬人類情感的一種情緒應激模型,主要是通過給予實驗動物恐懼的創傷應激,測試實驗動物的行為和生理變化。多項研究表明恐懼應激可以直接引起實驗動物的一系列的防御性行為反應,包括呆立反應、心率增快、驚跳反應、逃避反應等[1]應激反應,從而引起神經系統、心血管系統、免疫系統、內分泌系統等微環境的變化[2]。
1 材料和方法
1.1 實驗動物及分組 64只健康雄性Wisatr大鼠,體重(200±20)g,購自第二軍醫大學實驗動物中心。于安靜環境下飼養,自由攝食飲水,自然光照,溫度22~26℃。將實驗動物隨機分為恐懼模型組和對照組,每組32只。
1.2 恐懼模型制作方法
1.2.1 恐懼模型組 大鼠群居飼養于不銹鋼籠中(50 cm×30 cm×20 cm),自由攝食飲水,飼養10 d。第11天放入聲電刺激儀(40 cm×30 cm×20 cm,購自上海軟隆科技發展有限公司)。刺激儀四周為黑色玻璃,底部鋪設銅柵,可以通1 mA交流電,頂部設有攝像器及發聲器,噪音音量分貝固定。前5 min為適應期,之后給予2 s(75 Db∶1000 Hz)噪音,并緊跟1 s電流刺激(1 mA),間隔1 min,共30次。第12、13天重復實驗。第14天實驗只給予噪音5 min,不予電擊,攝像記錄第6~30 min內大鼠行為變化。實驗結束立即放入自發活動箱內,進行應激后行為學檢測。自第15天起每天于固定時間重復第11天實驗。
1.2.2 對照組 大鼠于同樣環境下飼養10 d,第11天放入聲電刺激儀內,前5 min為適應期,之后只給予2 s(75 Db∶1000 Hz)噪音,無電擊。 第12、13天重復實驗。第14天攝像記錄5 min噪音后6~30 min內大鼠行為變化。實驗結束放入自發活動箱,進行應激后行為學檢測。自第15天起每天于固定時間重復第11天實驗。實驗中抓取動物動作輕柔,避免不必要的刺激干擾實驗結果。
1.3 檢測指標及方法
1.3.1 凍結時間 凍結姿勢 (freezing posture):靜止、呆滯、蜷縮、蹲伏等,期間僅有呼吸和輕微搖擺運動。其總時間稱為凍結時間(freezing time),即大鼠行為得分。行為評定采用盲法,單位以秒來計算,由3名觀察者觀看錄像后評分,取其平均值。
1.3.2 體重 自造模成功之后第2天算起分別于1、2、3、4周每周周中 (實驗第18、25、32、39天),對兩組大鼠體重進行測量,觀察恐懼應激對大鼠體重的影響。YP系列電子天平(精度0.1 g)購自上海精密科學儀器有限公司。
1.3.3 自發活動 自造模成功之后第2天算起分別于1、2、3、4周每周周中 (實驗第 18、25、32、39天),進行兩組大鼠自發活動實驗。測試大鼠5 min內在新異環境的活動情況。自發活動視頻分析系統(DigBehv-LR)購自上海吉量軟件科技有限公司。
1.3.4 血清皮質酮含量測定 自造模成功之后第2天算起分別于1、2、3、4周每周周中(實驗第18、25、32、39天),對實驗大鼠進行斷頭取血,全血37℃恒溫靜置30 min后,3 900 r/min離心10 min,取上層血清,送檢。血清皮質醇(COP)放射免疫試劑盒購自上海西塘生物科技有限公司并有該公司代測,檢測過程符合各項規范。
1.3.5 血清C反應蛋白含量測定 自造模成功之后第2天算起分別于1、2、3、4周每周周中(實驗第18、25、32、39天),對實驗大鼠進行斷頭取血,全血37℃恒溫靜置30 min后,3 900 r/min離心10 min,取上層血清,送檢。血清高敏C反應蛋白(hs-CRP)放射免疫試劑盒購自上海西塘生物科技有限公司并有該公司代測,檢測過程復合各項規范。
1.4 統計學處理 所有數據均采用SPSS17.0軟件進行處理。用均數±標準差(±s)表示,計量資料采用獨立樣本t檢驗;同一對象不同時點的計量資料采用重復測量的方差分析。檢驗水準α=0.05。
2 結 果
2.1 凍結時間 恐懼模型組大鼠在第11天實驗噪音后出現凍結姿勢:靜止、呆滯、蜷縮、蹲伏等,期間僅有呼吸和輕微搖擺運動并伴有立毛、肌肉輕微振頗、大小便失禁等表現。行為評定采用盲法,凍結時間即為大鼠得分,單位以秒來計算,由3名觀察者觀看錄像后評分,取其平均值。三者評定一致性Kappa值>0.95。兩組間行為學得分存在顯著性差異,恐懼模型組大鼠行為學得分高于對照組 (t=5.700,P<0.01),見圖1。
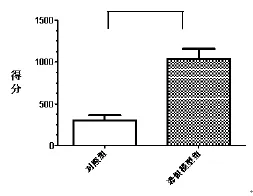
圖1 二組行為計分
2.2 體重 隨著飼養時間的增加兩組大鼠體重均有所增長,但恐懼模型組體重增加較緩。第1周兩組大鼠體重無顯著差異,第2、3周恐懼模型組體重低于空白對照組(P<0.05),第4周恐懼模型組體重顯著低于對照組(P<0.01),見表1。
表1 兩組大鼠體重(±s,g)

表1 兩組大鼠體重(±s,g)
兩組比較,*P<0.05,#P<0.01
?
2.3 自發活動
2.3.1 休息時間 第1、3、4周,恐懼模型組休息時間顯著高于對照組(P<0.05),第2周恐懼模型組休息時間非常顯著高于對照組(P<0.01),見表2。
2.3.2 活動次數 第1、4周,恐懼模型組活動次數顯著少于對照組(P<0.05)。第2、3周恐懼模型組活動次數非常顯著少于對照組(P<0.01),見表3。
表2 兩組大鼠自發活動時休息時間(±s,s)

表2 兩組大鼠自發活動時休息時間(±s,s)
兩組比較,*P<0.05,#P<0.01
?
表3 兩組大鼠自發活動次數(±s,次)
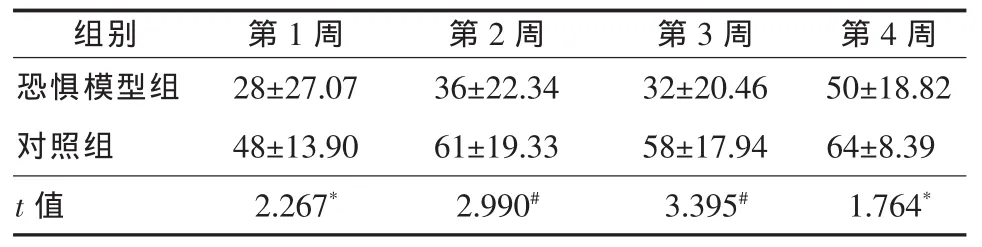
表3 兩組大鼠自發活動次數(±s,次)
兩組比較,*P<0.05,#P<0.01
?
2.4 皮質酮含量 第1、3、4周恐懼模型組血清皮質酮高于對照組(P<0.05),第2周恐懼模型組血清皮質酮顯著高于對照組(P<0.01),見表4。
表4 兩組大鼠血清皮質酮水平(±s,μmol/L)
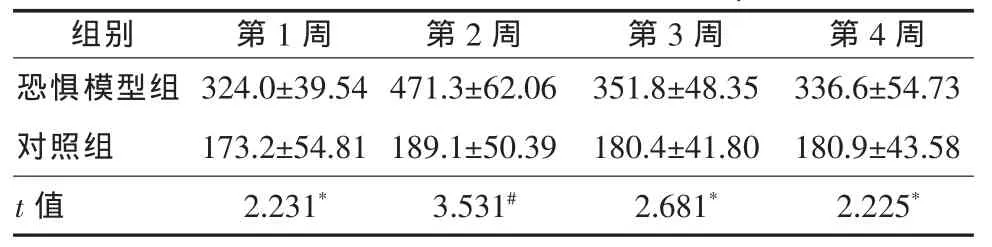
表4 兩組大鼠血清皮質酮水平(±s,μmol/L)
兩組比較,*P<0.05;,#P<0.01
?
2.5 血清C反應蛋白含量 第1周恐懼模型組血清hs-CRP濃度顯著高于對照組(P<0.05),第2、3、4周恐懼模型組hs-CRP濃度非常顯著高于對照組(P<0.01),見表5。
表5 兩組大鼠血清C反應蛋白水平(±s,μmol/L)
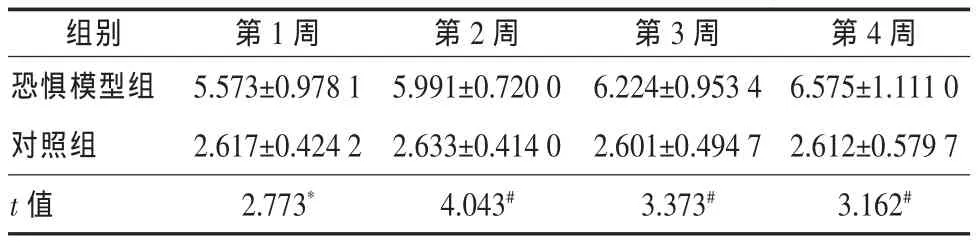
表5 兩組大鼠血清C反應蛋白水平(±s,μmol/L)
兩組比較,*P<0.05,#P<0.01
?
3 討 論
諸多研究表明多種應激都可以使動物產生行為和情緒障礙[3]。恐懼應激模型是根據經典條件反射制造的一種模擬恐懼情感的動物模型。恐懼條件反射是指在一種明確的中性刺激(一般是光照或聲音)與一種惡性刺激(通常是電擊足底)之問建立聯系,這種聯系建立與否可以用木僵行為實驗進行檢測[4]。目前條件性恐懼訓練已經成為一種經典的誘導焦慮恐懼反應模型的方法,被國外學者所采用。
本實驗通過改良的Takeuchi方法,發現條件恐懼應激模型實驗組出現的不同行為學變化,在噪聲后出現凍結姿勢:靜止、呆滯、蜷縮、蹲伏等,期間僅有呼吸和輕微搖擺運動,這些行為變化與文獻報道一致[5]。以上所述行為的總時間稱為凍結時間,即條件恐懼模型組大鼠得分。本研究發現在連續3 d噪音+電擊刺激后恐懼模型組大鼠在第14天凍結時間顯著高于對照組,證明造模成功。
情緒變化會對體重產生影響,多項研究表明恐懼、抑郁、焦慮等情緒癥狀會引起厭食或貪食等飲食方面發生變化,最終引起體重的變化[6]。本研究發現隨著飼養時間的延長,兩組大鼠體重均呈生長狀態,但與對照組比較恐懼模型組體重增長緩慢,提示恐懼應激對大鼠體重增長有一定影響。
自發活動實驗可用來測試動物的活動性和對新異環境的適應能力[7],一些研究已從分子水平探討應激對大鼠行為的影響機制[8]。本實驗通過對大鼠自發活動實驗的研究,發現恐懼模型組與對照組差異顯著。在第2周恐懼模型組休息時間顯著長于對照組,而活動次數顯著低于對照組,第1、3、4周統計學差異小于第2周。表明恐懼應激在第2周處于高峰期。
近幾年的研究已經證明,下丘腦-垂體-腎上腺(HPA)軸在機體的應激反應中發揮著重要作用,應激能夠激活 HPA軸和交感神經系統,導致腎上腺皮質釋放糖皮質激素以及交感神經末梢和腎上腺髓質釋放兒茶酚胺增加[9]。本研究發現第2周血清皮質酮含量處于最高峰,第3、4周有下降趨勢,表明較長時間恐懼應激對大鼠血清皮質酮含量影響不同與短期應激的變化趨勢,這與一些研究結果相符[10、11]。提示噪音加電擊已不能對大鼠造成新意額外刺激。
hs-CRP是一項敏感的炎癥反應指標,心理應激能使炎癥和抗炎癥細胞因子之問的平衡破壞,造成免疫功能紊亂[12]。本研究顯示,隨著恐懼應激時間的增長,大鼠血清hs-CRP持續升高,表明恐懼應激對大鼠機體功能造成持續損傷。但本研究未從分子水平進一步提示氧化應激與炎癥之間的關系,尚待以后進一步研究證實。
本研究建立了較為可信的大鼠條件恐懼應激模型,并得出了恐懼應激對大鼠一般行為及機體損傷指標的損傷效應,以期為抗恐懼應激藥物評價提供可靠的依據。
[1]Conrad CD,Mauldin Jourdain ML,Hobbs RJ.Metyrapone reveals that previous phronic stress differentially impairs hippoeampal dependent memory[J].Stress,2001,4(4):305-318.
[2]安獻麗,鄭希耕.創傷后應激障礙的動物模型及其神經生物學機制[J].心理科學進展,2008,16(3):371-377.
[3]Rosch PJ.Stress and memory loss:some speculations and solutions[J].Stress Med,1997,13:1-6.
[4]Davis M.Are different parts of the extended amygdala involved in fear versus anxiety?[J].Biol Psychiatry,1998,44(12):1239-1247.
[5]Takeuehi T,Iwanaga M,Harada E.Possible regulatory mechanism of DHA-induced anti-stress reaction in rats[J].Brain Res,2003,964(1):136-143.
[6]陳純姿,劉少文,趙巍峰.慢性應激對大鼠行為和體重的影響[J].中國民康醫學雜志,2005,17(3):129-130.
[7]Keeney AJ,Hogg S.Behavioural consequences of repeated social defeat in the mouse:preliminary evaluation of a potential animal model of depression.Behav Phammvol,1999,10(8):753-764.
[8]嚴 進,王春安,葉阿莉,等.應激對大鼠行為和部分腦區谷氨酸含量的影響[J].心理學報,1995,27(4):422-426.
[9]Li ZH,Sun L,Zhang HY,et al.Elevated homcysteine was associated with hemorrhagic and ischemic stroke,but methylennetetrahydrofolate reductase gene C677T polymorphism was a risk factor for thrombotic stroke[J].Stroke,2003,34:2085.
[10]嚴 進,王春安,陳宜張,等.心理性應激引起的大鼠行為、血漿皮質酮及腦區氨基酸水平的變化[J].第二軍醫大學學報,1997,18(4):330-333.
[11]劉繼民.長期心理應激對大鼠血漿皮質酮、兒茶酚胺水平及免疫功能的影響[J].青島大學醫學院學報,2005,41(3):228-228.
[12]Maes M.Major depression and activation of the inflammatory response system[J].Cytokines,Stress,and Depression,1999,(1):25-46.

