魚油對脂多糖刺激仔豬腸道損傷的保護作用
吳志鋒 劉玉蘭 洪 宇 朱惠玲 侯永清 丁斌鷹
(武漢工業學院,動物營養與飼料科學湖北省重點實驗室,武漢 430023)
魚油對脂多糖刺激仔豬腸道損傷的保護作用
吳志鋒 劉玉蘭*洪 宇 朱惠玲 侯永清 丁斌鷹
(武漢工業學院,動物營養與飼料科學湖北省重點實驗室,武漢 430023)
本試驗旨在研究魚油對脂多糖(LPS)刺激仔豬腸道損傷的保護作用。試驗選用32頭(28±3)日齡、體重為(8.91±0.74)kg的杜洛克×長白×大白仔豬,隨機分為4組,每組4個重復,每個重復(欄)2頭豬,公母各1頭。試驗采用2×2因子設計,主因子包括:1)飼糧處理(5%魚油或5%玉米油);2)免疫應激(注射LPS或生理鹽水),試驗期19 d。試驗第19天,每個飼糧組1/2的豬注射150μg/kg BW的LPS,另1/2注射無菌生理鹽水作為對照。注射LPS 4 h后屠宰仔豬,取小腸樣品待測。結果表明:1)LPS刺激導致空腸、回腸黏膜絨毛高度和隱窩深度顯著下降(P<0.05),魚油顯著提高了回腸黏膜絨毛高度、隱窩深度和絨毛高度/隱窩深度(P<0.05)。2)LPS刺激導致空腸黏膜麥芽糖酶、乳糖酶和蔗糖酶活性顯著降低(P<0.05);魚油顯著提高了空腸蔗糖酶活性(P<0.05),同時魚油對回腸乳糖酶活性的影響與LPS刺激存在顯著的互作關系(P<0.05),即對生理鹽水組,魚油顯著提高了回腸乳糖酶活性(P<0.05)。3)LPS刺激顯著提高了空腸和回腸中腫瘤壞死因子α(TNF-α)、前列腺素E2(PGE2)含量(P<0.05),魚油顯著降低了空腸中TNF-α含量(P<0.05),對空腸中PGE2含量有抑制趨勢(P<0.10)。4)LPS刺激導致空腸和回腸黏膜中核轉錄因子kappaB(NF-κB)蛋白表達水平顯著提升(P<0.05),而魚油則有效降低了回腸中NF-κB蛋白表達水平(P<0.05)。結果提示:魚油緩解了LPS導致仔豬的腸道損傷,魚油可能通過影響腸道中NF-κB蛋白的表達來抑制炎性介質的分泌,從而發揮保護作用。
魚油;免疫應激;仔豬;炎性介質;NF-κB
免疫應激在養豬生產中普遍存在,是抑制豬生長的重要因素之一,給養豬生產造成很大的經濟損失。免疫應激是由飼養環境中的病原體或非病原體,如細菌、病毒和內毒素等刺激豬的免疫系統所致[1]。當機體受到病原體或非病原體刺激時,免疫系統常處于一種高度的激活狀態,尤其是炎性細胞因子,如腫瘤壞死因子α(TNF-α)、白細胞介素-1β(IL-1β)、白細胞介素 -6(IL-6)等過量分泌,從而產生免疫應激問題[2]。免疫應激中受影響最大的是腸道。研究表明,免疫應激損害腸黏膜的完整性,導致腸道消化酶活性下降,從而影響了營養物質的消化吸收[3]。魚油富含n-3多不飽和脂肪酸(PUFA),已成為特定的免疫營養素[4-5]。目前,已有研究證明,n-3 PUFA能調控感染、創傷等情況下機體過度的炎性反應,起到營養和藥理的聯合作用[4]。除了其營養和免疫作用外,在醫學上的研究表明,n-3 PUFA對危重癥患者的腸黏膜損傷有防護作用[6]。同時在試驗動物上的研究表明,從深海魚油中提取的n-3 PUFA可以減少小鼠腸道細菌易位,保護腸黏膜屏障[7]。但是關于n-3 PUFA對豬的調控作用尚未見報道。鑒于n-3 PUFA對腸道的保護作用,推測魚油可能對緩解仔豬免疫應激導致的腸道損傷有一定作用。因此,本研究用大腸桿菌脂多糖(LPS)刺激仔豬建立免疫應激模型[8],研究魚油對仔豬腸道黏膜結構及屏障功能的影響,旨在探討魚油對LPS刺激導致的仔豬腸道損傷的調節作用及機理。
1 材料與方法
1.1 試驗動物和飼糧
試驗選用32頭(28±3)日齡、體重為(8.91±0.74)kg的杜洛克×長白×大白仔豬,按體重相近原則隨機分為4組,每組4個重復,每個重復(欄)2頭豬,公母各1頭。試驗期19 d。飼糧參照NRC(1998)5~10 kg斷奶仔豬的營養需要量配制,基礎飼糧組成及營養水平見表1。
1.2 試驗設計
1.3 腸道樣品采集
仔豬屠宰后剖開腹腔取小腸,把小腸分為十二指腸、空腸和回腸,將小腸從其腸系膜處取下并立即放入冰塊中。于空腸和回腸中部各取5 cm腸段置于4%多聚甲醛中固定,同時各取10 cm腸段用剪刀剖開,并用4℃生理鹽水輕輕沖洗腸內容物,用濾紙吸干水分,再用手術刀鈍面輕輕刮取腸黏膜,分裝在5 m L無菌凍存管中,立即放入液氮中速凍,再轉入-80℃低溫冰箱中凍存。
1.4 檢測指標
1.4.1 小腸黏膜形態
將4%多聚甲醛固定的腸段常規石蠟包埋、切片,蘇木素-伊紅染色。光學顯微鏡下進行觀察、取圖和拍照,從組織切片上選10個典型視野(絨毛完整、走向平直),測量小腸黏膜的絨毛高度和隱窩深度,其平均值作為測定數據。

表1 基礎飼糧組成及營養水平(風干基礎)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4.2 小腸黏膜二糖酶活性
準確稱取一定量黏膜,按1∶9加入生理鹽水放入玻璃勻漿器中勻漿,冷凍離心(4℃,3 000 r/m in,10 m in),分離上清液,制備成10%的黏膜勻漿,待測黏膜中二糖酶的活性,采用酶偶聯法(葡萄糖氧化酶-過氧化物酶偶聯法)測定二糖酶活性。二糖酶測定試劑盒購自上海榮盛生物技術有限公司。
1.4.3 小腸黏膜炎性介質
取10%的黏膜勻漿液,TNF-α采用ELISA試劑盒(R&D System,美國)測定;前列腺素 E2(PGE2)采用125IRIA試劑盒(北京華英生物技術研究所)測定。
1.4.4 小腸黏膜核轉錄因子kappaB(NF-κB)蛋白水平
這個老陳啊,都躺在醫院里了,還口齒牙硬。當我告訴老陳他被撞后是樓上的那個女人打的120時,老陳的臉再一次紅了,吭哧了半天,才說那天他見到那個女人后,就把那條內褲拿給她,誰知她不承認是自己的。老陳說他問遍了其他的人家,大家都說不是自己的,所以他認定是那個女人的。誰想老陳塞給那個女人,那個女人又塞給他,一來二往,老陳的手就觸到了那個女人不該觸的地方。那個女人反應也快,抬手就給了老陳一耳光。打過之后,那個女人才意識到自己有些過分了。
采取蛋白質印跡(Western Blot)分析方法。取約0.2 g腸道黏膜溶解在7倍體積的蛋白裂解液中,勻漿后10 000×g4℃離心10 m in獲得總蛋白。以相同總蛋白質量作為變性蛋白質的十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)后轉至聚偏乙烯(PVDF)膜上進行抗原抗體反應,4℃過夜。一抗為兔源NF-κB p65抗體(#3034,購于 Cell Signaling Technology,1∶1 000 稀釋)和鼠源β-肌動蛋白(β-actin)抗體(sc-47778,購于Santa Cruz Biotechnology,1∶1 000 稀釋)。洗膜后二抗(武漢博士德生物工程有限公司)室溫下孵育2 h,二抗分別為羊抗兔IgG-HGP和羊抗鼠IgGHRP,1∶10 000稀釋。洗膜后用 ECL試劑(Pierce公司)熒光顯色,于A lpha Innotech成像系統中檢測及分析條帶強度。NF-κB p 6 5蛋白水平以NF-κB p65的強度和β-actin的強度比值表示。
1.5 飼養管理
試驗在動物營養與飼料科學湖北省重點實驗室進行。舍溫保持在20~22℃。豬欄面積1.20 m ×1.10 m。粉料飼喂,乳頭式飲水器,自由采食和飲水。
1.6 統計分析
數據用SPSS 16.0進行雙因子方差分析。模型主效應包括飼糧處理、免疫應激及二者的互作。以P<0.05為差異顯著性標準,以P<0.10為具有顯著性趨勢。
2 結果與分析
2.1 魚油對LPS刺激仔豬腸道形態的影響
小腸黏膜形態的結果見圖1和表2。由表2可知,LPS刺激導致各腸段絨毛高度和隱窩深度均顯著下降(P<0.05),魚油顯著提高了回腸黏膜絨毛高度、隱窩深度和絨毛高度/隱窩深度(P<0.05)。從圖1可看出,生理鹽水組空腸絨毛完整且較長;LPS組空腸絨毛排列不整齊,絨毛脫落較嚴重,而LPS刺激后相比于玉米油,飼糧中添加魚油時絨毛恢復較好,形態較完整。

圖1 空腸形態光鏡圖Fig.1 The lightm icroscope photograph of jejunum(100 × )
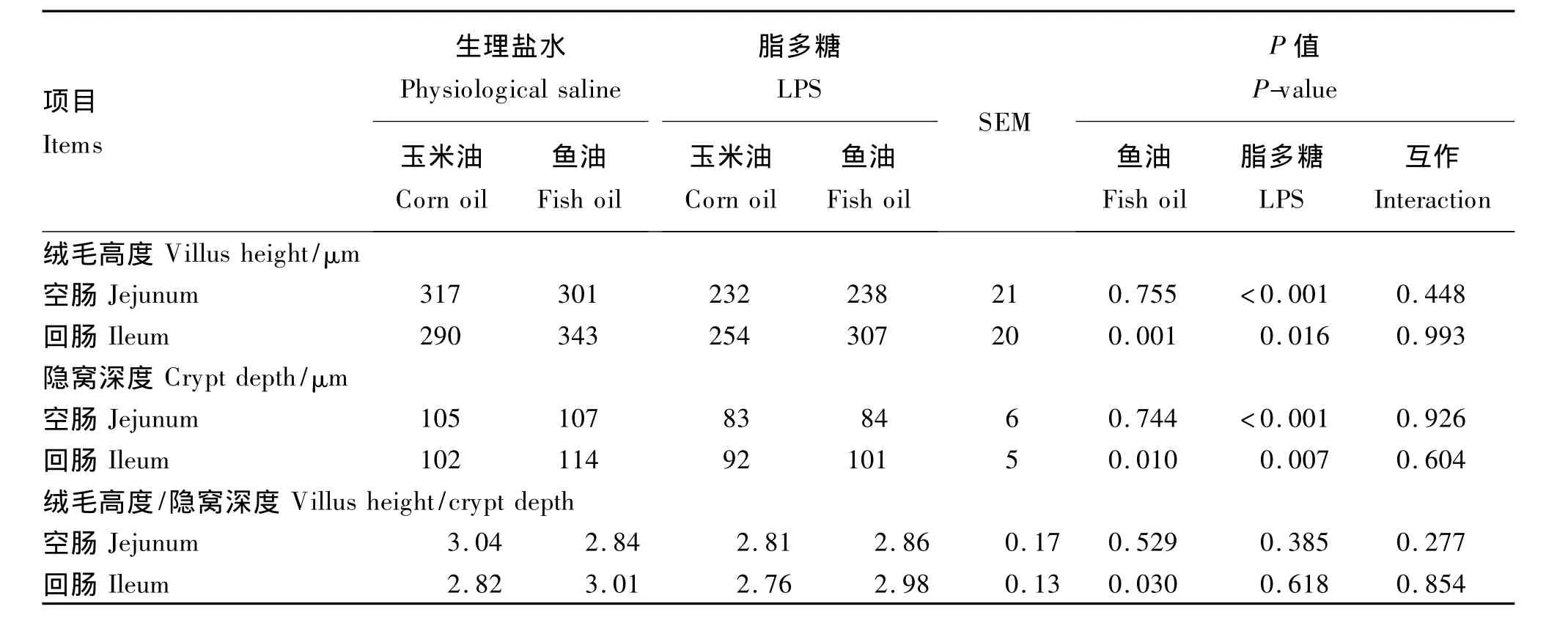
表2 魚油對脂多糖刺激仔豬腸道形態的影響Table 2 Effect of fish oil on intestinalmorphology of piglets challenged with lipopolysaccharide
2.2 魚油對LPS刺激仔豬腸道二糖酶活性的影響
由表3可見,LPS刺激導致空腸黏膜麥芽糖酶、乳糖酶和蔗糖酶活性顯著降低(P<0.05)。魚油對回腸乳糖酶活性的影響與LPS刺激存在顯著的互作關系(P<0.05),即對生理鹽水組,魚油顯著提高了回腸乳糖酶活性(P<0.05),而對 LPS組的豬則無影響。魚油顯著提高了空腸蔗糖酶活性(P<0.05)。

表3 魚油對脂多糖刺激仔豬腸道二糖酶活性的影響Table 3 Effect of fish oil on intestinal disaccharidase activities of piglets challenged with lipopolysaccharide U/mg prot
2.3 魚油對LPS刺激仔豬腸道黏膜中炎性介質的影響
從表4可見,LPS刺激顯著提高了空腸、回腸中 TNF-α、PGE2含量(P<0.05),魚油顯著降低了空腸中TNF-α含量(P<0.05),同時有緩解空腸中PGE2上升的趨勢(P<0.10)。
2.4 魚油和LPS刺激對仔豬腸道黏膜中NF-κB蛋白水平的影響
由圖2和表5可知,LPS刺激后,空腸和回腸黏膜中 NF-κB蛋白表達水平顯著提高(P<0.05),而魚油則有效降低了回腸中NF-κB蛋白表達水平(P<0.05)。

表4 魚油對脂多糖刺激仔豬腸道黏膜中炎性介質的影響Table 4 Effect of fish oil on inflammatory parameters of intestinal mucosa in piglets challenged with lipopolysaccharide pg/mg prot

圖2 空腸和回腸黏膜中NF-κB代表性Western Blot蛋白條帶Fig.2 The representative protein bands from Western blot for NF-κB in the jejunum and ileum mucosa
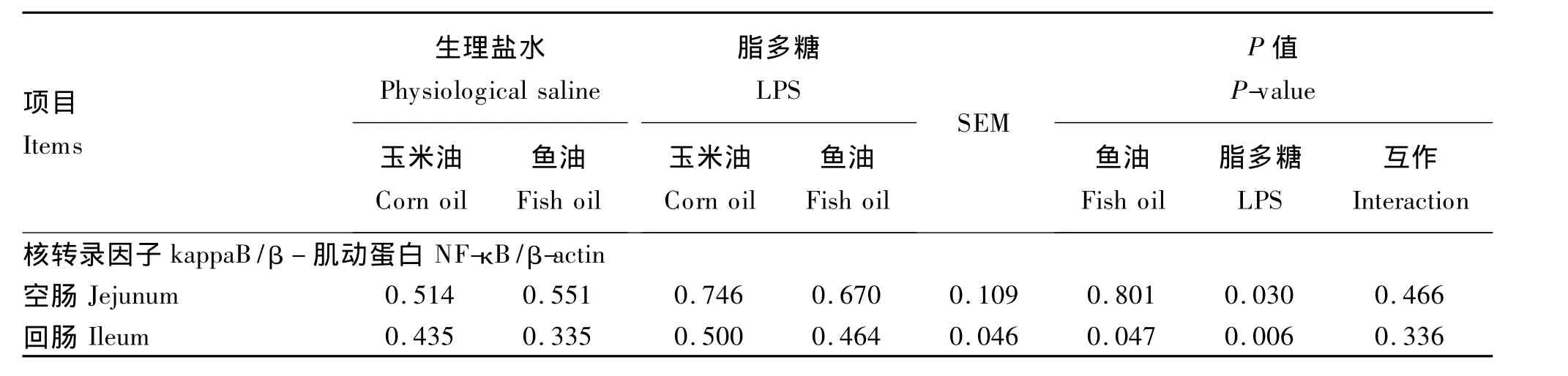
表5 魚油對脂多糖刺激仔豬腸道黏膜中NF-κB蛋白水平的影響Table 5 Effect of fish oil on intestinalmucosa NF-κB protein expression of piglets challenged with lipopolysaccharide
3 討論
LPS模型是動物營養學中常用的豬免疫應激模型[9]。LPS是革蘭氏陰性菌膜結構物質,能引起全身炎癥反應綜合征,出現如厭食、嗜睡和發熱等癥狀[5]。此外,LPS刺激也會損害腸黏膜的完整性,破壞腸道結構和功能,如給豬腹膜注入LPS后,觀察發現腸黏膜血流量減少50%,腸黏膜通透性明顯增加[10]。
小腸黏膜絨毛高度與隱窩深度是小腸吸收面積和成熟腸細胞數量多少的結構基礎,與仔豬消化吸收功能密切相關,是決定仔豬對腹瀉敏感性強弱的因素之一[11]。本試驗結果表明,LPS刺激損害腸黏膜的完整性,這與Sukhotnik等[12]的研究結果一致。飼糧中添加魚油顯著提高回腸黏膜絨毛高度、隱窩深度和絨毛高度/隱窩深度。這表明魚油在一定程度上加速了回腸上皮細胞的更新代謝,緩解了LPS應激導致的腸絨毛萎縮。
乳糖酶、蔗糖酶和麥芽糖酶是小腸重要的二糖酶,主要存在于小腸絨毛頂端,對小腸的消化及吸收功能有重要意義,同時也是監測小腸功能受損最敏感的指標之一[13]。本研究表明LPS刺激降低了空腸黏膜麥芽糖酶、乳糖酶和蔗糖酶活性,表明LPS刺激損傷了腸道的消化吸收功能。飼糧中添加魚油提高了回腸乳糖酶和空腸蔗糖酶活性,表明魚油具有提高腸道黏膜二糖酶活性的功能。這與前面提到的魚油維持小腸黏膜的正常形態的結果密切相關。只有完整的腸黏膜形態與結構,才有益于黏膜二糖酶的分泌,才能使養分得以更好地消化、吸收,進而促進了仔豬生長[14]。同時也有報道,加魚油的腸外營養可促進嚴重創傷后腸道血供和腸屏障功能的恢復,降低全身系統炎癥反應綜合征的發生[15]。對腸道缺血再灌注損傷大鼠,腸內營養添加n-3 PUFA可促進腸黏膜修復,維護腸屏障功能,減少內毒素移位和減輕系統炎癥反應[16]。
動物在發生免疫應激反應時,應激原會刺激單核/巨噬細胞系統產生并分泌TNF-α等炎性細胞因子[2]。PGE2是花生四烯酸的代謝產物,花生四烯酸通過環氧化酶和脂氧化酶途徑代謝產生許多生物活性物質,其中PGE2是調節免疫反應的重要代謝產物,也是一種重要的炎性介質[5]。研究表明,炎性介質在腸道損傷起到決定性作用[17],其過量分泌將造成腸道黏膜的完整性和上皮細胞吸收功能受損[18]。在本試驗中,LPS刺激導致腸道炎性介質TNF-α和PGE2上升,說明仔豬的腸道發生炎癥反應,從而導致腸道結構和功能的損傷。而魚油顯著抑制了腸道黏膜中TNF-α的上升、減緩了PGE2水平的上升趨勢,說明魚油具有緩解腸道炎癥從而緩解腸道結構和功能損傷的作用。與此類似,我們前期的研究表明,與玉米油組相比,添加7%的魚油飼糧顯著緩解了LPS刺激仔豬血漿 IL-1β、PGE2含量的上升[5]。同時也有研究報道,與玉米油和禽脂相比,魚油能顯著降低肉雞腸道組織PGE2水平[19]。此外,魚油的主要成分二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)可顯著降低人胃癌BGC-823細胞PGE2濃度[20]。這可能是n-3 PUFA與能置換細胞膜磷脂中的花生四烯酸,競爭相同的環氧化酶途徑,減少了來源于花生四烯酸的代謝產物,從而抑制過度炎癥反應的發生和發展[21]。
NF-κB屬于Rel蛋白家族成員,主要參與調節與機體免疫、炎癥反應及包括白細胞粘附有關的蛋白質分子的基因轉錄。典型的NF-κB是由p65和p50 2個亞基組成,在胞漿中通過與其抑制蛋白-κB家族緊密結合,以無活性的形式存在。外界信號可以通過活化IκB激活NF-κB,研究發現,LPS可通過破壞的上皮屏障進入循環并激活NF-κB[22],NF-κB 進入核內與靶基因 κB 序列結合,調控特定基因轉錄。活化的NF-κB核因子可以促進TNF-α等炎性細胞因子的分泌[23]和環氧化二酶(COX-2)激活,COX-2進一步促進PGE2產生[24],而這些炎性介質的大量產生是導致腸道損傷的重要原因之一[25]。本試驗研究表明,LPS刺激促進腸道黏膜NF-κB的表達,而魚油通過降低回腸黏膜中NF-κB的蛋白表達,抑制了PGE2和TNF-α的過量分泌來起到保護腸道的作用。與此相似,有試驗報道,魚油灌胃可以抑制移植腸中NF-κB的活性,并可以顯著降低移植小腸中TNF-α和 IL-6 的表達[26]。Zhao等[27]發現在人 THP-1 細胞株中,α-亞麻酸及DHA通過抑制NF-κB的活性發揮抗炎作用。此外,Li等[21]亦證明在 HK-2細胞中,EPA和 DHA能下調 LPS誘導的 NF-κB活化從而發揮抗炎的作用。
4 結論
魚油緩解了免疫應激下仔豬的腸道損傷,其機制可能是魚油降低了腸道黏膜組織中NF-κB蛋白表達起到抑制炎性因子的分泌,從而發揮保護作用。
[1]GABLER N K,SPURLOCK M E.Integrating the immune system with the regulation of growth and efficiency[J].Journal of Animal Science,2008,86:64-74.
[2]JOHNSON RW.Inhibition of growth by pro-inflammatory cytokines:an integrated view[J].Journal of Animal Science,1997,75:1244-1255.
[3]黃晶晶.精氨酸對早期斷奶仔豬腸粘膜結構和功能的調節作用及其信號機制[D].碩士學位論文.武漢:武漢工業學院,2007.
[4]王新穎.多不飽和脂肪酸影響炎癥和免疫功能的基礎研究[J].腸外與腸內營養,2007,14(1):54-58.
[5]劉玉蘭.魚油對斷奶仔豬抗免疫應激機理研究[D].博士學位論文.北京:中國農業大學,2003.
[6]阮鵬,況軍,劉杰,等.ω-3魚油脂肪乳對危重癥患者腸粘膜防護作用的研究[J].中國醫師進修雜志,2008,31(11):9-12.
[7]PSCHEIDL E,SCHYWALSKY M,TSCHAIKOWSKY K,et al.Fish oil-supplemented parenteral diets normalize splanchnic blood flow and improve killing of translocated bacteria in a low-dose endotoxin rat model[J].Critical Care Medicine,2000,28(5):1489-1496.
[8]JOHNSON R W,EVON B.Lipopolysaccharide-induced sickness behavior in pigs is inhibited by pretreatmentwith indomethacin[J].Journal of Animal Science,1994,72:309-314.
[9]WEBEL D M,FINCK B N,BAKER D H,et al.Time course of increased plasma cytokines,cortisol,and urea nitrogen in pigs follow ing intraperitoneal injection of lipopolysaccharide[J].Journal of Animal Science,1997,75:1514-1520.
[10]凌康,劉良明,付祥林.多器官功能不全綜合征的腸道保護及治療進展[J].國外醫學:生理病理科學與臨床分冊,2000,20(1):60-63.
[11]張振斌,張延和,蔣宗勇,等.大豆超濃縮蛋白對超早期斷奶仔豬、小腸黏膜結構和細胞免疫功能的影響[J].飼料工業,2003,24(10):34-36
[12]SUKHOTNIK I,MOGILNER J,KRAUSZ M M,et al.Oral arginine reduces gutmucosal injury caused by lipopolysaccharide endotoxem ia in rat[J].Journal of Surgical Research,2004,122(2):256-262.
[13]DAHLQVIST A.Assay of intestinal disaccharidases[J].Analytical Biochem istry,1968,22(1):99-106.
[14]彭彤,馬玉龍,許梓榮.納米載銅蒙脫石對斷奶仔豬生長、消化性能及二糖酶活性的影影響[J].單胃動物營養,2007,43(21):22-24.
[15]張宏光.創傷患者腸屏障功能變化及加魚油腸外營養對其的影響[D].碩士學位論文.重慶:第三軍醫大學,2009.
[16]何桂珍,董良廣,周開國,等.ω-3多不飽和脂肪酸對腸道缺血再灌注損傷和淋巴干結扎的影響[J].中華臨床營養雜志,2010,18(2):95-100.
[17]PIé S,LALLèS JP,BLAZY F,et al.Weaning is associated with an upregulation of expression of inflammatory cytokines in the intestine of piglets[J].The Journal of Nutrition,2004,134,641-647.
[18]MCKAY D M,BAIRD A W.Cytokine regulation of epithelial permeability and ion transport[J].Gut,1999,44,283-289.
[19]楊小平.日糧油脂調控肉雞腸道粘膜免疫和免疫應激信號傳導的研究[D].博士學位論文.北京:中國農業大學,2006.
[20]鞏濤,李勇,范立橋,等.ω-3多不飽和脂肪酸對人胃癌BGC-823細胞PGE2、SOD和 MDA的影響[J].中國腫瘤臨床,2006,33(19):1102-1104.
[21]LIH,RUAN X Z,POW IS S H,et al.EPA and DHA reduce LPS-induced inflammation responses in HK-2 cells:evidence for a PPAR gamma-dependent mechanism[J].Kidney International,2005,67(3):867-874.
[22]李玥,錢家鳴.雙歧桿菌對葡聚糖硫酸鈉(DSS)誘導的小鼠結腸炎腸道黏膜的保護作用及其對NF-κB的影響[J].現代消化及介入診療,2010,14(3):131-135.
[23]SABROE I,PARKER L C,DOWER S K,et al.The role of TLR activation in inflammation[J].The Journal of Pathology,2008,214:126-135.
[24]WATKINS B A,LIY,ALLEN K G D,et al.Dietary ratio of(n-6)/(n-3)polyunsaturated fatty acids alters the fatty acid com position of bone com partments and biomarkers of bone formation in rats[J].The Journal of Nutrition,2000,130:2274-2284.
[25]BLIKSLAGER A T,MOESER A J,GOOKIN J L,et al.Restoration of barrier function in injured intestinal mucosa[J].Physiological Reviews,2007,87:545-564.
[26]馬昊.n-3多不飽和脂肪酸改善大鼠小腸移植慢性排斥中的血管病變[D].博士學位論文.南京:南京大學,2007.
[27]ZHAO G,ETHERTON T D,MARTIN K R,et al.Anti-inflammatory effects of polyunsaturated fatty acids in THP-1 cells[J].Biochem ical and Biophysical Research Communications,2005,336(3):909-917.
*Corresponding author,associate professor,E-mail:yulanflower@126.com
(編輯 田艷明)
Fish Oil Supp lem entation Protects against Intestinal M ucosa Injury Induced by Lipopolysaccharide Challenge in Piglets
WU Zhifeng LIU Yulan*HONG Yu ZHU Huiling HOU Yongqing DING Bingying
(Hubei Key Laboratory of Animal Nutrition and Feed Science,Wuhan Polytechnic University,Wuhan430023,China)
This experimentwas conducted to study the protective effects of fish oil on intestinalmucosa injury of piglets challenged with lipopolysaccharide(LPS).Thirty-two crossbred(Duroc×Landrace×LargeWhite)piglets weaned at(28 ±3)d of age with body weight of(8.91 ±0.74)kg were used in a 2 ×2 factorial design.The piglets were random ly assigned to 4 groups with 4 replicates per group and 2 piglets per replicate.Themain factors consisted of diet(5%corn oil or 5%fish oil)and immunological challenge(LPS injection or physiological saline injection).The experiment lasted for 19 days.On day 19,half of piglets in every diet group were injected intraperitoneally with either 150μg/kg BW of LPS or an equivalent amount of sterile saline.At4 h after LPS challenge,the pigletswere slaughtered to collect intestinalmucosa samples for analysis.The results showed as follows:1)LPS challenge reduced the villus height and crypt depth in jejunum and ileum(P<0.05).Fish oil supplementation improved villus height,crypt depth and the ratio of villus height to crypt depth in ileum(P<0.05).2)LPS challenge reduced the activities of lactase,sucrase and maltase in jejunum(P<0.05).The sucrase activity of piglets fed fish oilwas improved in jejunum(P<0.05).The lactase activity of piglets fed fish oil and injected physiological salinewas increased in ileum(P<0.05).3)LPS challenge increased tumor necrosis factor-α (TNF-α)and prostaglandin E2(PGE2)contents in jejunum and ileum(P<0.05).Piglets fed fish oil had lower TNF-α level than piglets fed corn oil(P< 0.05).Fish oil supplementation inhibited PGE2contents in jejunum(P<0.10).4)LPS challenge increased nuclear transcription factor-kappaB(NF-κB)protein expression in jejunum and ileum(P<0.05).Fish oil suppressed NF-κB protein expression in ileum(P<0.05).These results suggest that fish oil can alleviate intestine damage induced by LPS challenge.Additionally,the protective effects of fish oil on the intestine are associated with decreasing the production of intestinal pro-inflammatory parameters through inhibiting NF-κB expression.[Chinese Journal of Animal Nutrition,2011,23(10):1775-1782]
fish oil;immunological stress;piglet;pro-inflammatory parameters;NF-κB
S 828;S816.7
A
1006-267X(2011)10-1775-08
10.3969/j.issn.1006-267x.2011.10.018
2011-04-14
新世紀優秀人才支持計劃(NCET-10-0158);國家自然科學基金面上項目(30972109);湖北省自然科學基金項目(重點2010CDA 050;面上2009CDB006);武漢市科技計劃項目(201171034320)
吳志鋒(1986—),男,湖北仙桃人,碩士研究生,從事豬的營養生理與機理調控研究。E-mail:molang1027@yahoo.com.cn
*通訊作者:劉玉蘭,副教授,碩士生導師,E-mail:yulanflower@126.com

