β-防御素在金華豬和長白豬腸道中表達規律的研究
安 沙 韓菲菲 高彥華 劉倚帆 汪以真
(浙江大學飼料科學研究所,動物分子營養學教育部重點實驗室,浙江省動物飼料與營養重點實驗室,杭州 310029)
β-防御素在金華豬和長白豬腸道中表達規律的研究
安 沙 韓菲菲 高彥華 劉倚帆 汪以真*
(浙江大學飼料科學研究所,動物分子營養學教育部重點實驗室,浙江省動物飼料與營養重點實驗室,杭州 310029)
本試驗旨在研究金華豬和長白豬從初生到60日齡不同腸段中3種β-防御素[β-防御素-1(pBD-1)、β-防御素 -2(pBD-2)和 β-防御素 -3(pBD-3)]基因表達規律,并比較β-防御素基因在2個品種之間的表達差異。選取初生、20、40和60日齡的金華豬和長白豬各3頭,屠宰后取十二指腸、空腸、回腸和結腸組織,實時定量PCR法檢測各腸段pBD-1、pBD-2和pBD-3基因的表達量。結果表明:1)從初生到60日齡,隨日齡的增加pBD-1和pBD-3基因在豬腸道中的表達量升高,pBD-2基因在十二指腸和空腸中的表達量升高,而在豬結腸和回腸中的表達量先下降后上升。2)在20、40和60日齡時,金華豬各腸段中3種β-防御素基因的表達量均高于長白豬。3)初生和20日齡,金華豬十二指腸pBD-1基因表達量極顯著高于長白豬(P<0.01);60日齡pBD-1基因在空腸、回腸和結腸中的表達量,金華豬顯著高于長白豬(P<0.05),pBD-2基因在十二指腸、回腸和結腸的表達量,金華豬顯著高于長白豬(P<0.05),金華豬pBD-3基因在十二指腸、空腸和回腸的表達量顯著高于長白豬(P<0.05),結腸中的表達量極顯著高于長白豬(P<0.01)。結果顯示,初生到60日齡,pBD-1和pBD-3基因在豬腸道中的表達呈上升趨勢,金華豬腸道中3種β-防御素的表達水平在20、40和60日齡均高于長白豬。
β-防御素;金華豬;長白豬;腸道;基因表達
抗菌肽是一類廣泛存在于動植物體內的小分子肽,作為哺乳動物先天性免疫的第一道防線,對抵御外來微生物的入侵發揮重要作用[1]。與抗生素相比,抗菌肽除具有廣譜的抗細菌、真菌和病毒作用外,還具有分子量小、熱穩定性高、水溶性好、不易產生耐藥性等優點,因此成為了研究熱點[2]。作為哺乳動物體內重要抗菌肽,防御素廣泛分布在動物呼吸道、消化道等上皮組織中,是一類富含精氨酸的陽離子多肽,含有6~8個半胱氨酸組成的3~4個二硫鍵,形成的分子結構穩定。根據防御素二硫鍵的連接位置及形成的空間結構,可將其分為α-、β-和θ-防御素[3]。其中,在豬體內僅發現了β-防御素,研究較多的是β-防御素-1(pBD-1)、β-防御素 -2(pBD-2)和 β-防御素-3(pBD-3)。此3種防御素廣泛分布于豬的呼吸道、消化道、胸腺、脾臟、淋巴結、腦、肝、腎、皮膚、骨髓和臍帶中,參與組成機體的先天性免疫系統[4]。目前,對防御素的研究多集中于其抗菌能力及機理方面,對其在豬先天性免疫系統(特別是腸黏膜免疫)中作用的研究較少[5]。研究表明,pBD-1和pBD-3基因為組成型表達,在豬的腸黏膜具有較高表達量[6];pBD-2基因為誘導型表達,在豬腸道中的表達受腸道微生物的影響,如沙門氏菌可上調體外培養腸上皮細胞系pBD-2基因的表達[7]。
金華豬,又稱“金華兩頭烏”,是我國著名的優良地方品種之一,具有肉品質好、繁殖率高、抗逆性強等優點。原產丹麥的長白豬,因生長速度快、飼料轉化率高,而在世界各地廣泛分布,但該品種的抗逆性有所下降[8]。研究表明不同豬種的抵御外界病原微生物入侵的能力有別,且其免疫力也有所差異。通過免疫功能比較試驗證明,杜洛克和大白豬的免疫力存在差異[9];同樣飼養管理條件下,大白豬和太湖豬的免疫功能也具有明顯差異[10]。但是,這種差異出現的機制卻鮮有報道。本試驗通過實時定量PCR法,檢測β-防御素基因在金華豬和長白豬不同腸段中的表達量、表達規律和不同品種間的表達差異,為揭示豬抗菌肽基因表達水平與抗病力和免疫功能之間的關系奠定基礎,為闡明抗菌肽在腸道免疫功能中的作用積累試驗數據。
1 材料與方法
1.1 試驗材料及樣品處理
選取相同環境下飼養的初生、20、40和60日齡的金華豬和長白豬各3頭,試驗期間豬自由采食、飲水,飼養管理按日常管理進行。屠宰前空腹12 h,放血致死,取十二指腸、空腸、回腸和結腸腸段各3 cm,所取各腸段位置相對固定,棄內容物,用預冷的磷酸緩沖液(PBS)沖洗干凈,液氮速凍,-80℃保存備用。
1.2 總RNA提取
取50mg樣品于液氮預冷的研缽中,加液氮研磨至粉末,轉移到1.5 m L離心管,加1 m L Trizol(Invitrogen公司,美國),劇烈震蕩;冰上靜置5 m in,加 0.2 m L 氯仿,劇烈震蕩15 s,12 000 ×g、4℃離心15 m in;吸上清液于新的離心管中,加入等體積異丙醇,低溫靜置30 m in;12 000×g、4℃離心10 m in,棄上清,加1 m L 75%乙醇洗滌;12 000×g、4℃離心 8 m in,棄上清,干燥后加入30μL無酶水溶解。紫外分光光度計檢測樣品260 nm和280 nm的吸光值,計算提取的總RNA濃度,計算 OD260nm/OD280nm,比值在 1.8 和 2.0 之間的樣品可用于下一步試驗。
1.3 反轉錄
反應體系中加入 2μg總 RNA,1μL 10μmol/L隨機引物及相應體積的無酶水,65℃孵育5 m in,立即置于冰上;加4μL 5×反轉錄緩沖液、2 μL 10 mmol dNTP、1 μL M-M uLV 反轉錄酶(200 U),終體積為20μL,25℃孵育10 m in后,轉入42℃,孵育1 h。
1.4 實時定量PCR
1.4.1 引物設計
以18S rRNA為內參,內參基因和目標基因的引物序列均參考文獻[11-13],引物由上海生工生物工程有限公司合成。引物序列及參數見表1。
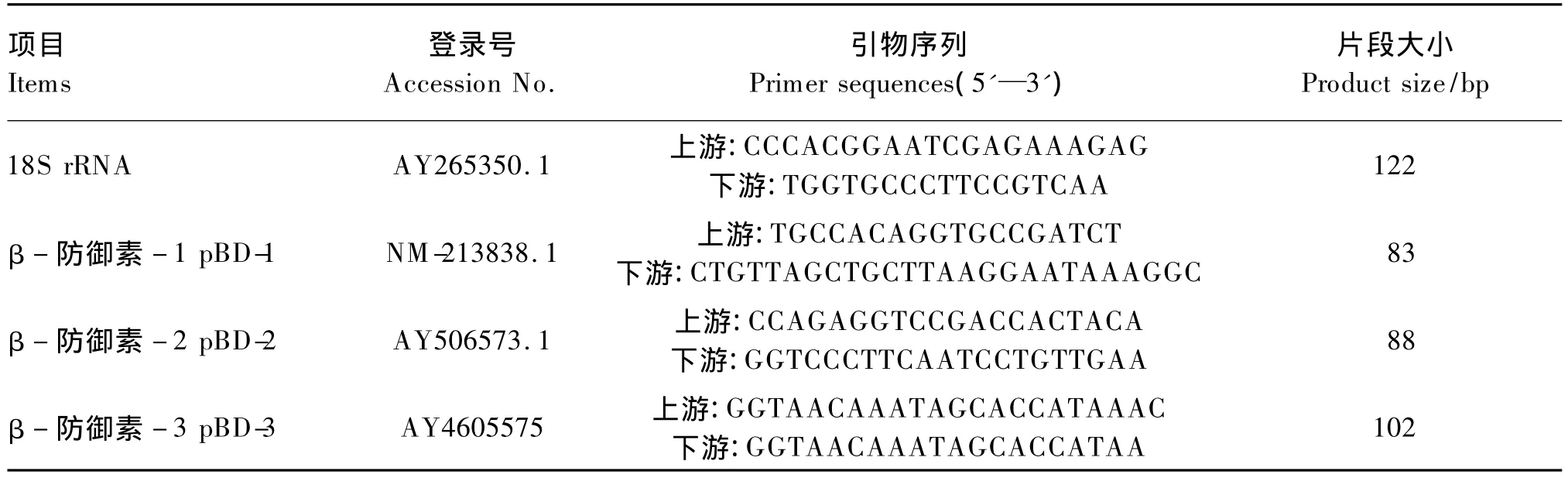
表1 實時定量PCR引物序列及參數Table 1 Sequences and parameters of primers for real-time PCR
1.4.2 實時定量PCR反應
利用反轉錄合成的cDNA對18s rRNA及目的基因進行實時定量PCR。PCR擴增體系如下:1μL模板 cDNA、0.5 μL 上游引物、0.5 μL 下游引物、10.4 μL SYBR Green PCR Mix,加水補足至20μL。PCR反應條件:94℃預變性2 m in;94℃變性10 s,61℃退火延伸30 s,共40個循環。PCR結束后,將擴增產物用1%瓊脂糖凝膠電泳法檢測目的基因條帶大小。
用比較模板的域值循環數(Ct)相對定量法研究腸道組織中3種防御素mRNA的表達量。以內參基因18S rRNA為參比,目的基因相對表達量以2-△△Ct表示。
1.5 數據處理
數據采用SPSS 16.0統計軟件進行統計整理,結果用平均值±標準差表示,各組織間的基因表達采用One-way ANOVA分析,并用Duncan氏法進行多重比較,2品種間的統計用t檢驗法進行。
2 結果
2.1 pBD-1基因在豬腸道中的表達規律
由圖1可見,豬不同腸段pBD-1基因表達量隨日齡變化存在一定規律,不同品種間亦存在差異。從初生到60日齡,pBD-1基因表達量隨日齡增加呈現上升趨勢。所有日齡金華豬各腸段的表達量均高于長白豬,其中十二指腸在初生和20日齡的表達量極顯著高于長白豬(P<0.01),40日齡顯著高于長白豬(P<0.05);60日齡,空腸、回腸和結腸中的基因表達量均顯著高于長白豬(P<0.05)。
2.2 pBD-2基因在豬腸道的表達規律
由圖2可見,豬腸道pBD-2基因的表達隨日齡變化存在一定規律,不同品種間存在差異。初生到60日齡,在十二指腸和空腸的表達量,隨豬日齡的增加呈現上升趨勢;回腸和結腸的表達量隨日齡增加呈現先下降后上升的趨勢。所有日齡金華豬腸道pBD-2基因表達量均高于長白豬,其中十二指腸、回腸和結腸中的表達量在60日齡時顯著高于長白豬(P<0.05)。
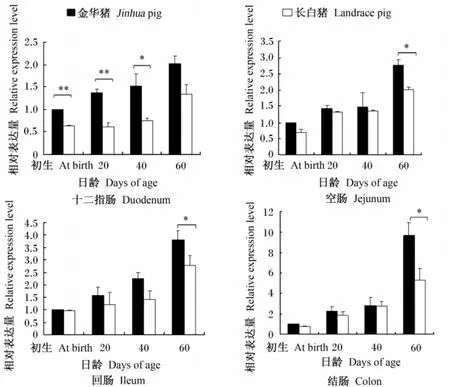
圖1 金華和長白豬不同腸段pBD-1基因相對表達量Fig.1 Relative expression levels of pBD-1 gene in different segments of intestine of Jinhua and Landrace pigs

圖2 金華和長白豬不同腸段pBD-2基因相對表達量Fig.2 Relative expression levels of pBD-2 gene in different segments of intestine of Jinhua and Landrace pigs
2.3 pBD-3基因在豬腸道的表達規律
由圖3可見,豬腸道pBD-3基因的表達隨日齡變化存在一定規律,不同品種間存在差異。初生到60日齡,隨日齡增加pBD-3基因在4個腸段表達量呈現上升趨勢。在20、40和60日齡,金華豬所有腸段pBD-3基因的表達量均高于長白豬,其中60日齡,金華豬十二指腸、空腸和回腸的表達量均顯著高于長白豬(P<0.05),結腸中的表達量極顯著地高于長白豬(P<0.01)。
3 討論
作為哺乳動物先天性免疫系統的重要組成部分,抗菌肽在機體的免疫中發揮著重要作用。抗菌肽與抗生素相比,抗菌譜廣、抗菌機理獨特,因而成為近年來研究的熱點[14]。對于抗菌肽的研究多集中在體外抗菌、作用機制等方面,而對其基因在體內表達變化的研究較少。本試驗以地方(金華豬)和引進品種豬(長白豬)為研究對象,比較了不同日齡、品種、腸段的β-防御素基因表達量,初步揭示了抗病力不同的2個品種豬體內防御素的表達特點。
本試驗結果表明,從初生到60日齡,2品種仔豬腸道中pBD-1和pBD-3基因表達量隨日齡的增加而上升,pBD-2基因的表達趨勢較為復雜。防御素是宿主執行免疫防御能力的細胞所分泌的、具有殺微生物活性和細胞毒性的小分子多肽。β-防御素在動物呼吸道、消化道,以及胸腺、腦、心臟等各組織器官中廣泛分布[15]。一般認為,防御素基因的表達方式有2種:組成型和誘導型。其中 pBD-1和 pBD-3基因為組成型表達[16],pBD-1基因的表達具有組織特異性,在舌組織的表達量高于在其他組織器官[17]。作為誘導型的防御素,PBD-2基因的表達受多種因素影響[18],如鼠傷寒DT104沙門氏菌,它能夠上調IPI-2細胞系pBD-2基因的表達[12]。研究表明初生、7、28 和49日齡仔豬,舌組織中pBD-1基因表達量隨日齡增加而上升[17];從初生到28日齡,隨著日齡增加骨髓抗菌肽(protegrin-1)基因的表達量顯著增加,28日齡斷奶應激引起了抗菌肽表達量有所下降,但斷奶后2周抗菌肽表達又呈增加趨勢[19]。本試驗結果揭示了金華豬和長白豬β-防御素基因在4個腸段均有表達,且pBD-1和pBD-3基因的表達隨日齡呈現上升趨勢,與上述研究結果類似。該變化趨勢與2種β-防御素的組成型表達有關,β-防御素由仔豬腸道上皮細胞合成分泌,形成抵御微生物的分子屏障[20],隨豬日齡的增加,其腸道黏膜免疫功能逐漸完善,防御素在仔豬腸道免疫中發揮的作用也日趨顯現,因而防御素的表達隨日齡增加而呈現上升趨勢。誘導型防御素pBD-2在十二指腸和空腸的表達隨日齡的增加而呈上升趨勢,而在回腸和結腸的表達隨日齡的增加呈現先下降后上升的趨勢。可能由于pBD-2基因的表達與回腸和結腸中多種微生物的形成有關,因而在這個2個腸段中的表達呈現更為復雜。
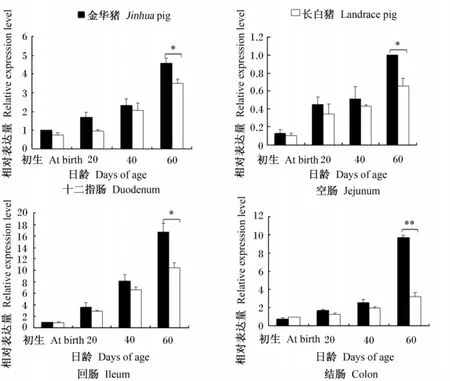
圖3 金華長白豬不同腸段pBD-3基因相對表達量Fig.3 Relative expression levels of pBD-3 gene in different segments of intestine of Jinhua and Landrace pigs
通過比較初生、20、40和60日齡的金華豬和長白豬腸道β-防御素基因的表達量,可以看出金華豬腸道內3種β-防御素基因的表達量均高于長白豬。在梅山豬的多數組織中3種β-防御素基因的表達均高于長白豬[21],與本試驗結果類似;藏豬pBD-1和pBD-3基因在多數組織中的表達量高于杜 長 大雜交豬[13]。這是不同品種的豬的抗病力不同的因素之一。
本試驗對2個豬種的腸道防御素表達的研究表明,pBD-1基因在初生、20和40日齡金華豬的十二指腸中表達量極顯著的高于長白豬,這可能與在仔豬生長的前期階段,組成表達型的pBD-1在豬十二指腸中的免疫起著重要作用有關。隨日齡的增加,pBD-2和pBD-3基因的表達量在60日齡金華豬和長白豬各腸段的表達有顯著差異,可能是由于隨仔豬的生長,這2種防御素在免疫和抗病方面起的作用逐漸凸顯。仔豬自身的生長發育各階段,起主要作用的防御素不同可能是造成地方優良品種金華豬和國外引進品種長白豬抗病力不同的另一方面因素。上述研究結果說明免疫力不同豬腸道內防御素的表達存在差異,且地方品種腸道防御素的表達量高于引進品種。本試驗初步揭示了免疫力不同的豬腸道內防御素的表達有差異,為進一步研究抗菌肽表達與免疫力、抗病力之間的關系奠定基礎。
4 結論
①初生到60日齡,仔豬腸道pBD-1和pBD-3基因的表達量在2種豬各腸段均隨日齡的增加呈上升趨勢,pBD-2在豬回腸和結腸的表達量隨日齡的增加呈現先下降后上升的趨勢。
②金華豬腸道中3種防御素的表達量在20、40和60日齡均高于長白豬。
[1]ZHANG G,ROSS C R.Porcine antim icrobial peptides:new prospects for ancientmolecules of host defense[J].Veterinary Research,2000,31:277 -296.
[2]馬衛明,佘銳萍,彭芳珍,等.豬小腸抗菌肽的提取及部分生物學活性研究[J].科學技術與工程,2004,4(3):202 -205.
[3]GANZ T.Defensins,antim icrobial peptides of innate immunity[J].Nature Review Immunology,2003,3(9):710-720.
[4]AONO S,LIC,ZHANG G,et al.Molecular and function characterization of bovine β-defensin-1[J].Veterinary Immunology Immunopathology, 2006,113(12):181-190.
[5]周聯,俞瑜.防御素與先天性免疫和獲得性免疫[J].國外醫學(免疫學分冊),2005,28(2):68 -72.
[6]SANG Y,PATIL A A,ZHANG G,et al.Bioinformatic and expression analysis of novel porcine betadefensins[J].Mammalian Genome,2006,17(4):332-339.
[7]VELDHUIZEN E J,HENDRIKS H G,HOGENKAMP A,et al.Differential regulation of porcine betadefensin 1and 2 uponSalmonellainfection in the intestinal epithelial cell line IPI-2I[J].Veterinary Immunology Immunopathology,2006,114:94-102.
[8]陳效華.豬育種的理論與實踐[M].北京:中國農業出版社,1990.
[9]NGUYEN T X,COLE A M,LEHRER R I.Evolution of primate theta-defensins:a serpentine path to a sweet tooth[J].Peptides,2003,24(11):1647 -1654.
[10]楊倩,毛衛華,陳杰,等.太湖豬與大白豬小腸發育及其免疫功能形態學比較[J].南京農業大學學報,2001,24(4):75 -78.
[11]SHAN T,WANG Y,WU T,et al.Porcine adipose triglyceride lipase com plementary deoxyribonucleic acid clone,expression pattern,and regulation by resveratrol[J].Journal of Animal Science,2008,86(8):1781-1788.
[12]VELDHUIZEN E J,VAN DIJK A,TERSTEEG M H,et al.Expression of beta-defensins pBD-1 and pBD-2 along the small intestinal tract of the pig:lack of upregulationin vivouponSalmonella typhimuriuminfection[J].Moleculor Immunology,2007,44(4):276-283.
[13]QISR N,CHEN JY,GUO R F,etal.β-defensins gene expression in tissues of the crossbred andTibetanpigs[J].Livestock Science,2009,123:161 -168.
[14]IZADPANAH A,GALLO R L.Antim icrobial peptides[J].Journal of the American Academ y of Dermatology,2005,52(3):381-390.
[15]余興邦,郭鎖鏈,烏翠蘭,等.防御素研究進展[J].動物醫學進展,2006,27(8):47 -51.
[16]CAVERLY JM,DIAMOND G,GALLUP JM,et al.Coordinated expression of tracheal antim icrobial peptide and inflammatory-response elements in the lungs of neonatal calves with acute bacterial pneumonia[J].Infection Immunology,2003,71(5):2950-2955.
[17]ZHANG G,WU H,SHIJ,et al.Molecular cloning and tissue expression of porcine beta-defensin-1[J].FEBS Letters,1998,424(1/2):37 -40.
[18]MEYERHOLZ D K,GALLUP J M,GRUBOR B M,et al.Developmental expression and distribution of sheep beta-defensin-2[J].Developmental and Comparative Immunology,2004,28(2):171-178.
[19]趙玉蓉,周燦,范志勇,等.斷奶及日齡對仔豬骨髓組織抗菌肽Protegrin-1 mRNA表達的影響[J].動物營養學報,2007,19(5):605 -609.
[20]王恬,鐘翔.仔豬腸道黏膜營養和腸道修復[J].飼料工業,2008,29(2):2 -5.
[21]CHEN JY,QISR N,GUO R F.Differentmessenger RNA expression for the antim icrobial peptidesβdefensins betweenMeishanand crossbred pigs[J].Molecular Biology Reports,2009,37(3):1633 -1639.
*Corresponding author,professor,E-mail:yzwang@zju.edu.cn
(編輯 王智航)
Gene Expression Profile ofβ-Defensins in Intestinal Tract ofJinhuaand Landrace Pigs
AN Sha HAN Feifei GAO Yanhua LIU Yifan WANG Yizhen*
(Key Laboratory for Molecular Animal Nutrition of Ministry of Education,Key Laboratory for Feed and Animal Nutrition of Zhejiang Province,Institute of Feed Science,Zhejiang University,Hangzhou310029,China)
The study was conducted to investigate gene expression regularity of the three kinds ofβ-defensins[β-defensins-1(pBD-1),β-defensins-2(pBD-2)andβ-defensins(pBD-3)]in different segments of intestinal tract inJinhuaand Landrace pigs from new-born to 60 days of age,and to compare differences ofβ-defensins gene expression between the two breeds.Three heads ofJinhuapigs and Landrace pigs(new-born,20,40 and 60 days of age)were selected and slaughtered,respectively,and tissue samples of duodenum,jejunum,ileum and colon were collected for analysis of gene expression levels of pBD-1,pBD-2,pBD-3 by real-time PCR.The results showed as follows:1)with the days of age increasing,pBD-1 and pBD-3 gene expression levels in intestine increased,and pBD-2 gene expression level in duodenum and jejunum increased,while that in ileum and colon tended tofirstly decrease and then increase.2)A t20,40 and 60 days of age,gene expression levels of the threeβ-defensins in different segments of intestine inJinhuapigswere higher than those in Landrace pigs,respectively.3)gene expression level of pBD-1 in duodenum ofJinhuapigswas significantly higher than thatof new-born and 20-day-age Landrace pigs(P<0.01);at60 days of age,gene expression level of pBD-1 in jejunum,ileum and colon ofJinhuapigswas significantly higher than that of Landrace pigs(P<0.05),gene expression level of pBD-2 in duodenum,ileum and colon ofJinhuapigswas significantly higher than that of Landrace pigs(P<0.05),and gene expression level of pBD-3 in duodenum(P<0.05),jejunum(P<0.05),ileum and colin(P<0.01)ofJinhuapigs was significantly higher than that of Landrace pigs(P<0.05).These results indicate that the gene expression levels of pBD-1and pBD-3 increase in the intestinal tractof pigs from birth to 60 days of age,and gene expression levels of the threeβ-defensins inJinhuapigs are higher than those in Landrace pigs at20,40 and 60 days of age.[Chinese Journal of Animal Nutrition,2011,23(10):1762-1768]
β-defensins;Jinhuapigs;Landrace pigs;intestinal tract;gene expression
S828
A
1006-267X(2011)10-1762-07
10.3969/j.issn.1006-267x.2011.10.016
2011-05-06
高等學校全國優秀博士學位論文作者專項資金資助項目(2007B6)資助
安 沙(1987—),女,山東棗莊人,碩士研究生,從事動物營養與免疫的研究。E-mail:ansha168@163.com
*通訊作者:汪以真,教授,博士生導師,E-mail:yzwang@zju.edu.cn
book=10,ebook=491

