低分子右旋糖酐與地塞米松預防脂肪栓塞綜合征的實驗研究
蔡賢華,吳璐鋒,劉曦明,徐 峰,黃衛兵,汪國棟,魏世俊
骨折并發脂肪栓塞綜合征(fat embolism syndrome,FES)的救治相當困難,目前尚未取得明顯突破,預防一直是FES研究的重點,藥物逐漸成為預防FES的重要措施之一[1-4]。在早期固定骨折的基礎上,單一藥物(如地塞米松等)已顯示出一定的預防效果[1-5],但FES仍有一定的發生率,說明FES發病機制的復雜性。而低分子右旋糖酐加地塞米松聯合應用臨床觀察顯示其預防FES的療效較兩藥單用強[5],但無相關的動物實驗證實。因此,本研究以靜脈注射油酸法建立大鼠FES動物模型,觀察低分子右旋糖酐、地塞米松及其聯用對FES的預防效果,旨在探討這些藥物預防FES的作用及其機制,為臨床應用提供理論依據。
材料與方法
1 材料
健康雄性Wistar大鼠(廣州軍區武漢總醫院實驗中心提供),體重300~320g。油酸注射液(國藥集團化學試劑有限公司),低分子右旋糖酐(武漢濱湖雙鶴藥業),地塞米松(湖北天藥藥業股份有限公司),腫瘤壞死因子-α(tumor necrosis factor-α,TNFα),髓過氧化物酶(myeloperoxidase,MPO)測試盒(南京建成生物工程研究所),ELISA試劑盒(武漢博士德生物科技有限公司)。
2 實驗方法
大鼠80只,飼養2周后,隨機分為4組:低分子右旋糖酐組(A組)、地塞米松組(B組)、地塞米松及低分子右旋糖酐聯用組(C組)、空白對照組(D組),每組20只。
采用10%水合氯醛腹腔注射(0.3ml/100g)麻醉后,經大鼠尾靜脈分別注射相應藥物:低分子右旋糖酐20ml/kg加油酸0.2ml/kg(A組)、地塞米松35mg/kg加油酸0.2ml/kg(B組)、低分子右旋糖酐20ml/kg加地塞米松25mg/kg加油酸0.2ml/kg(C組)、油酸0.2ml/kg(D組)。于注射后1、2、3、4小時隨機取5只大鼠行動脈血氧分壓(PaO2)測定,然后放血法處死大鼠,取肺組織進行相關檢測。
3 PaO2檢查
于注射前及注射后各時間點,經頸動脈抽取血液0.3ml,立即行PaO2測定。
4 MPO、TNF-α測定
于各時間點取肺組織,用等滲鹽水為遞質制成20%勻漿,隨機分為兩部分。一部分按MPO測試盒說明操作,在460nm處,10mm光徑,測各管吸光度值;另一部分4 000r/min離心10分鐘(4℃),取上清液按TNF-αELISA試劑盒說明操作,在450nm處測定光密度值,通過標準曲線計算TNF-α生成量。
5 組織學檢查
于4小時取肺組織分別行光鏡和電鏡觀察。光鏡標本用10%甲醛浸泡,逐級脫水,石蠟包埋,HE染色。透射電鏡標本則用3%戊二醛前固定24小時以上,1%鋨酸后固定,脫水后樹脂包埋,橫斷面超薄切片,鈾-鉛復染色。
6 統計學分析
結 果
1 一般情況
各組大鼠尾靜脈注射油酸及相應藥物后,均表現為心跳加快、呼吸急促,以D組最明顯,但無死亡。
2 PaO2檢查結果
藥物注射前大鼠PaO2為(12.67±0.58)kPa,注射后PaO2均為C組>B組>A組>D組(圖1),組間差異具有統計學意義(F=41.076,P<0.01)。其中,注射1小時時各組均下降:D組最明顯(下降近1/2),A組次之,C組最輕;隨后PaO2均呈進行性上升:C組2小時、B組3小時、A組4小時接近或超過注射前水平,但D組PaO2上升緩慢且4小時時仍低于A組1小時水平。
3 TNF-α檢查結果
注射后1~4小時均為D組>A組>B組>C組(圖2),4組之間差異均有統計學意義(F=50.074,P<0.01;F=46.388,P<0.01;F=67.575,P<0.01;F=73.879,P<0.01)。其中,注射后1、2小時,各組TNF-α值先逐漸上升,隨后呈下降趨勢,4小時時TNF-α含量均低于初始值。
4 MPO檢查結果
注射后各用藥組肺組織MPO值低于空白對照組:D組>A組>B組>C組(圖3),4組之間的差異具有統計學意義(F=13.257,P<0.01;F=23.716,P<0.01;F=6.204,P<0.01;F=73.285,P<0.01)。其中,注射1、2、3小時時,各組MPO值基本上呈逐漸上升趨勢,4小時時下降。
5 組織學改變
光鏡觀察各組均有廣泛肺泡間質水腫與肺泡腔滲出,以D組最為嚴重,A、B組有不同程度減輕,C組最輕(圖4)。電鏡檢查見A組、B組肺泡Ⅱ型細胞內線粒體均呈不同程度腫脹,肺泡腔內散見油酸滴,并見白細胞、纖維素滲出;C組Ⅱ型細胞內板層小體良好,肺泡腔內可見單核細胞及紅細胞滲出;D組Ⅱ型細胞退變,胞漿內板層小體破裂,肺泡腔內可見較多巨噬細胞及纖維素等滲出(圖5)。

圖1 各組PaO2水平隨時間變化

圖2 各組TNF-α`隨時間的變化趨勢

圖3 各組MPO隨時間的變化趨勢

圖4 各組肺組織光鏡下改變
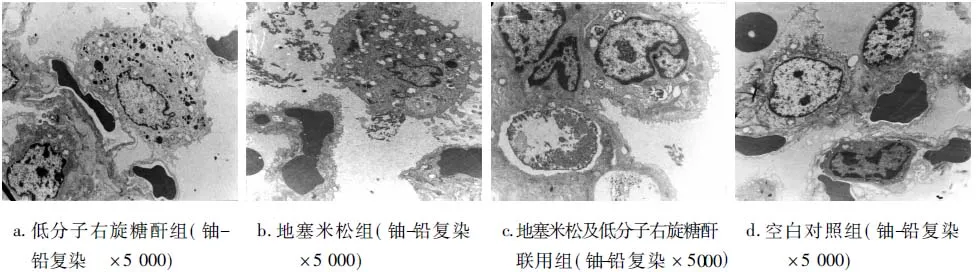
圖5 各組肺組織電鏡下改變
討 論
1 油酸靜脈注射制作FES動物模型的特點
靜脈注射油酸、甘油三油酸酯、骨髓脂肪均可制作FES動物模型[1,6]。由于肺血管栓塞或血管內皮細胞損傷,動物注射后出現呼吸急促、心動過速、PaO2下降;病理學檢查呈現肺泡內滲出,肺間質充血、水腫或壞死及炎性細胞浸潤等化學性肺部炎癥改變[6-8],這些表現與FES相似。骨髓脂肪制作的模型與臨床最為接近,但小型動物不易提取。油酸所致模型優點是簡單易得,模型穩定且重復性強,成本低;缺點是油酸劑量與注射速度不易掌握,劑量偏小或速度過慢PaO2下降不明顯,劑量偏大或速度過快容易死亡,不利于長時間觀察。精確控制油酸劑量與注射速度,可顯著提高造模的成功率與可行性,此方法已廣泛用于FES、急性呼吸窘迫綜合征(ARDS)、急性肺損傷等研究[6-8]。故本實驗選用油酸靜脈注射法制備動物模型。
FES的病變主要在肺,臨床表現以低氧血癥為主。注射油酸前PaO2為(12.67±0.58)kPa、注射油酸后1小時時PaO2降為(6.43±0.57)kPa,說明PaO2變化明顯。筆者結合人類FES診斷標準[2,5,8],以PaO2≤8kPa為大鼠FES低氧血癥的判斷標準。當油酸靜脈注射劑量為0.2ml/kg時,大鼠PaO2下降能達到此標準。本實驗靜脈注射油酸后大鼠表現為呼吸、心跳加快、PaO2下降;病理切片示大鼠肺組織表現出廣泛出血,肺葉梗死(圖4、5),這表明FES模型制作是成功的。
2 地塞米松與低分子右旋糖酐對FES的預防作用與機制探討
PaO2是早期診斷FES的可靠且敏感指標之一,也是肺組織損傷時肺部病理改變的直接反應,阻止PaO2降低、減輕肺組織損傷是FES預防中的關鍵措施[9]。本實驗顯示,使用藥物初期能不同程度地減輕油酸注射所引起的PaO2下降,且隨著時間的推移,各用藥組PaO2逐漸上升,其作用:C組>B組>A組。這表明地塞米松、低分子右旋糖酐均能降低FES低氧血癥發生的風險或程度,聯合用藥作用最強,地塞米松次之。組織學檢查結果與之相對應,即各用藥組均能明顯降低FES引起的肺部病理改變(圖4、5):聯合用藥>地塞米松>低分子右旋糖酐。可能的原因是各用藥組能不同程度地抑制或降低對肺泡Ⅱ型細胞損害,減輕肺泡壁水腫與肺泡腔滲出。此結果與文獻報道類似[1-5]。
TNF-α、MPO主要分別由巨噬細胞及中性粒細胞分泌。TNF-α在油酸所致肺損傷中是一個前炎性遞質[9],能誘導中性粒細胞、淋巴細胞、單核細胞等分泌具有趨化中性粒細胞功能的白細胞介素-8(IL-8),中性粒細胞被激活后脫顆粒、釋放溶酶體,導致MPO峰值出現,產生過多的氧自由基;同時它介導肺毛細血管內皮細胞的損害,增加其通透性,并刺激內皮細胞釋放大量組織因子,損害毛細血管的抗凝功能,導致微血栓的形成,從而引起急性肺水腫[3,9-10]。因此,肺組織中TNF-α、MPO的變化能在一定程度上反映FES的嚴重程度及其發病機制。本實驗中各組TNF-α于2小時達到高峰,與文獻報道相似[9]。各用藥組TNF-α水平較空白對照組低(D組>A組>B組>C組),隨時間延長而作用更明顯(圖2)。除峰值延緩1小時外,MPO水平的變化與TNF-α相似。這些現象與同時相PaO2和肺組織病理改變呈對應關系,表明各用藥組均具有預防FES作用(聯合用藥>地塞米松>低分子右旋糖酐),其主要機制可能是穩定巨噬細胞和中性粒細胞細胞膜,從而減少其相應細胞因子的生成。此外,地塞米松還能阻止炎癥應答反應并抑制血小板聚集[3],低分子右旋糖酐能減輕肺內紅細胞聚集,改善微循環[5,9]。
綜上所述,地塞米松、低分子右旋糖酐均具有一定的預防大鼠FES作用,聯合用藥作用最強,地塞米松次之。其機制較為復雜,聯合用藥可能是同時阻斷了FES發生的多個病理環節,包括穩定巨噬細胞和中性粒細胞等細胞膜、抑制對肺泡Ⅱ型細胞損害并減少肺組織TNF-α與MPO生成或改善肺內微循環等。
[1]Lee JE,Jea SY,Oum BS,et al.Effect of fat embolism with triolein emulsion on blood-retinal barrier[J].Ophthalmic Res,2009,41(1):14-20.
[2]Bederman SS,Bhandari M,McKee MD,et al.Do corticosteroids reduce the risk of fat embolism syndrome in patients with long-bone fractures:a meta-analysis[J].Can J Surg,2009,52(5):386-393.
[3]Habashi NM,Andrews PL,Scalea TM.Therapeutic aspects of fat embolism syndrome[J].Injury,2006,37(S4):S68-73.
[4]蔡賢華,陳莊洪,徐永年,等.多發傷并脂肪栓塞綜合征中長骨干骨折的內固定治療[J].中華創傷骨科雜志,2006,8(4):314-316.
[5]蔡賢華,唐運章,陳莊洪,等.低分子右旋糖酐加地塞米松預防脂肪栓塞綜合征的臨床研究[J].華南國防醫學雜志,2004,18(4):12-14.
[6]Akhtar S.Fat embolism[J].Anesthesiol Clin,2009,27(3):533-550.
[7]Woo OH,Yong HS,Oh YW,et al.Experimental pulmonary fat embolism:computed tomography and pathologic findings of the sequential changes[J].J Korean Med Sci,2008,23(4):691-699.
[8]Vadász I,Morty RE,Kohstall MG,et al.Oleic acid inhibits alveolar fluid reabsorption:a role in acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2005,171(5):469-479.
[9]Park WY,Goodman RB,Steinberg KP,et al.Cytokine balance in the lungs of patients with acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2001,164(10):1896-1903.
[10]Ito K,Mizutani A,Kira S,et al.Effect of Ulinastatin,a human urinary trypsin inhibitor,on the oleic acid-induced acute lung injury in rats via the inhibition of activated leukocytes[J].Injury,2005,36(3):387-394.

