病原菌TAL效應子與寄主靶基因相互識別的分子密碼
李巖強,王春連,趙開軍
中國農業科學院作物科學研究所 農業部作物遺傳育種重點實驗室 農作物基因資源與基因改良國家重大科學工程,北京 100081
黃單胞桿菌屬 (Xanthomonas) 的多個致病變種,在多種作物上造成嚴重的病害,包括辣椒和番茄的細菌性斑點病、水稻的白葉枯病和細菌性條斑病[1]。TAL 效應子 (Transcription activator Like effector) 作為黃單胞桿菌的蛋白類效應子之一,能夠通過三型分泌系統 (Type III secretion system,TTSS) 進入植物的細胞核,并與特定基因啟動子DNA結合,類似于真核生物轉錄因子,啟動植物基因的表達,以控制植物的生理生化進程。病原菌通過進化產生一系列的TAL效應子以利于在寄主上的定殖和傳播,而植物亦進化出一系列的抗病策略以抑制該病原菌引起的病害。因此針對不同的寄主植物的基因型,TAL效應子既有可能是毒性因子,也有可能是無毒因子。近年來關于黃單胞桿菌的蛋白類效應子TAL效應子的研究有許多新進展,尤其是TAL效應子與寄主 DNA特異性識別的分子密碼的破解,將在生物工程領域和植物抗病育種應用上產生重要的影響。本文在介紹TAL效應子類蛋白的發現及功能、TAL效應子與寄主靶基因識別的專一性及其分子密碼的基礎上,討論了該分子密碼的應用前景。
1 TAL效應子的發現及研究現狀
1.1 TAL效應子的發現及功能
第一個TAL效應子 (AvrBs3) 于1989年發現于辣椒斑點病細菌 Xanthomonas campestris pv. vesicatoria (xcv) 中,其編碼基因avrBs3的中心區有17.5個幾乎相同的102 bp堿基重復,每個重復編碼34個氨基酸,全基因共編碼一個1 164 aa的蛋白質(122 kDa)[2]。此后發現的TAL效應子類蛋白被稱為AvrBs3家族蛋白。TAL效應子類家族蛋白具有結構的相似性 (圖1A,B):1) N端高度保守,其mRNA水平上存在著TTSS分泌信號 (T3S);2) C端含有亮氨酸拉鏈結構 (Leucine zipper,LZ)、核定位信號(Nuclear localization signals,NLSs) 和酸性轉錄激活域 (Acidic activation domain,AD);3) 中間為多個串聯重復單元組成的串聯重復區,每個重復單元含有34個氨基酸,其中第12和13位氨基酸高度可變,被稱為重復可變區 (Repeat-variable diresidue,RVD)[3]。研究表明NLS具有核定位功能,而保守的LZ和 AD結構都是引起過敏反應 (Hypersensitive reaction,HR) 所必需的。所有的 TAL效應子都具有相同的NLS及AD,只是其重復可變區的重復數目和重復類型不同,并決定TAL效應子與寄主識別的特異性。
TAL效應子對于寄主植物,既是無毒因子,又是毒性因子。從最早克隆的avrBs3基因到最近克隆的avrXa7、avrXa10、AvrXa27,分別能使含相應抗病基因的寄主引起 HR反應,從而引起寄主的抗病反應,表現出無毒效應子功能。而對于不含相應抗病基因的寄主,這些無毒蛋白就表現為毒性因子,能夠引起寄主植物發病。
1.2 已經克隆的TAL效應子編碼基因及其寄主靶基因
TAL效應子類蛋白廣泛存在于黃單胞桿菌屬Xanthomonas和少數的青枯拉爾氏菌屬 Ralstonia solanacearum中[4]。水稻黃單胞桿菌白葉枯病致病變種 (Xanthomonas oryzae pv. oryzae) 引起的水稻白葉枯病 (Bacterial blight,BB) 是一種典型的“基因對基因”病害,植物病原細菌的無毒基因 (Avirulence gene,avr) 和寄主植物抗病基因 (Resistance gene,R) 的顯性互作決定不親和反應[5]。李平等 2004年對黃單胞菌無毒基因的研究進展作了綜述[6]。李玉蓉等于2007年對水稻黃單胞桿菌白葉枯病無毒新基因的克隆以及細菌性條斑病 (Bacterial leaf streak,BLS) 的病原菌 (Xanthomonas oryzae pv. oryzicola)無毒基因的研究進展進行了綜述[7]。但隨著黃單胞桿菌屬許多生理小種的測序[8-12]與進一步研究,該領域的進展日新月異。目前,已有更多的TAL效應子編碼基因及其寄主靶基因被克隆。例如,我們通過構建PXO99的Tn5轉座子插入的突變體庫,篩選使近等基因系 CBB23致病的菌株[13],并克隆了水稻 Xa23基因對應的無毒基因 avrXa23,發現AvrXa23蛋白是一個TAL效應子,它被Xa23基因的啟動子陷阱捕獲而激發水稻產生強烈的抗病反應。White等于2009年將已鑒定的TAL效應子及其寄主靶基因的信息進行了列表綜述[14],由于該領域進展很快,筆者在 White文章基礎上將國內外已克隆鑒定的黃單胞菌TAL效應子及其相關信息的最新進展整理成表1。
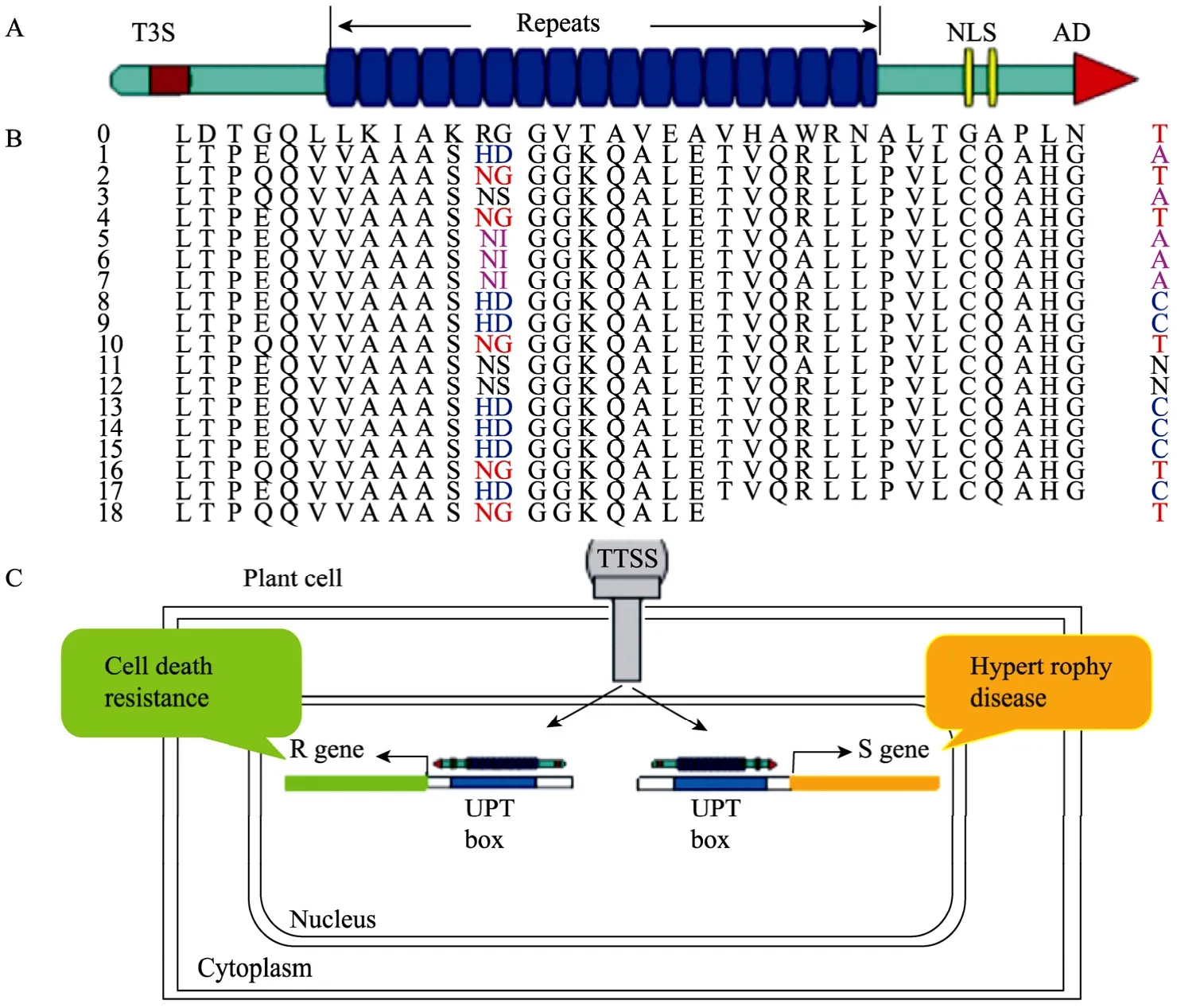
圖1 以AvrBs3為例說明TAL效應子的結構和功能Fig. 1 Structure and function of the TAL effector AvrBs3. (A) The TAL effector AvrBs3 contains central tandem repeats (Repeat domain), the type III signal at N-terminal in mRNA level; the nuclear localization signals (NLSs) and an acidic transcriptional activation domain (AD) at C-terminal. (B) The amino acid sequences of the repeat domain of AvrBs3. The amino acids 12 and 13 are hypervariable, the repeats are numbered in the right and the left is the corresponding nucleotide. Because the all known UPT box has an invariable 5' T, so the 0-position is the nucleotide T. (C) Using the nuclear localization signals, the TAL effectors translocate into the plant cell through type III secretion system, bind the UPT Box of target genes: the R genes or S genes, respectively result in the resistance such as HR response and disease symptom like hypertrophy.
絕大多數的TAL效應子對應的寄主靶基因仍然未知,研究最清楚的avrBs3,其寄主靶基因為Bs3、UPA20等;AvrBs3被注入到植物的細胞核中,其中抗病基因 Bs3啟動子區存在能夠特異性識別該無毒基因的元件,受其誘導表達,產生抗性[15]。感病品種中受AvrBs3誘導的UPA20等是感病相關的基因,UPA20是一個轉錄因子,能夠誘導下游基因 UPA7的表達,進而引起寄主細胞肥大,有利于病原菌的侵染和定殖[16]。AvrBs4的寄主靶基因是Bs4,與其他TAL效應子不同的是,AvrBs4是在植物細胞質而不是細胞核中與Bs4識別并產生抗病的[17]。其他研究比較明確的主要為水稻白葉枯病細菌的 TAL效應子及其對應的寄主靶基因,如 avrXa3/Xa3、avrXa5/Xa5、avrXa7/Xa7和Os11N3、avrXa10/Xa10、
avrXa23/Xa23、avrXa27/Xa27、pthXo1/Os8N3、pthXo3/Os11N3、pthXo6/OsTFX1、Tal9a/OsHEN1等(表1)。抗白葉枯病基因Xa27能夠專一性地受含無毒蛋白 avrXa27菌的誘導,引起植物的抗病,而其等位基因xa27由于啟動子區的缺失和突變,不能受avrXa27的誘導,進而發生感病[18]。PthXo1是一個毒性因子,它能夠誘導水稻中感病基因Os8N3的表達,引起植物感病,對該感病基因進行沉默可以使水稻對含PthXo1的菌株產生抗性,Os8N3是MtN3家族中的一員,對水稻的花粉發育有促進作用,但是Os8N3的生化功能還未知[19]。而隱性抗白葉枯病基因xa13是Os8N3基因啟動子區發生了變化而不能夠受PthXo1的誘導表達[20]。目前鑒定的TAL效應子類蛋白絕大多數為毒性因子,少數的為無毒因子,而目前發現的大部分寄主靶基因為抗病基因,也有少數的為感病基因如:Os11N3、Os8N3、OsTFX1及OsHEN1等。當前研究比較清楚的TAL效應子都與靶基因啟動子識別進而引起抗病或感病反應,而仍然有許多 TAL效應子與靶基因的作用機制仍不明朗,需要進一步的研究證實。
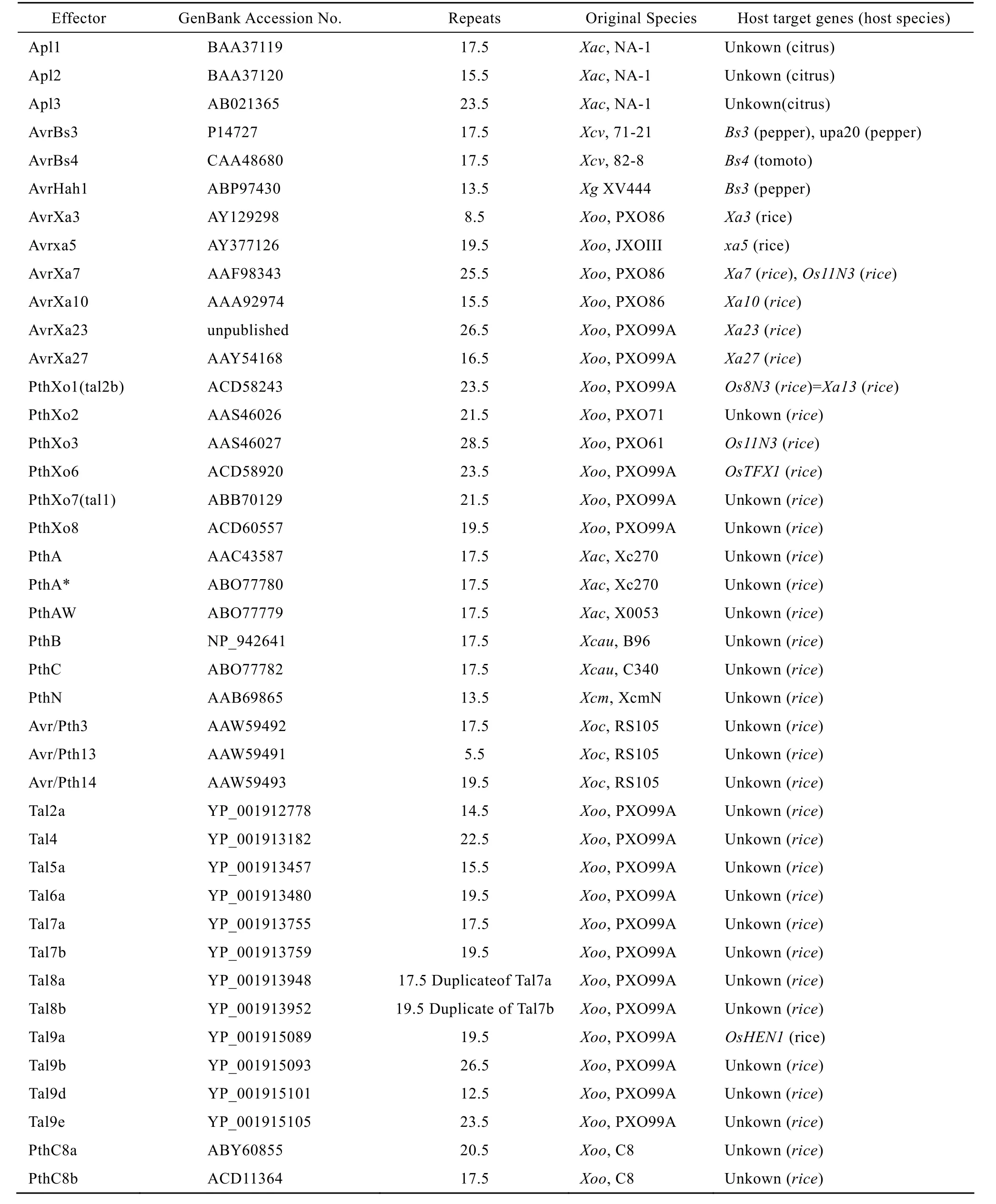
表1 已鑒定的TAL效應子Table 1 List of identified TAL effectors
2 TAL效應子與寄主靶基因識別的專一性
含有AvrBs3蛋白的黃單胞桿菌能夠引起含Bs3基因的辣椒品種ECW-30R的抗病反應,即產生HR (圖1C),對avrBs3的重復區進行缺失突變后,發現缺失突變體avrBs3?rep不能引起ECW-30R產生抗病反應[2]。但其中的一些突變體如avrBs3?rep16 (缺失 11~14之間的重復) 能夠引起另一個辣椒品種ECW產生HR反應。后來的研究發現AvrBs3?rep16能夠特異性識別Bs3等位基因Bs3-E的啟動子[15]。AvrXa7和AvrXa10分別含有25.5和15.5個重復單元,若它們的重復區互置,所識別的抗病基因 Xa7和 Xa10也發生相應的變化,即含有 AvrXa10重復區的AvrXa7可以識別Xa10,含有AvrXa7重復區的AvrXa10可以識別 Xa7[21]。水稻抗白葉枯病基因Xa27專一性地受白葉枯病原菌中無毒蛋白AvrXa27的誘導表達[18],感病基因Os8N3 (Xa13) 受TAL效應子PthXo1的誘導[19],而當Os8N3啟動子區發生突變,可以逃避 PthXo1的識別,xa13抗病基因便因此獲得對白葉枯病的抗性[20]。
深入的研究發現,TAL效應子與寄主靶基因的特異性識別發生在啟動子區域。AvrBs3和AvrBs3?rep16分別特異地與Bs3及Bs3-E的啟動子區的特定序列互作[22-23],R?mer等將這些識別序列稱為UPT((UP regulated by TAL effectors)Box。缺失突變分析和體外的 EMSA實驗表明:AvrBs3和AvrBs3?rep16分別與UPTAvrBs3box和UPTAvrBs3?rep16box專一性識別[22]。水稻抗白葉枯病基因Xa27受無毒蛋白AvrXa27的誘導表達,序列分析發現,Xa27與其等位基因xa27的編碼區沒有明顯的差異,只是在啟動子區存在堿基的缺失和變異[18]。對Xa27的啟動子進行分析,并將靠近TATA box區的突變位點的相關片段導入到 xa27的啟動子中,發現融合后的xa27啟動子能夠受 AvrXa27的誘導,利用缺失突變及 EMSA實驗最終確定了最短的 UPTavrXa27box序列[23]。TAL效應子不僅能夠識別抗病基因的啟動子,它們的靶基因還可能是感病相關的基因。受AvrBs3誘導的Upa20基因能夠引起植物生理狀態上的變化,例如細胞分裂以及細胞增大,以利于病原菌在寄主中的定殖和生長 (圖2C)[16]。受無毒因子誘導的另外一些典型的感病基因如 Os8N3 (Xa13)、OsTFX1以及Os11N3等分別受PthXo1、PthXo6及AvrXa7的特異性誘導[19,24-26]。同樣地,利用缺失突變及 EMSA實驗分析的方法,相應的 UPT Box:UPTPthXo1Box、UPTPthXo6Box以及UPTAvrXa7Box得到確認,根據UPT box單個堿基的突變分析表明,特定的TAL效應子,專一性誘導特定的UPT Box[27]。上述實驗表明,特定的TAL效應子識別相應的UPT box,這也是為什么許多R基因 (Bs3、Xa27、Xa7、Xa10) 僅受特定的AvrBs3類無毒蛋白誘導的原因,這從分子水平上驗證了“基因對基因”學說。
3 TAL效應子與寄主靶基因識別的分子密碼
AvrBs3直接識別被其誘導的靶基因啟動子區的UPT Box[22,28],引起受AvrBs3誘導的許多基因如UPA1-11[29]、UPA14-25[30]的表達,導致感病植株的葉肉細胞肥大 (圖 1C)。Kay等分析受 AvrBs3誘導的基因Bs3、UPA10、UPA12、UPA14、UPA19、UPA20、UPA21、UPA23及UPA25啟動子轉錄起始點上游100 bp序列,發現這些受AvrBs3誘導的基因含有相同的UPA motif基序,有19個核苷酸組成的box具有極強的保守性,與以前鑒定的AvrBs3的UPT Box一致[30]。由于UPT Box[18 bp[29]和19 bp[30]]的堿基數與 AvrBs3的重復數 (17.5) 基本一致,Boch等推測 AvrBs3的每一個重復單元識別一個特異的DNA堿基對[31]。當每一個AvrBs3的重復類型(每個重復區的第 12和第 13氨基酸) 對應到 UPT Box中去時,發現特定的重復類型與目標DNA上的特異堿基相關聯 (圖1B)。例如HD和NI分別對C和A有很強的偏愛,而AvrBs3?rep16 (缺失11~14之間的重復),能夠識別更短的或者 (DNA Box的3′端)不同的目標DNA序列[31]。另外,在UPT Box的5′末端,對應于第一個預測的重復堿基的前一個位點上含有一個保守的 T[31]。后來的研究發現保守的 T堿基對于誘導活性至關重要[27]。Boch等通過分析多個無毒蛋白重復類型以及受其誘導的基因啟動子區的UPT Box的對應關系,構建了不同重復類型特異性識別目標DNA堿基的分子密碼模型[31]。與此同時,Moscou和 Bogdanove利用計算機掃描比對TAL效應子中可變重復類型與目標啟動子中的DNA序列,統計分析得到了類似的分子密碼模型(圖1B)[32]。
為了驗證病原菌無毒蛋白與靶基因 DNA特異性識別的分子密碼模型,Boch等分析受AvrXa27、PthXo1、PthXo6及 PthXo7誘導的基因及其等位基因的啟動子區,發現受誘導的基因中均含有相匹配的UPT Box,而不受誘導的等位基因找不到相應的UPT Box[31]。他們將預測的 UPT Box構建到最小Bs4(–55~+25) 啟動子的上游,驅動 GUS基因,與含有相對應35S啟動子驅動的TAL效應子載體的農桿菌共注射本茗煙,證明預測的UPT Box受相應的TAL效應子誘導。他們還根據已知的密碼模型,成功預測了Hax2的靶基因PAP1(At1G56650)。此外,Boch等構建了7個人造的TAL效應子 (ArtX),將它們構建成N端融合了GFP報告基因的人造效應子,并檢驗其誘導含有預測的UPT box的Bs4啟動子驅動報告基因表達的能力。這 7個人造效應子都只激發含相應的UPT Box的啟動子引起GUS表達活性,且人造的ArtX和GFP融合蛋白能夠在植物細胞中表達[31]。
4 TAL效應子與寄主靶基因識別密碼的應用前景
4.1 TALN的產生及應用前景
TAL效應子與寄主靶基因的互作是一種新型的蛋白-DNA結合方式,即2個特異的氨基酸組合對應1個特異的堿基。根據TAL效應子與寄主靶基因相互識別的分子密碼,科學家已將TAL效應子與核酸內切酶 FokⅠ融合構建了新型的位點特異性識別的工具酶TALNs (TAL effector nucleases),并通過體外實驗,對識別的特異性進行了驗證[33-34]。Li等構建了AvrXa7和PthXo1與核酸內切酶FokⅠ融合的酶,通過體外的 DNA酶切實驗以及酵母內的重組實驗均證明,TALN能夠特異性地識別其目標DNA序列,并使 FokⅠ在特定的位點進行酶切[33]。Christian等先是利用AvrBs3及PthXo1和核酸內切酶FokⅠ融合的酶,發現了不同的融合酶對于酶切位點的活性受識別位點的距離的影響,他們還證明使用 2個不同的融合酶能夠分別識別特異的位點并共同完成酶切。同時,為了驗證該分子密碼,他們找到了基因組上的序列,并按照頻率最大的密碼 (NI對應A, HD對應C,NN對應G以及NG對應T) 人工設計了相對應的TAL效應子,通過酵母內的實驗發現許多人工設計的融合酶具有很強的活性 (圖2A)[34]。
這些實驗證明了利用分子密碼設計相應的TALN完成真核生物基因組的重組和突變成為可能。例如可以設計能與特定 DNA序列結合的人造效應子,以完成靶基因的定點突變和重組。另外,這種轉錄因子模式可以控制目的基因轉錄水平上的表達,如利用特異識別啟動子的人造TAL效應子作為基因表達的分子開關,在轉錄水平上進行基因的表達調控。當然,這種機制不僅僅用于植物,也可能應用于人類重要疾病比如癌癥等的基因治療。我們預計,TALN將在未來的基因治療中受到重視并發揮重要作用。
4.2 利用分子密碼發掘更多的抗病基因和感病基因
根據分子識別密碼,可以利用TAL效應子的可變區序列預測并尋找抗病基因或感病基因 (圖2B)。比如水稻基因組序列已經完成,可以利用TAL效應子可變區序列,掃描基因組序列,找到受其誘導的啟動子,進而研究相應基因的功能。這可能為尋找抗病基因開辟一條新的途徑。如 Boch等根據 TAL效應子HAX2的序列,推測出其對應啟動子的序列,并在擬南芥基因組中找到了靶基因 MYB轉錄因子類的PAP1 (At1G56650)[31]。現在已發現多個毒性因子TAL效應子,這樣可以根據其可變區 (RVD) 的變化,推測出與感病相關的基因,研究植物感病的分子機制,并利用 RNAi的辦法抑制感病基因從而達到提高抗病性的目的。
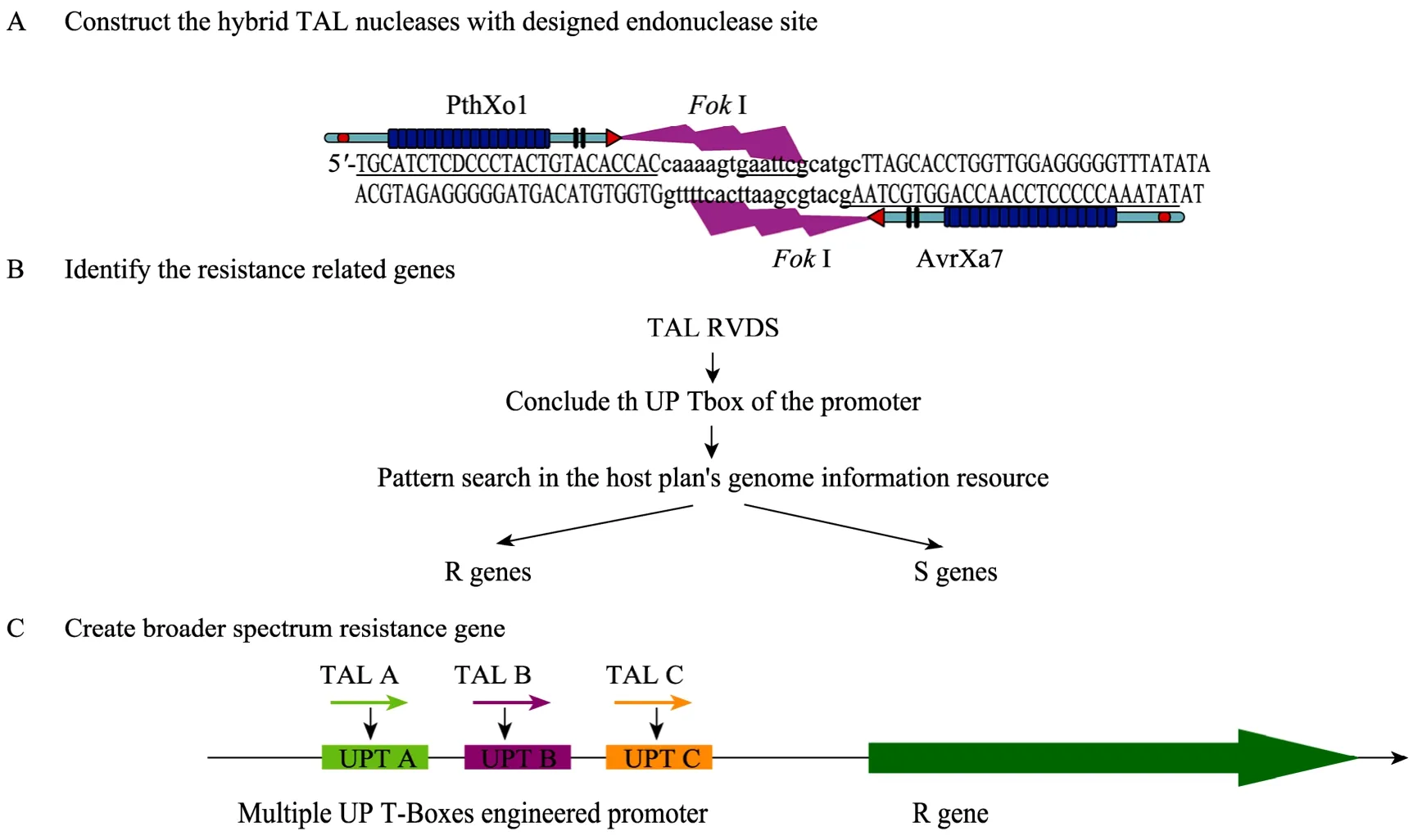
圖2 TAL effector與靶基因識別的分子密碼的應用前景Fig. 2 Applications and future prospects of molecular recognition code between TAL effectors and host genes. (A) Construction of hybrid TAL nucleases (TALN). This chimeric protein can bind the target nucleotides and cut at the relative position using the Fok I digestion function. This diagram takes the AvrXa7 and PthXo1 used in Li's paper[33] as an example. (B) Identify the resistance related genes. The known effectors can be used to identify their target genes through pattern search in the host plant's information resource. In this way, more and more resistance or susceptible genes can be identified in the future. (C) Create broader spectrum resistance gene. Multiple UPT-Boxes can be combined in one promoter to drive a R gene like Rxo1 or Xa27. This new engineered R gene complex can be recognized and induced by different TAL effectors, resulted in resistance to more pathogenic bacteriums.
4.3 利用分子密碼開發廣譜抗病基因啟動子
R?mer等利用基因工程的方法將不同的 UPT Box聚合到一個啟動子上,獲得受多個TAL效應子誘導的新啟動子[27]。這種新型的啟動子使利用基因工程擴展抗病基因的抗譜成為可能。例如,在水稻白葉枯病抗病育種中,選育和種植抗病品種是防治該病的最經濟、有效和環保的途徑。目前國內外報道的白葉枯病抗病基因已經有 36個之多[35],但是由于水稻白葉枯病原菌致病性的變異和新毒性菌群的不斷出現,一些抗病品種的抗性逐漸喪失[36]。根據“基因對基因”理論,抗病基因是和相應的無毒基因互作后起作用的,介導的抗性是小種特異性的,向植物中導人某一抗病基因后,它可以對攜帶特定無毒基因的病原菌產生抗性。目前克隆得到的抗白葉枯病基因的無毒基因很多,可以根據分子密碼設計受多種無毒基因誘導的UPT Box[27]。將新設計的含多個UPT Box的啟動子驅動一個抗病基因,使該抗病基因受多個無毒基因產物的誘導,進而擴大抗病基因的抗譜 (圖2C)。另外,目前在細菌性條斑病細菌 (Xooc) 中也克隆到一些TAL效應子類基因[37]。但是抗細菌性條斑病的主效基因報道仍然很少[38],目前比較有效的為非寄主抗性基因Rxo1[39],而組成型表達的抗白葉枯病基因 Xa27也可以抗一些細菌性條斑病小種[40]。可以利用TAL效應子與寄主靶基因 DNA識別的分子密碼設計受多個細菌性條斑病細菌TAL效應子誘導的啟動子,驅動抗病基因如Rxo1或Xa27,進而得到抗細菌性條斑病的抗病基因。目前我們擬利用已經克隆得到的 avrXa23以及已經發表的無毒基因,根據分子密碼推測的UPT Box組合成一個受多個TAL效應子誘導的抗病基因啟動子,用于驅動抗病基因,期望能夠獲得更大的抗譜。
4.4 問題及展望
TAL效應子與其靶基因互作的研究取得了很大進展,但是仍然有許多問題需要進一步揭示。例如TAL效應子到底如何與 DNA堿基相結合,包括結合的方式及分子機制,以及為什么發生特異性的結合,這些都需要完成TAL效應子及TAL-DNA復合物的晶體結構解析才能準確地回答。TAL效應子與寄主靶基因相互識別密碼的廣泛性還需要新的實驗證明。對于分子密碼的應用研究也只是剛剛開始,TALN在基因組靶向修飾中的使用條件以及在各個物種中的通用性仍然需要進一步研究。受多種 TAL效應子誘導的啟動子已經構建成功,但是構建的新型啟動子能否獲得更大的抗譜仍然需要實踐證明。盡管如此,TAL效應子與寄主靶基因識別的分子密碼作為一種新型的識別機制,具有很強的專一性,利用該分子密碼設計新的基因工程酶,尋找更多的抗病基因,構建更多抗譜的抗病基因將會有巨大的應用前景。繼續研究黃單胞桿菌TAL效應子與其對應的寄主靶基因相互識別的分子機制,并將其相互識別的分子密碼應用于生物醫學工程及農業抗病育種技術中去,將為人類戰勝疾病及獲得更多的糧食提供更大的支持。
REFERENCES
[1] Boch J, Bonas U. Xanthomonas AvrBs3 family-type III effectors: discovery and function. Annu Reveal Phytopathol, 2010, 48: 419?436.
[2] Bonas U, Stall RE, Stskawicz BJ. Genetic and structural characterization of the avirulence gene avrBs3 from Xanthomonas campestris pv. campestris. Mol Gen Genet, 1989, 218(1): 127?136.
[3] Herbers K, Conrads-Strauch J, Bonas U. Race-specifcity of plant resistance to bacterial spot disease determined by repetitive motifs in a bacterial avirulence protein. Nature, 1992, 356(6365): 172?174.
[4] Salanoubat M, Genin S, Artiguenave F, et al. Genome sequence of the plant pathogen Ralstonia solanacearum. Nature, 2002, 415(6871): 497?502.
[5] Flor H H. Host parasite interactions in fax rust—its genetics and other implications. Phytopathology, 1955, 45: 680?685.
[6] Li P, Long JY, Zhang Y, et al. Avirulence genes from Xanthomonas oryzae pv. oryzae. J Nangjing Agric Univ, 2004, 27(3): 119?124.李平, 龍菊英, 張燕, 等. 水稻黃單胞細菌的無毒基因.南京農業大學學報, 2004, 27(3): 119?124.
[7] Li YR, Zou LF, Wu XM, et al. Current Progress in the Research On avrBs3/PthA Family Genes of Xanthomonas oryzae. Sci Agric Sin, 2007, 40(10): 2193?2199.李玉蓉, 鄒麗芳, 武曉敏, 等. 水稻黃單胞菌avrBs3/PthA家族基因研究進展. 中國農業科學, 2007, 40(10): 2193?2199.
[8] da Silva ACR, Ferro JA, Reinach FC, et al. Comparison of the genomes of two Xanthomonas pathogens with differing host specificities. Nature, 2002, 417(6887): 459?463.
[9] Lee BM, Park YJ, Park DS, et al. The genome sequence of Xanthomonas oryzae pathovar oryzae KACC10331, the bacterial blight pathogen of rice. Nucleic Acids Res, 2005, 33(2): 577?586.
[10] Qian W, Jia Y, Ren SX, et al. Comparative and functional genomic analyses of the pathogenicity of phytopathogen Xanthomonas campestris pv. campestris. Genome Res, 2005, 15(6): 757?767.
[11] Salzberg SL, Sommer DD, Schatz MC, et al. Genome sequence and rapid evolution of the rice pathogen Xanthomonas oryzae pv. oryzae PXO99A. BMC Genomics, 2008, 9(1): 204?219.
[12] Thieme F, Koebnik R., Bekel T, et al. Insights into genome plasticity and pathogenicity of the plant pathogenic bacterium Xanthomonas campestris pv. vesicatoria revealed by the complete genome sequence. J Bacteriol, 2005, 187(21): 7254?7266.
[13] Wang CL, Xu AB, Gao Y, et al. Generation and characterization of Tn5-tagged Xanthomonas oryzae pv. oryzae mutants that overcome Xa23-mediated resistance to bacterial blight of rice. Eur J Plant Pathol, 2009, 123(3): 343?351.
[14] White FF, Potnis N, Jones JB, et al. The type III effectors of Xanthomonas. Mol Plant Pathol, 2009, 10(6): 749?766.
[15] Schornack S, Meyer A, R?mer P, et al. Gene -for -gene-mediated recognition of nuclear-targeted AvrBs3 -like bacterial effector proteins. J Plant Physiol, 2006, 163: 256?272.
[16] Kay S, Hahn S, Marois E, et al. A bacterial effector acts as a plant transcription factor and induces a cell size regulator. Science, 2007, 318(5850): 648?651.
[17] Schornack S, Peter K, Bonas U, et al. Expression levels of avrBs3-like genes affect recognition specifcity in tomato Bs4 but not in pepper Bs3 mediated perception. Mol Plant Microbe Interact, 2005, 18(11): 1215?1225.
[18] Gu KY, Yang B, Tian DS, et al. R gene expression induced by a type-III effector triggers disease resistance in rice. Nature, 2005, 435(7045): 1122?1125.
[19] Yang B, Sugio A, White FF. Os8N3 is a host disease-susceptibility gene for bacterial blight of rice. Proc Natl Acad Sci USA, 2006, 103(27): 10503?10508.
[20] Chu ZH, Yuan M, Yao JL, et al. Promoter mutations of an essential gene for pollen development result in disease resistance in rice. Gene Dev, 2006, 20(10): 1250?1255.
[21] Hopkins CM, White FF, Choi SH, et al. Identification of a family of avirulence genes from Xanthomonas oryzae pv. oryzae. Mol Plant Microbe Interac, 1992, 5: 451?459.
[22] R?mer P, Strauss T, Hahn S, et al. Recognition of AvrBs3-like proteins is mediated by specifc binding to promoters of matching pepper Bs3 alleles. Plant Physiol, 2009, 150(4): 1697?1712.
[23] R?mer P, Recht S, Lahaye T. A single plant resistance gene promoter engineered to recognize multiple TAL effectors from disparate pathogens. Proc Natl Acad Sci USA, 2009, 106(48): 20526?20531.
[24] Yuan M, Chu ZH, Li XH, et al. Pathogen-induced expressional loss of function is the key factor in race-specifc bacterial resistance conferred by a recessive R gene xa13 in rice. Plant Cell Physiol, 2009, 50(5): 947?955.
[25] Sugio A, Yang B, Zhu T, et al. Two type III effector genes of Xanthomonas oryzae pv. oryzae control the induction of the host genes OsTFIIAγ1 and OsTFX1 during bacterial blight of rice. Proc Natl Acad Sci USA, 2007, 104(25): 10720?10725.
[26] Antony G, Zhou JH, Huang S, et al. Rice xa13 recessive resistance to bacterial blight is defeated by induction of the disease susceptibility gene Os11N3. Plant Cell, 2010, 22(11): 3864?3876.
[27] R?mer P, Recht S, Strau? T, et al. Promoter elements of rice susceptibility genes are bound and activated by specifc TAL effectors from the bacterial blight pathogen, Xanthomonas oryzae pv. oryzae. New Phytol, 2010, 187(4): 1048?1057.
[28] R?mer P, Hahn S, Jordan T, et al. Plant pathogen recognition mediated by promoter activation of the pepper Bs3 resistance gene. Science, 2007, 318(5850): 645?648.
[29] Marois E, Van den Ackerveken G, Bonas U. The Xanthomonas type III effector protein AvrBs3 modulates plant gene expression and induces cell hypertrophy in the susceptible host. Mol Plant Microbe Interact, 2002, 15(7): 637?646.
[30] Kay S, Hahn S, Marois E, et al. Detailed analysis of the DNA recognition motifs of the Xanthomonas type III effectors AvrBs3 and AvrBs3Drep16. Plant J, 2009, 59(6): 859?871.
[31] Boch J, Scholze H, Schornack S, et al. Breaking the code of DNA binding specificity of TAL-type III effectors. Science, 2009, 326(5959): 1509?1512.
[32] Moscou MJ, Bogdanove AJ. A simple cipher governs DNA recognition by TAL effectors. Science, 2009, 326(5959): 1501.
[33] Li T, Huang S, Jiang ZW, et al. TAL nucleases (TALNs): hybrid proteins composed of TAL effectors and Fok I DNA-cleavage domain. Nucleic Acids Res, 2010, 39(1): 359?372.
[34] Christian M, Cermak T, Doyle EL, et al. TAL effector nucleases create targeted DNA double-strand breaks. Genetics, 2010, 110: 120717.
[35] Miao LL, Wang CL, Zheng CK, et al. Molecular mapping of a new gene for resistance to rice bacterial blight. Sci Agric Sin, 2010, 43(15): 3051?3058.苗麗麗, 王春連, 鄭崇珂, 等. 水稻抗白葉枯病新基因的初步定位. 中國農業科學, 2010, 43(5): 3051?3058.
[36] Zeng LX, Zhu XY, Yang JY, et al. A new pathotype of Xanthomonas oryzae pv. oryzae was found and tested for pathogenicity in Guangdong. Guangdong Agric Sci, 2005, 2: 58?59.曾列先, 朱小源, 楊建源, 等. 廣東水稻白葉枯病菌新致病型的發現及致病性測定. 廣東農業科學, 2005, 2: 58?59.
[37] Zou LF, Chen GY, Wu XM, et al. Cloning and analysis of diverse members of avrBs3/PthA Family of Xanthomonas oryzae pv. oryzicola. Sci Agric Sin, 2005, 38(5): 929?935.鄒麗芳, 陳功友, 武曉敏, 等. 中國水稻條斑病細菌avrBs3/PthA家族基因的克隆和序列分析. 中國農業科學, 2005, 38(5): 929?935.
[38] Zeng JM, Lin WX. Research progress on rice bacterial leaf streak and its resistance. Mol Plant Breed, 2003, 1(2): 257?263.曾建敏, 林文雄. 水稻細菌性條斑病及其抗性研究進展. 分子植物育種, 2003, 1(2): 257?263.
[39] Zhao BY, Lin XH, Poland J, et al. A maize resistance gene functions against bacterial streak disease in rice. Proc Natl Acad Sci USA, 2005, 102(43): 15383?15388.
[40] Tian DS, Yin ZC. Constitutive heterologous expression of avrXa27 in rice containing the R gene Xa27 confers enhanced resistance to compatible Xanthomonas oryzae strains. Mol Plant Pathol, 2009, 10(1): 29?39.

