轉基因雞生物反應器載體的構建及其表達特性分析
楊鵬翔,王曦晨,王宇祥,王啟貴,李輝
東北農業大學動物科學技術學院,哈爾濱 150030
隨著人們對營養類蛋白、醫用類蛋白需求量的日益增長,轉基因動物的研究越來越多地集中在建立更為經濟高效的生產技術平臺上[1]。最初,哺乳動物的乳腺被認為是一個很有希望的生物反應器,應用羊乳汁生產的治療人類血凝疾病的轉基因藥物于2006年成功上市,為轉基因動物在生物制藥領域的應用開辟了道路[2]。但家畜因世隔長、擴群慢、飼料成本高,從乳中純化外源蛋白工藝復雜等劣勢,使其成為一種低效過程。相比之下,禽類具有個體小、產蛋多、蛋白提取技術成熟,且所產生的蛋白具有與人類近似的糖基化結構等特點,使得轉基因雞輸卵管生物反應器的研究成為最具有競爭力的前沿產業之一[3]。
目前,構建用于攜帶外源基因的高效表達載體和良好的導入方法是禽類轉基因研究的兩大關鍵技術[4]。因此,篩選出高效的外源基因表達載體是禽類轉基因能否獲得成功的首要條件。雞輸卵管的管狀腺細胞具有表達和分泌卵白蛋白的強大功能和高度特異性,其中,卵清蛋白 (Ovalbumin,OV) 占白蛋白的 55%~60%,表明該基因啟動調控區的高度有效性,許多研究者因此選擇該基因 5'調控序列作為制備雞輸卵管生物反應器的首選調控元件[5]。宇麗等的研究中,采用OV基因5′端1.2 kb調控序列,實現了組織特異性表達[6]。然而,Zhu等分別用OV基因5′側翼7.5 kb和15 kb片段構建的表達載體卻未能成功實現組織特異性表達[7]。最近,逆轉錄病毒其中一族的慢病毒載體因具有能夠感染分裂期和靜止細胞、主動整合到基因組、導入的外源基因不易沉默、能夠穩定地進行種系間傳遞等優點被廣泛用來制備轉基因雞[8]。McGrew等認為利用慢病毒載體制備轉基因雞,在表達效率上比目前所報道的任何其他載體高出百倍[9],因此被認為是最有希望的禽類轉基因工具。
本研究克隆了雞卵清蛋白基因5′端1.25 kb調控序列,通過構建雞卵清蛋白啟動子表達載體、巨細胞病毒 (Cytomegalovirus,CMV) 啟動子的對照質粒載體和慢病毒載體,采用綠色熒光蛋白 (Green fluorescent protein,GFP) 和熒光素酶 (Luciferase,Luc) 兩種標記基因,在雞原代輸卵管上皮細胞、雞胚成纖維細胞、鼠3T3-L1前脂肪細胞和牛乳腺上皮細胞中進行表達,利用熒光顯微鏡觀察和酶活性統計分析載體的表達活性和細胞特異性,篩選出實現高效表達的載體,期望為轉基因雞生物反應器的制備奠定基礎。
1 材料與方法
1.1 材料
真核表達載體pcDNA3.1(+)、pEGFP-C1為本實驗室保存;克隆載體 pMD18-T購自大連寶生物公司;熒光素酶報告基因載體 pGL3-Basic、pRL-TK購自Promega公司;慢病毒顆粒購自上海英為信公司。大腸桿菌JM109、DH5α感受態菌種均為本實驗室保存;BamHⅠ、XhoⅠ等各種限制性內切酶、Taq酶、T4 DNA聚合酶、T4 DNA連接酶、DNA marker均購自寶生物工程 (大連) 有限公司。凝膠回收 (小量) 試劑盒、質粒 (小量) 抽提試劑盒購自AXYGEN生物技術有限公司;雙熒光素酶報告基因檢測試劑盒購自Promega公司。D-MEM/F-12培養基、D-MEM高糖培養基、Ⅰ型膠原酶、胰蛋白酶購自Invitrogen公司;明膠、青霉素、鏈霉素、Triton X-100等購自 Sigma公司;優級胎牛血清購自天津灝洋生物制品有限公司;廣譜角蛋白抗體購自北京博奧森生物技術有限公司;FuGENE?HD轉染試劑購自Roche公司。56周齡產蛋母雞來自于本校畜牧園區雞飼養場;雞胚成纖維細胞系DF-1由哈爾濱獸醫研究所 志高研究員饋贈;鼠3T3-L1前脂肪細胞系購自中國科學院細胞庫;牛乳腺上皮細胞系由東北農業大學生命中心李慶章教授饋贈。
1.2 方法
1.2.1 引物設計
根據 OV基因序列 (GenBank Accession No. J00895) 設計引物OVNF、OVNR,用于擴增OV調控區。上下游引物分別引入NruⅠ和HindⅢ酶切位點。片段長度為1 238 bp;根據克隆載體pEGFP-C1基因序列 (GenBank Accession No. CVU55763) 設計引物GFPF、GFPR,用于擴增綠色熒光蛋白基因。上下游引物分別引入 BamHⅠ和 XhoⅠ酶切位點。片段長度為725 bp;根據克隆載體pGL3-Basic基因序列 (GenBank Accession No. U47295) 設計引物LucF、LucR,用于擴增螢火蟲熒光素酶基因。上下游引物分別引入BamHⅠ和XhoⅠ酶切位點。片段長度為1 677 bp。
1.2.2 pcDNA3.1(+) 載體的改造
根據載體圖譜分析,用限制性酶 PvuⅡ酶切pcDNA3.1(+) 載體,切除其中的neo基因,酶切產物經瓊脂糖凝膠電泳分離,用DNA回收試劑盒回收3.2 kb片段,自體連接后轉化大腸桿菌DH5α感受態細胞,從陽性的重組子中獲得不含 neo基因的改造載體pc[10]。用限制性酶NruⅠ和HindⅢ雙酶切載體pc,切除其中的CMV啟動子,電泳回收,獲得大小為2.5 kb的載體框p。
表1 本實驗所用引物序列Table 1 Primers used in this study
1.2.3 卵清蛋白啟動子表達載體的構建
采用設計的引物OVNF和OVNR,以雞的基因組DNA為模板,采用高保真Taq DNA聚合酶擴增目的基因,擴增產物經NruⅠ和HindⅢ雙酶切回收后,連接到改造的表達載體 p中。轉化大腸桿菌DH5α感受態細胞,涂板培養后,挑取光滑單菌落接種至含氨芐青霉素的液體培養基中,振蕩培養后提取重組質粒 DNA,然后經PCR擴增及酶切鑒定篩選轉化子,將初步判定陽性的重組子菌種送至上海英駿生物技術有限公司測序,將測序正確的陽性克隆命名為pOV。
1.2.4 包含報告基因表達載體的構建
采用設計的引物 GFPF和 GFPR、LucF和LucR,分別從 PEGFP-C1、PGL3-Basic中擴增出EGFP、Luc基因序列,擴增產物經 BamHⅠ和XhoⅠ雙酶切回收后分別連接到卵清蛋白啟動子表達載體 pOV和真核表達載體 pcDNA3.1(+) 中,以和1.2.3中相同的方法,將測序正確的陽性克隆分別命名為pOV-EGFP、pOV-Luc、pcDNA3.1(+)-EGFP、pcDNA3.1(+)-Luc。
1.2.5 雞原代輸卵管上皮細胞的分離和培養
將56周齡的產蛋母雞斷頸放血,腹部消毒,無菌取出輸卵管膨大部分。在膨大部切取3~5 cm的組織,放入裝有磷酸緩沖液 (Phosphate belance solution,PBS) 的平皿中,反復沖洗,盡量除去雞輸卵管上皮細胞分泌的卵清蛋白和其他粘液。用小鑷子小心摘取輸卵管內壁的褶皺組織上皮,用眼科剪剪碎組織,隨即轉入含有Ⅰ型膠原酶消化液的試管中進行初步消化,于37 ℃消化 60 min (每5 min振蕩1次)。消化完畢,將消化產物分裝入離心管,1 000 r/min離心10 min,除去培養液。轉入含有胰酶消化液的試管中繼續消化,于37 ℃消化10 min (每2 min振蕩1次)。加入培養液終止消化,吸管吹打,經3層無菌紗布過濾。濾液以1 000 r/min離心10 min,除去培養液,用含 10%胎牛血清 (Fetal bovine serum,FBS) 的D-MEM-F12培養液重懸細胞,制成細胞懸液,即為純化前的雞輸卵管上皮細胞。將此細胞懸液鋪瓶后每5 h進行1次差速貼壁,過程為將懸液吸出,1 000 r/min離心5 min,棄上清,沉淀用含10% FBS的D-MEM-F12培養液重懸,重新鋪到新瓶中。差速貼壁3次以后,即為純化的雞輸卵管上皮細胞[11]。將細胞記數后,按 5×105/孔(6孔板) 左右的密度接種,置于37 ℃、5% CO2培養箱中培養,每2天換液1次[12]。
1.2.6 雞原代輸卵管上皮細胞的鑒定
每日對細胞進行形態學觀察,掌握輸卵管上皮細胞的生長特性和細胞形態的差異,待細胞貼壁且呈現出上皮細胞形態特征時,對輸卵管上皮細胞進行生物學鑒定。取普通潔凈的蓋玻片,接種細胞,制作輸卵管上皮細胞爬片。待細胞長成80%匯合單層時,倒掉培養液,用預冷的PBS沖洗細胞2次。用冰浴的甲醇于 4 ℃固定 10 min。用含 0.1%的Triton X-100的PBS溶液 (PBSTx) 沖洗細胞3次,每次5 min,然后用干凈濾紙擦掉邊緣水分。用含5%牛血清白蛋白的PBSTx封閉60 min,用搖床輕輕搖動。去封閉液,用 PBSTx稀釋的異硫氰酸熒光素 (Fluorescein isothiocyanate,FITC) 標記角蛋白抗體作用60 min。去除抗體,用PBSTx沖洗細胞3次,每次5 min,然后用干凈濾紙擦掉邊緣水分,用抗熒光淬滅劑封片,于熒光顯微鏡下觀察角蛋白的表達[13-14]。
1.2.7 雞胚成纖維細胞系、鼠3T3-L1前脂肪細胞系、牛乳腺上皮細胞系的復蘇和培養
將液氮保存的細胞放入37 ℃的水中,搖動凍存管,直至融化。用70%酒精清潔凍存管外壁,加入到裝有37 ℃預溫的完全培養液的離心管中,針對各類型細胞,在離心管中加入不同濃度FBS的完全培養液進行培養:雞胚成纖維細胞采用含5% FBS的D-MEM-F12培養液;鼠3T3-L1前脂肪細胞采用含10% FBS的D-MEM高糖培養液;牛乳腺上皮細胞采用含20% FBS的D-MEM-F12培養液。溫和混勻,反復數次,1 000 r/min離心5 min后,棄去上清。收集細胞后,用各細胞的完全培養液重懸,進行細胞記數,按5×105/孔 (6孔板) 左右的密度接種,置于37 ℃、5% CO2培養箱中培養,每2天換液1次。待細胞鋪滿時,即可傳代。
1.2.8 質粒載體的細胞轉染
將待轉染的細胞接種至6孔板中,于37 ℃、5% CO2培養箱中培養 70%~80%匯合時,按FuGENE?HD Transfection Reagent (羅氏) 說明書操作。將FuGENE?HD Transfction Reagent、DNA和培養液調整到 15 ℃~25 ℃,振蕩混勻。將含有 GFP報告基因的重組質粒用無血清無雙抗的 DMEM稀釋質粒至0.02 g/L;將含有Luc報告基因的重組質粒分別與phRL-TK質粒按質量比1∶20進行混合后,用無血清無雙抗的DMEM稀釋質粒至0.02 g/L。吸取5 μL的HD加入到100 μL含質粒的培養液中,將混合物用槍吹打15次,室溫孵育15 min。從培養箱中取出細胞,將轉染混合物加到液面以下,搖晃培養板混勻,48 h后觀察結果。
1.2.9 病毒顆粒的細胞轉染
將待轉染的細胞接種至6孔板中,于37 ℃、5% CO2培養箱中培養50%~70%匯合時,按照上海英為信公司慢病毒使用說明書操作。根據MOI值將計算好的慢病毒稀釋到培養液中,與體積比 1∶20的phRL-TK質粒進行混合,加入聚凝胺至終濃度為6~8 mg/L,將混合物用槍吹打15次。棄掉細胞原培養液,將含有慢病毒的混合物加到培養板中,搖晃混勻,轉染后12 h更換成正常培養液培養細胞,96 h后觀察結果。
1.2.10 報告基因的檢測
轉染48或96 h后,將轉染EGFP報告基因的細胞于熒光顯微鏡下觀察結果;將轉染 Luc報告基因的細胞按照Promega公司的雙熒光素酶報告基因檢測試劑盒說明書進行。用細胞裂解液充分裂解細胞。每個樣品測定時,取樣品20 μL,加入100 μL Luciferase檢測試劑,用移液器吹打 15次后測定Luciferase值。完成后,加入100 μL Renilla檢測試劑,用移液器吹打15次后測定Renilla值。
2 結果
2.1 載體構建
經PCR擴增后,產物經瓊脂糖凝膠電泳檢測可見一條約 1.25 kb大小的單一條帶,與預計擴增的OV調控區大小相符 (圖1)。將該產物回收后連接入pMD18-T Simple中進行測序,測序結果表明,克隆的片段與 NCBI報道的相比只有兩個堿基的差別。分別是上游422位的堿基由G變成C,上游667位的堿基由T變成了C,都沒有發生在已報道的調控區的關鍵調控元件部位。
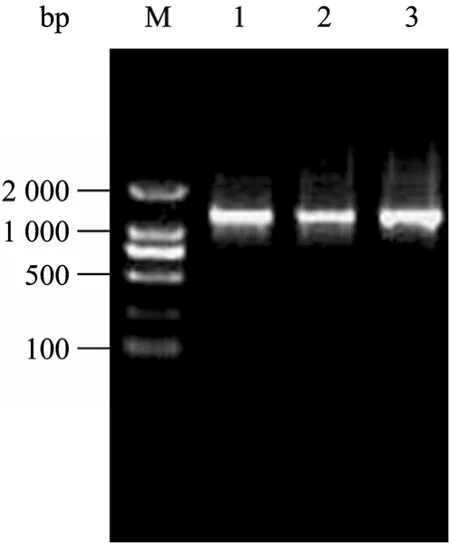
圖1 雞卵清蛋白調控區的PCR擴增結果Fig. 1 PCR products of chicken OV regulatory region. M: DL2000 marker; 1?3: PCR products.
將擴增的 O V調控區片段克隆入改造的pcDNA3.1(+) 載體,獲得雞卵清蛋白啟動子表達載體pOV。再將重組載體pOV和pcDNA3.1(+) 分別連入EGFP、Luc報告基因片段,獲得帶有標記基因的雞卵清蛋白啟動子表達載體 pOV-EGFP、pOV-Luc和 CMV啟動子表達載體 pcDNA3.1(+)-EGFP和pcDNA3.1(+)-Luc。為了驗證所構建載體的正確性,用限制性內切酶NruⅠ/HindⅢ和BamHⅠ/ XhoⅠ分別雙酶切載體,經瓊脂糖凝膠檢測,結果切出的 OV調控區的大小約為 1.25 kb,酶切的EGFP、Luc報告基因片段大小分別約為725 bp、1 677 bp,片段長度與預計大小相一致,表明連接正確 (圖2~5)。

圖2 pOV-EGFP載體的酶切鑒定Fig. 2 Identification of pOV-EGFP by enzyme digestion. M: DL5000 marker; 1: pOV-EGFP vector digested with Nru Ⅰand Hind Ⅲ; 2: pOV-EGFP vector digested with BamH Ⅰand Xho Ⅰ.
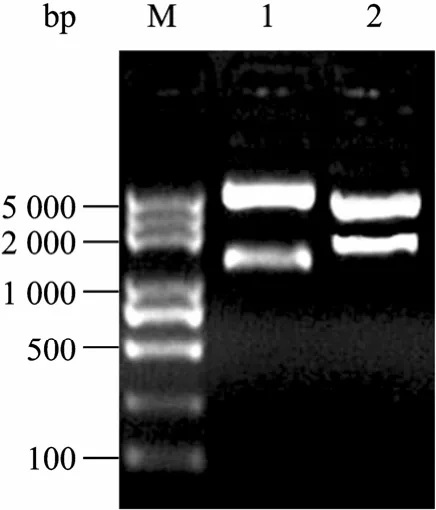
圖3 pOV-Luc載體的酶切鑒定Fig. 3 Identification of pOV-Luc by enzyme digestion. M: DL5000 marker; 1: pOV-Luc vector digested with Nru Ⅰand Hind Ⅲ ; 2: pOV-Luc vector digested with BamH Ⅰand Xho Ⅰ.
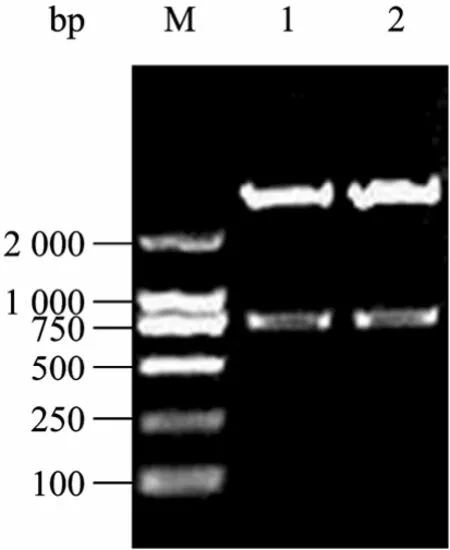
圖4 pcDNA3.1(+)-EGFP的酶切鑒定Fig. 4 Identification of pcDNA3.1(+)-EGFP by enzyme digestion. M: DL2000 marker; 1?2: pcDNA3.1(+)-EGFP vector digested with BamH Ⅰand Xho Ⅰ.
2.2 卵清蛋白啟動子表達載體和對照載體啟動子活性比較
將CMV啟動子表達載體pcDNA3.1(+)-EGFP、雞卵清蛋白啟動子表達載體pOV-EGFP分別轉染雞胚成纖維細胞、雞原代輸卵管上皮細胞、鼠3T3-L1前脂肪細胞和牛乳腺上皮細胞,轉染后48 h檢測綠色熒光蛋白的表達效果。進行 3次以上重復,都選取實驗所得結果中 EGFP表達量較高、熒光分布均勻的圖片。結果發現,轉染后 pcDNA3.1(+)-EGFP和pOV-EGFP在4種細胞中均有熒光表達 (圖6)。 pcDNA3.1(+)-EGFP在轉染雞胚成纖維細胞組中熒光表達量較高,在其他 3種細胞組中表達水平相當(圖6E~H);pOV-EGFP在轉染鼠3T3-L1前脂肪細胞組中熒光表達量較低,在其他3種細胞組中表達水平相當 (圖6I~L)。總體來看,pcDNA3.1(+)-EGFP在轉染的 4種細胞組中熒光表達量明顯高于pOV-EGFP。
圖5 pcDNA3.1(+)-Luc的酶切鑒定結果Fig. 5 Identification of pcDNA3.1(+)-Luc by enzyme digestion. M: DL2000 marker; 1?2: pcDNA3.1(+)-Luc vector digested with BamH Ⅰand Xho Ⅰ.

圖6 pcDNA3.1(+)-EGFP、pOV-EGFP轉染細胞后EGFP表達效果Fig. 6 Expression of EGFP after transfected cells with pcDNA3.1(+)-EGFP and pOV-EGFP. (A,E,I) Chicken embryo fibroblasts cells. (B,F,J) Chicken oviduct epithelial cells. (C,G,K) Mouse 3T3-L1 preadipocytes cells. (D,H,L) Bovine mammary epithelial cells. (A-D) Cells picture. (E-H) Transfected with pcDNA3.1(+)-EGFP. (I-L) Transfected with pOV-EGFP.
將載體 pcDNA3.1(+)-Luc和 pOV-Luc分別與phRL-TK共轉染以上4種細胞,并于轉染后48 h檢測螢火蟲熒光素酶表達效果。結果發現,轉染后pcDNA3.1(+)-Luc和pOV-Luc在4種細胞中均有熒光素酶的表達。pcDNA3.1(+)-Luc在轉染雞胚成纖維細胞組中酶表達量較高,較其他3組差異極顯著(P<0.01),pOV-Luc在轉染雞原代輸卵管上皮細胞組酶表達量略高于其他組,較鼠 3T3-L1前脂肪細胞組和牛乳腺上皮細胞組差異顯著 (P<0.05),較雞胚成纖維細胞組差異不顯著(P>0.05)。總體來看,pcDNA3.1(+)-Luc在轉染4種細胞組中的酶表達量都要遠遠高出pOV-Luc,在雞胚成纖維細胞組高達6 000多倍,在雞輸卵管上皮細胞組也有473倍 (圖7)。
2.3 慢病毒載體介導基因在不同細胞中的表達
將慢病毒 LV-GFP-Luc分別感染雞胚成纖維細胞、雞原代輸卵管上皮細胞、鼠3T3-L1前脂肪細胞和牛乳腺上皮細胞,感染后96 h檢測綠色熒光蛋白的表達效果。進行 3次以上重復,都選取實驗所得結果中 EGFP表達量較高、熒光分布均勻的圖片。結果發現,慢病毒載體具有良好的宿主廣泛性,感染后LV-GFP-Luc在4種細胞中均有熒光表達,但慢病毒表達效率在不同的細胞間具有差異性,在感染雞胚成纖維細胞組中熒光表達量略高,在其他3種細胞組中表達水平相當 (圖8)。
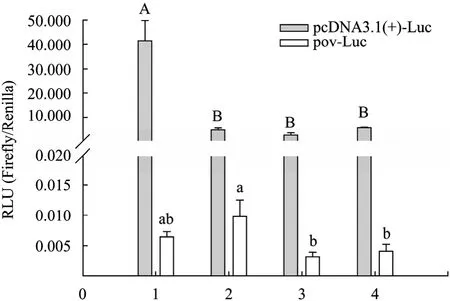
圖7 pcDNA3.1(+)-Luc、pOV-Luc轉染細胞后熒光素酶的表達 (螢火蟲/海腎)Fig. 7 Expression of Luciferase after transfected cells with pcDNA3.1(+)-EGFP and pOV-EGFP (Firefly/Renilla). RLU: relative light unit. 1: chicken embryo fibroblasts cells; 2: chicken oviduct epithelial cells; 3: mouse 3T3 preadipocytes cells; 4: bovine mammary epithelial cells. Capital-small letter means highly differ significantly (capital letter for cells transfected with pcDNA3.1(+)-Luc and small letter for cells transfected with pOV-Luc, P<0.01); A-B means highly differ significantly (P<0.01); a-b means differ significantly (P<0.05).
慢病毒LV-GFP-Luc感染后96 h檢測螢火蟲熒光素酶活性,結果發現,感染后在 4種細胞中均有熒光素酶的表達,其中,在感染雞胚成纖維細胞組中酶表達量較高,較其他3組差異極顯著 (P<0.01) (圖9)。
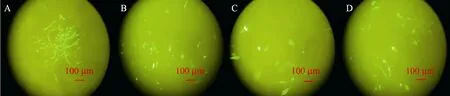
圖8 慢病毒感染細胞后綠色熒光蛋白的表達效果Fig. 8 Expression of EGFP after infected cells with lentivial. (A) Chicken embryo fibroblasts cells. (B) Chicken oviduct epithelial cells. (C) Mouse 3T3 preadipocytes cells. (D) Bovine mammary epithelial cells.
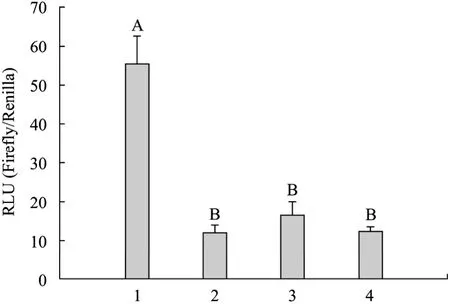
圖9 慢病毒感染細胞后熒光素酶的表達 (螢火蟲/海腎)Fig. 9 Expression of luciferase after infected cells with lentivial (Firefly/Renilla). RLU: relative light unit. 1: chicken embryo fibroblasts cells; 2: chicken oviduct epithelial cells; 3: mouse 3T3 preadipocytes cells; 4: bovine mammary epithelial cells. A-B means highly differ significantly (P<0.01).
2.4 慢病毒載體啟動活性分析
在培養6~8 d的雞原代輸卵管上皮細胞中感染慢病毒LV-GFP-Luc,分別將感染單個細胞的病毒顆粒 (Multiplicity of infection,MOI) 設為5、10、20三個對照組,感染后96 h檢測綠色熒光蛋白的表達效果。進行 3次以上重復,都選取實驗所得結果中EGFP表達量較高、熒光分布均勻的圖片。結果發現,隨著MOI的提高,綠色熒光蛋白表達量也隨之升高(圖10 A~C),與之前2.2中結果相比,當MOI為20時,LV-GFP-Luc感染雞原代輸卵管上皮細胞后熒光的表達量達到了 pcDNA3.1(+)-EGFP轉染該細胞的表達水平 (圖10D),遠遠高于pOV-EGFP轉染該細胞的表達水平 (圖10E)。
3 討論
制備轉基因雞輸卵管生物反應器的基本方法是以組織特異性基因的調控序列指導外源基因在雞輸卵管中定位表達,然后從轉基因雞所產的蛋中獲取表達產物[3,5]。雞卵清蛋白基因啟動子是指導外源基因高效表達的理想調控區,該基因的一些與輸卵管特異性表達相關的調控元件已經被廣泛研究,其中,類固醇依賴的正調控序列 (SDRE) 及其下游的負調控序列 (NRE) 和轉錄起始位點上游處的 TATATAT框是最為重要的調控元件[15]。Sanders等[16-17]的研究結果表明,這些元件都位于上游調控區1 kb以內,說明該長度序列足以指導外源基因的高水平表達。Zhu等[7]分別用卵清蛋白基因 5′側翼7.5 kb和15 kb片段以及3′側翼15.5 kb片段作為雞輸卵管組織特異性表達啟動子,以抗腫瘤的單克隆抗體和人干擾素基因為目的基因,制作出的轉基因嵌合體家雞所產的雞蛋蛋清中外源蛋白的含量達到了3 mg,不過,未能實現組織特異性表達,推斷可能所采用的調控序列還不足以實現輸卵管組織特異性表達。Kwon等[18]縮短啟動子長度至1.35 kb用于轉基因鵪鶉,雖然在卵白中表達重組人白細胞介素-1受體拮抗蛋白含量僅為88.7~233.8 pg?L,但卻保持了輸卵管的組織特異性。

圖10 雞輸卵管上皮細胞中綠色熒光蛋白的表達效果Fig. 10 Expression of EGFP in chicken oviduct epithelial cells. (A?C) Infected with lentivial (A: MOI=20, B: MOI=10, C: MOI=5). (D) Transfected with pcDNA3.1(+)-EGFP. (E) Transfected with pOV-EGFP. (F) Blank control.
本研究中,對照載體的CMV啟動子是廣泛性表達的啟動子,因此,pcDNA3.1(+)-GFP和pcDNA3.1(+)-Luc在轉染的4種細胞中都獲得了表達。在雞胚成纖維細胞組綠色熒光蛋白和熒光素酶報告基因表達量都要明顯高于其他組,可能與成纖維細胞快速的生長特性和對質粒載體的表達高效性有關。
在選用1.25 kb雞卵清蛋白基因5′側翼區為啟動子的載體轉染中,pOV-EGFP和pOV-Luc在4種細胞中也都獲得了表達,沒有表現出細胞特異性,可能是所采用的調控序列沒有包含所有必要的調控元件,還不能實現輸卵管組織特異性表達。轉染pOV-EGFP在鼠3T3-L1前脂肪細胞組綠色熒光蛋白表達量較低;轉染pOV-Luc在雞原代輸卵管上皮細胞組熒光素酶的表達量與雞胚成纖維細胞組表達量差異不顯著,與鼠3T3-L1前脂肪細胞組和牛乳腺上皮細胞組差異顯著,這些都可能與所構建的載體在不同細胞中的表達差異有關。同時,卵清蛋白啟動子載體在轉染各細胞組中報告基因表達活性較低,與 CMV啟動子的對照質粒載體的表達效率相差數百倍,這與之前孫明軍等[19]所得的結果相一致,可能是與擴增的卵清蛋白基因調控區片段沒有包含其遠端的增強子有關[5]。
近年來,應用慢病毒作為表達載體進行轉基因雞輸卵管反應器方面的研究已經獲得了初步成功,在多種細胞和組織中檢測到了外源基因的表達。Xu等[20]以增強型綠色熒光蛋白為標記基因構建復制缺陷型慢病毒載體感染不同來源、不同分化特征的細胞,均獲得了較高水平的表達。Park等[21]通過慢病毒載體結合顯微注射和原始生殖細胞等轉基因方法,生產出的轉基因雞在多種組織中都檢測到了標記基因的表達。特別是最近Masamichi等[22]應用廣泛表達的逆轉錄病毒載體生產的藥用抗體在轉基因雞的血清,所產蛋的蛋黃和蛋白中都獲得了表達。本研究中,慢病毒在所感染的 4種細胞 (分別來源于雞、鼠、牛) 都獲得了綠色熒光蛋白的表達,表明其具有廣泛的宿主。但在不同的細胞間表達效率具有一定的差異。在雞胚成纖維細胞組綠色熒光蛋白的表達量略高于其他 3個細胞組,熒光素酶報告基因的表達量顯著高于其他3個細胞組,可能與該細胞所具有的增殖能力強,對病毒耐受性好,長期保持性狀穩定等特點[23]有關。同時,兩種報告基因所得結果的差異可能與不同報告基因的檢測方法有關。目前,獲取輸卵管高效特異性啟動子,并與慢病毒表達載體相結合將成為轉基因雞輸卵管反應器研究的熱點。
獲得外源基因在雞輸卵管組織高效表達的載體是制備雞輸卵管生物反應器的首要條件。Ochiai等[24]采用卵清蛋白基因5′側翼1.35 kb片段和3種不同的病毒啟動子分別構建載體,通過基因槍的方法注射到產蛋母雞的輸卵管部位,結果發現病毒啟動子的啟動效率遠遠高于卵清蛋白調控區。本研究中,采用不同 MOI的慢病毒感染雞原代輸卵管上皮細胞,隨著MOI的提高,GFP表達量升高。在MOI為20時熒光表達活性就可達到攜帶CMV啟動子的質粒載體水平,遠遠高于攜帶雞卵清蛋白啟動子的表達載體水平,與Ochiai等所得的結果一致。綜合來看,與雞卵清蛋白啟動子表達載體相比,慢病毒載體的轉基因效率較高,在轉基因雞輸卵管反應器的制備上具有較好的應用前景。
REFERENCES
[1] Sun ZH, Miao XY, Zhu RL. New advances in animal transgenic technology. Hereditas, 2010, 32(6): 539?547.孫振紅, 苗向陽, 朱瑞良. 動物轉基因新技術研究進展.遺傳, 2010, 32(6): 539?547.
[2] Louis MH. Production of pharmaceutical proteins by transgenic animals. Comp Immunol Microbiol Infect Dis, 2009, 32(2): 107?121.
[3] Simon GL, Michael J, Adrian S, et al. Transgenic chickens as bioreactors for protein-based drugs. Drug Discov Today, 2005, 10(3): 191?196.
[4] Yan HF, Wen P, Hu XG, et al. Construction vector of transgenic poultry and import mothod research. Anim Husb Vet Med, 2008, 40(11): 92?95.燕海峰, 文平, 胡雄貴, 等. 轉基因禽類載體構建與導入方法研究現狀. 畜牧與獸醫, 2008, 40(11): 92?95.
[5] Zhao YH, Zhang NH, Du LX. Expression and regulation of chicken ovalbumin. Biotechnol, 2004, 14(4): 82?84.趙英會, 張念華, 杜立新. 雞卵清蛋白表達調控. 生物技術, 2004, 14(4): 82?84.
[6] Yu L, Zhao J, Zhang YL, et al. Construction of the expressing vector of 5′ flanking regulatory regions of the chicken ovalbum in gene and its transient expression in chicken primary oviduct cell and chicken fibroblasts cell cultures. Chin J Vet Sci, 2001, 21(1): 21?24.宇麗, 趙君, 張艷玲, 等. 雞卵清蛋白基因 5′調控序列表達載體的構建及其在雞原代輸卵管上皮細胞及雞成纖維細胞的表達. 中國獸醫學報, 2001, 21(1): 21?24.
[7] Zhu L, Van D, Albanese J, et al. Production of human monoclonal antibody in eggs of chimeric chickens. Nat Biotechnol, 2005, 23(9): 1159?1169.
[8] Man CL, Chen Y. Retrovirus and transgenic chicken. China Biotechnol, 2007, 27(7): 117?121.滿朝來, 陳巖. 逆轉錄病毒與轉基因雞. 中國生物工程雜志, 2007, 27(7): 117?121.
[9] Michael J, Sherman A, Ellard FM, et al. Efficient production of germline transgenic chickens using lentiviral vectors. EMBO Rep, 2004, 5(7): 728?733.
[10] Gao B, Sun HC, Wang YJ, et al. Optimization and in vivo expression of chicken oviduct-specific expression vector. Chin J Biotech, 2008, 24(1): 137?141.高波, 孫懷昌, 王永娟, 等. 雞輸卵管特異表達載體的優化及體內表達. 生物工程學報, 2008, 24(1): 137?141.
[11] Shan CL, Chen Y. The pre-exploration of establishing chicken oviduct bio-reactor by retrovirus[D]. Harbin: Harbin Institute of Technology, 2007.單崇麗, 陳巖. 逆轉錄病毒法制備雞輸卵管生物反應器的前期探索[D]. 哈爾濱: 哈爾濱工業大學, 2007.
[12] Liu YB, Yu MZ, Shen XZ. The establishment of a temporary expression system in chicken oviduct epithelium. Chin Dev Reprod Biol, 2001, 10(1): 13?19.
[13] Tan XW, Ma SF, Liu XY, et al. Culture, purification and ability to support mouse embryo development of oviductal epithelial cells from different species. Acta Vet Zootech Sin, 2006, 37(9): 878?882.譚秀文, 馬所峰, 劉新勇, 等. 不同物種輸卵管上皮細胞培養、純度檢測及支持小鼠胚胎發育的能力. 畜牧獸醫學報, 2006, 37(9): 878?882.
[14] Lu LM, Li QZ, Wang CM, et al. Impact of miR-221 on mouse mammary epithelial cells and lactation. Chin J Biochem Mol Biol, 2009, 25(5): 454?458.陸黎敏, 李慶章, 王春梅, 等. miR-221對小鼠乳腺上皮細胞增殖和泌乳功能的影響. 中國生物化學與分子生物學報, 2009, 25(5): 454?458.
[15] Hyi-Man P, Sanders MM, Suzuki T, et al. An oviduct-specific and enhancer-like element resides at about -3000 in the chicken ovalbumin gene. Biochimie, 2006, 88(12): 1909?1914.
[16] Sanders MM, Mcknight GS. Positive and negative regulatory elements control the steroed-responsive ovalbumin promotor. Biochemstry, 1982, 27(17): 6550?6557.
[17] Haecker SA, Muramatsu T, Sensenbaugh KR, et al. Repression of the ovalbumin gene involes multiple negative elements including a ubiqritous transcriptional silencer. Mol Endocrinol, 1995, 9(9): 1114?1126.
[18] Kwon SC, Choi JW, Jang HJ, et al. Production of biofuctional recombinant human interleukin 1 reportor antagonist from transgenic quail egg white. Biol Reprod, 2010, 82(6): 1057?1064.
[19] Sun MJ, Zhao C, Sha J, et al. Construction and expression of the specific secretory vector in the chicken oviduct cells. J Agric Biotechnol, 2003, 11(1): 75?78.孫明軍, 趙晨, 沙金, 等. 雞輸卵管組織特異性分泌表達載體的構建和表達. 農業生物技術學報, 2003, 11(1): 75?78.
[20] Xu SY, Sun Y, Ding HM, et al. Efficient production of transgenic chickens using self-inactive HIV-based lentiviral vectors. Acta Zool Sin, 2009, 55(5): 383?387.
[21] Park SH, Kim JN, Park TS, et al. CpG methylation modulates tissue-specific expression of a transgene in chickens, Theriogenology, 2010, 74(5): 805?816.
[22] Masamichi K, Yoshinori K, Takuya S, et al. Production of chimeric monoclonal antibodies by genetically manipulated chickens. J Biotechnol, 2009, 141(1/2): 18?25.
[23] Zhu GP, Zhou XL, Guo YF, et al. Primary culture and applications in chicken embryo fibroblasts. Prog Vet Med, 2010, 31(3): 112?114.朱國坡, 周曉麗, 郭延峰, 等. 雞胚成纖維細胞原代培養及應用. 動物醫學進展, 2010, 31(3): 112?114.
[24] Ochiai H, Park HM, Nakamura A, et al. Synthesis of human erythropoietin in vivo in the oviduct of laying hens by localized in vivo gene transfer using electroporation. Poult Sci, 1998, 77(2): 299?302.

