輕度認知功能損害患者1H-MRS的研究
張立蘋,蔣根娣,苗迎春,譚中建
(北京中醫藥大學東直門醫院,北京 100700)
輕度認知障礙(Mild congnitive impairment,MCI)是介于正常老化和癡呆之間的一種臨床狀態,是老年性癡呆(AD)的高危人群,在老年人中的發生率大約為 5.3%,并以每年16%比率發展為癡呆。因此,MCI目前已被廣泛接受為癡呆發病的預警信號和新療法的靶點。目前,臨床工作面臨的一個巨大挑戰就是尋找客觀、無創傷的監測神經元和大腦功能衰退的生物學指標。近年來對MCI臨床診斷的生物學標志的研究,主要集中在測量腦脊液中的Aβ42和tau蛋白及腦影像學檢查,這些指標對MCI的診斷和鑒別診斷有重要價值。國際上有關MCI的研究重點集中在MCI與AD之間的功能連接上,旨在尋找AD的生物學標志,以提高AD早期診斷的準確性和干預措施的針對性。
磁共振波譜(MRS)是一種利用磁共振現象和化學位移作用進行一系列特定原子核及其化合物分析的方法,也是用于無創性研究活體組織器官代謝、生化改變及化合物定量分析的主要影像學技術。目前在我國應用最廣泛的是1H-MRS。它可以反映不同癡呆的病理生理改變,是各種癡呆診斷的有用工具。本文對遺忘型輕度認知損害(aMCI)和AD病人及正常對照個體行雙內側顳葉和左后扣帶回1H-MRS的研究,以便明確aMCI的細胞生化改變特征及在aMCI的診斷和鑒別診斷中的價值。
1 材料與方法
1.1 病例收集與診斷標準
研究對象:以北京地區50~80歲居民為調查對象,于2008年12月~2010年3月經北京中醫藥大學東直門醫院老年病科進行篩查,按照受試者就診次序,對其進行神經心理學評價和臨床體檢,篩選出aMCI組12例、AD組12例和認知正常組12例,共36例,所有研究對象均為右利者。
1.1.1 病例的排除標準
aMCI排除標準:①肯定的癡呆:MMSE≤19分或符合DSM-IV癡呆診斷標準;②明顯的腦血管疾病:Hachinski評分(HIS)大于4分或臨床腦梗塞;③過去2年內出現過符合DSM-IV標準的中度抑郁或另一種精神疾病,哈密爾頓抑郁評定量表得分大于12分/17項量表;④過去2年內有酒精或藥物濫用或成癮史(DSM-IV標準);⑤精神分裂癥病史(DSM-IV標準);⑥任何明顯的神經疾病如帕金森病、亨廷頓病、正常壓力腦積水、腦腫瘤、進行性核上麻痹、癲癇、慢性硬膜下血腫、多發性硬化、嚴重頭外傷史伴有持續神經功能缺損或已知的結構性腦異常;⑦在調查者的印象中受試者不能配合研究程序。
AD排除標準:①患者無可靠照料者;②伴有嚴重軀體疾病者,合并心、肝、腎和造血系統等嚴重原發性疾病;但下列患者可以包括在研究中:高血壓被控制,右束支傳導阻滯(完全或部分),安裝了心臟起搏器;③精神病患者,1年內使用大劑量精神藥物者;④抑郁癥患者,Hamilton測驗>12/17分;⑤已知或懷疑患者在過去10年中有酒精或藥物濫用史;⑥甲狀腺功能異常、營養不良性貧血引起癡呆;⑦在調查者的印象中受試者不能配合研究程序。
1.1.2 病例的診斷標準
aMCI診斷標準依據Petersen[1]制定的MCI診斷標準:①主訴記憶減退,最好由他人證實;②查出記憶損害,得分等于或低于與年齡匹配的平均值的1.5SD;③總的認知功能正常;④日常生活活動保存完好;⑤無癡呆。
AD的診斷標準依據NINCDS-ADRDA AD診斷的研究標準[2](參照DSM-Ⅳ的診斷標準),在核心診斷標準基礎上加一項或幾項支持特征。
核心診斷標準:早期顯著的情節記憶損害,包括以下特征:①患者和知情人報告的逐漸遞減的記憶功能改變6個月以上。②測試提供明顯的情節記憶損害的客觀證據:一般包括(延遲)記憶損害,這種損害采用線索測試或再認測試和在對先前對照的信息進行有效編碼之后也不會明顯改善和常態化。③情節記憶損害可能是孤立的,也可能與AD發病或進展時的其他認知功能改變有關聯。
支持性特征:①有內側顳葉(MTL)萎縮:采用視覺評分(參考正常人的年齡常模)的MRI定性評定或興趣區容量分析法(參考正常人的年齡常模)的MRI定量評定,證明海馬、內嗅皮質、杏仁核體積縮小。②腦脊液生物標志異常:A:Aβ42濃度下降,總的tau蛋白濃度增加,或磷酸化tau蛋白濃度增加,或三者都有;B:將來發現的其他被驗證的標志。③功能神經影像學PET的特殊圖像:A:兩側顳頂區葡萄糖代謝下降;B:其他被驗證的配位子,包括那些預計可能會出現的如匹茲堡化合物B或FDDNP(另一種影像顯影劑,作為PET診斷AD和其他神經變性病的探針)。④已知的直系家族中AD常染色體顯性突變。
1.1.3 認知正常者的納入標準
①無記憶減退或其他認知損害主訴,或有不穩定的輕微記憶減退;②沒有記憶損害客觀證據;③不符合NINCDS-ADRDA很可能AD標準或DSM-IV癡呆診斷標準;④不符合MCI診斷標準。
3組研究對象的臨床信息情況見表1。

表1 NC,aMCI,AD組臨床信息情況表
1.2 成像方法和技術
采用Siemens公司生產的1.5T超導磁共振儀行常規MRI及單體素1H-MRS檢查,采用頭部正交線圈。病人靜息15分鐘后擺好掃描位置行以下檢查:①常規掃描:應用SE序列分別對36例研究對象行頭顱MRI掃描。A:定位掃描:在矢狀位、軸位及冠狀位行T1WI定位掃描,FOV 280mm,FOV phase 100%, 層厚 10mm,TR 20ms,TE 5ms, 掃描時間9.2s。 B:T1WI 矢 狀 位 成 像 t1-mpr-ns-sag:TR 300ms,TE 8ms,層厚 6.0mm,無間隔掃描,掃描時間1分23秒。C:T2WI軸位黑水成像 t2-tirm-tradark-fluid:TI 2300ms,TR 8100ms,TE 126ms,層厚6.0mm,掃描時間1分55秒。D:T2WI冠狀位黑水成像 t2-tirm-cor-dark-fluid:TI 2300ms,TR 8100ms,TE 126ms,層厚5.0mm,掃描時間1分55秒。常規掃描用于海馬容積掃描和1H-MRS采集的定位,同時用于除外所選對象中有多發性腔隙性梗塞、腦積水、顱內腫瘤等病變,如有陽性發現者即不再行海馬體積掃描及波譜檢查。②1H-MRS采集技術參數:采用單體素波譜(single voxel spectroscopy)序列為SVS-SE-30 序列,TR 1500ms;TE 30ms;FA 90°,平均 256次采樣,矩陣 1024×1024,水激發 BW 35MHz,采集 BW 1000MHz。 興趣區(ROI)為左側內側顳葉、右側內側顳葉及左側后扣帶回,體素大小雙內側顳葉1.2cm×1.2cm×1.2cm,后扣帶回為1.5cm×1.5cm×1.5cm,每個 ROI都在 T2WI黑水冠狀位、T1WI矢狀位及T2WI黑水橫斷位3個方向上準確定位(圖 1a,1b,1c),ROI盡量多包含顳葉組織及灰質,盡量少的包含側腦室內腦脊液,避開巖尖脂肪及溝回內腦脊液(避免其造成磁場不均勻),每個體素掃描時間3分18秒。自動預掃描程序完成增益調節、勻場、水抑制和無水抑制掃描,設備提供的軟件自動識別并計算各代謝物波峰曲線下面積。各代謝物的化學頻移位置為:N-乙酰天門冬氨酸(NAA)2.0ppm、肌酸(Cr)3.0ppm、膽堿(Cho)3.2ppm、肌醇(mI)3.5ppm。以Cr為內參照計算各代謝物的相對濃度。磁共振掃描儀自帶軟件自動完成基線校準、信號平均、代謝物識別、各代謝物波峰曲線下面積計算(圖 2~4)。
1.3 統計方法
所有數據采用SPSS 13.0軟件進行統計分析與處理,主要的統計學方法包括卡方檢驗、方差齊性檢驗、方差分析及SNK-q檢驗、LSD檢驗,P<0.05為有統計學意義;秩和檢驗(秩和檢驗顯著性檢驗的水準P<0.017);相關性分析采用 Spearman相關檢驗法,P<0.05為有統計學意義;代謝不對稱指數的計算:[(右-左)/(右+左)/2]×100。

圖1 右內側顳葉波譜測量冠狀位、矢狀位、軸位3個方向定位圖。Figure 1.Localization of the right medial temporal lobe:volume of interest(VOI)on coronal(Figure 1a),sagittal(Figure 1b)and axial(Figure 1c)image.圖2 正常 (NC)波譜圖。圖3 aMCI波譜圖與NC比較NAA/Cr降低。圖4 AD波譜圖與NC比較NAA/Cr降低。Figure 2~4.Example of proton spectra from the right medial temporal lobe:volume ofinterest with an echo time of 30ms in a control subject(Figure 2),a patient with amnestic mild congnitive impairment(aMCI)(Figure 3),and a patient with probable AD(Figure 4).The N-acetyl aspartate(NAA)/creatine(Cr)ratio was lower in both the probable AD and the aMCI compared to the control subject.
2 結果
3組性別行卡方檢驗差異不顯著(χ2=0.892,P=0.640)。 年齡行方差齊性檢驗(F=2.497,P=0.098)方差齊,3組年齡及受教育年限差異不顯著(P>0.05);MMSE評分方差不齊,行秩和檢驗,3組MMSE評分的比較:NC與aMCI比較有統計學意義(χ2=11.496,P=0.001);NC與 AD比較有統計學意義(χ2=17.586,P=0.000);aMCI與 AD 比較有統計學意義 (χ2=16.504,P=0.000);即3組間MMSE分值差異有統計學意義。MMSE評分與分組相關(r=-0.895,P=0.000),年齡、受教育年限與MMSE分值不相關。
雙側內側顳葉、左后扣帶回3組間的代謝物比值比較行方差齊性檢驗、方差分析及LSD、SNK檢驗,P<0.05為有統計學意義。3組各ROI代謝物比值:NAA/Cr,Cho/Cr,mI/Cr,NAA/mI, 進行兩兩組間的多重比較()表示。
aMCI、AD和NC組左內側顳葉1H-MRS代謝物比值的比較見表2。
左內側顳葉的NAA/Cr:aMCI組明顯低于NC組,差異顯著(P=0.006);AD組明顯低于NC組,差異顯著(P=0.010),AD組與aMCI組差異不顯著(P=0.852)。左內側顳葉NAA/mI:aMCI組明顯低于NC組,差異顯著(P=0.028);AD組明顯低于NC組,差異顯著(P=0.033),AD組與aMCI組差異不顯著(P=0.947)。左內側顳葉mI/Cr:3組比較AD>aMCI>NC,但差異不顯著。左內側顳葉Cho/Cr:3組比較差異無統計學意義。
表2 aMCI、AD和NC組左內側顳葉1H-MRS代謝物比值的比較()

表2 aMCI、AD和NC組左內側顳葉1H-MRS代謝物比值的比較()
注:①1:左內側顳葉aMCI和NC NAA/Cr均值比較差異顯著(P=0.006);2:AD 和 NC NAA/Cr均值比較差異顯著(P=0.010);②1:左內側顳葉aMCI和NC NAA/mI均值比較差異顯著(P=0.028);2:AD和NC NAA/mI均值比較差異顯著(P=0.033)。
NAA/Cr Cho/Cr mI/Cr NAA/mI NC 2.3745±0.9074 0.7741±0.3879 0.3126±0.1406 7.7162±2.9084 aMCI1.4056±0.79681 0.8067±0.4825 0.3308±0.1990 4.6911±3.51441 AD 1.4679±0.71572 0.7499±0.4176 0.5313±0.4042 4.7794±3.24702
aMCI、AD和NC組右內側顳葉1H-MRS比較見表3。
表3 aMCI、AD和NC組右內側顳葉1H-MRS比較()
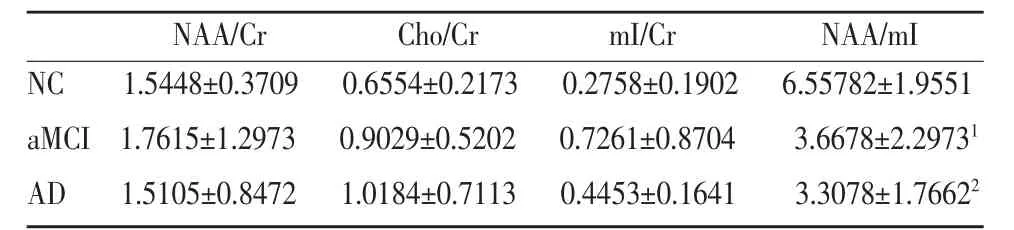
表3 aMCI、AD和NC組右內側顳葉1H-MRS比較()
注:1:右內側顳葉aMCI和NC NAA/mI均值比較差異顯著,P=0.001;2:AD 和 NC NAA/mI均值比較差異顯著,P=0.000。
NAA/Cr Cho/Cr mI/Cr NAA/mI NC 1.5448±0.3709 0.6554±0.2173 0.2758±0.1902 6.55782±1.9551 aMCI1.7615±1.2973 0.9029±0.5202 0.7261±0.8704 3.6678±2.29731 AD 1.5105±0.8472 1.0184±0.7113 0.4453±0.1641 3.3078±1.76622
右內側顳葉NAA/mI:aMCI組明顯低于NC組,差異顯著(P=0.001);AD組明顯低于NC組,差異顯著(P=0.000),AD組與 aMCI組差異不顯著(P=0.659)。右內側顳葉 Cho/Cr:3組比較 AD>aMCI>NC,但差異無統計學意義,NAA/Cr、mI/Cr 3組比較,差異不顯著。
aMCI、AD和NC組左扣帶回后部1H-MRS比較見表4。
表4 aMCI、AD和NC組左扣帶回后部1H-MRS比較()

表4 aMCI、AD和NC組左扣帶回后部1H-MRS比較()
注:3組間代謝物比值均值比較差異不顯著。
NAA/Cr Cho/Cr mI/Cr NAA/mI NC 1.9865±0.3929 0.6537±0.1366 0.4359±0.1299 4.7628±1.5461 aMCI 1.9411±0.4063 0.6275±0.1915 0.3507±0.1153 5.9634±2.7408 AD 1.6821±0.4762 0.60294±0.1232 0.3733±0.1053 4.7271±1.6667
aMCI、AD和NC組左扣帶回后部NAA/Cr、Cho/Cr、mI/Cr及NAA/mI比較,差異均無統計學意義。
aMCI、AD和NC組的代謝物不對稱指數比較見表5。
表5 aMCI、AD和NC組兩內側顳葉的代謝物比值不對稱指數比較()

表5 aMCI、AD和NC組兩內側顳葉的代謝物比值不對稱指數比較()
注:1:aMCI和NC均值比較差異顯著,P<0.05。
NAA/Cr Cho/Cr mI/Cr NAA/mI NC -41.747±28.114 -4.326±66.520 -1.419±17.520 -19.333±17.502 aMCI 16.912±52.2901 -7.622±101.895 -5.207±80.519 7.488±96.143 AD 9.676±78.181 34.716±54.946 -26.067±85.598 -17.179±81.635
雙內側顳葉aMCI組與NC組NAA/Cr代謝物不對稱指數比較,差異顯著(P=0.045),余代謝物比值差異無統計學意義。
3 討論
MRS是利用MR中的化學位移現象來測定分子組成及空間分布的一種檢測方法。在MRS譜線上,峰值曲線下的面積代表物質的含量,峰值在頻率軸上的位置代表物質的種類,常用系統磁共振的頻率的百萬分幾(ppm)表示。當前在AD相關疾病中研究最多的代謝物包括Cr、Cho、mI和NAA等。
NAA主要在中樞神經系統的神經元中出現,而不出現在神經膠質細胞或者是非神經細胞組織中。NAA的水平在神經元喪失或者是受損時會降低,但是在神經元修復期NAA的水平會恢復到正常。NAA水平的高低反映了神經元活性的變化和數量的多少,被認為是神經功能的一個標記物,NAA含量或與其它代謝物的比值的減低,可作為神經元脫失或活性降低的最佳指標。在許多體外的大腦尸體解剖的研究中,與對照組的病人相比,AD病人的NAA的水平下降。本研究發現,左內側顳葉aMCI和AD組的NAA/Cr均明顯低于NC組,有統計學差異(P<0.05),這與以往多項研究相一致[3-6];而AD組與aMCI組比較,差異不顯著(P>0.05)。右內側顳葉及左后扣帶回NAA/Cr三組比較,差異無統計學意義,與Kantarci[7]的報道不同。NAA/Cr的下降考慮是aMCI和AD患者的海馬的神經元密度的減少、神經元的丟失,或者部分可逆的神經功能障礙所引起[8]。雙內側顳葉NAA/Cr的不同表現,考慮aMCI和AD對雙側海馬的侵襲可能是不同步的,即雙側海馬不同時受累。本組研究顯示病變先侵襲左內側顳葉,本研究所選觀察對象均為右利者,有研究發現左側海馬與語言信息的記憶能力有關,而右側海馬與空間信息的記憶能力有關。研究對象的入選以記憶損害為主要癥狀,這樣導致結果對左側海馬的結構和功能的反映更充分。同時有文獻報道腦內NAA含量與乙酰膽堿酯酶抑制藥對AD臨床治療的反應有相關性增加[9-11],支持了NAA含量和NAA與其它代謝物比值的變化,可以反映出神經元活性的變化和數量多少的結論,間接地反映了aMCI和AD的病理特征。Jessen[3]在一項多中心1H-MRS的研究中提出,NAA的測量,應作為AD診斷另外的一個候選生物學指標。首先NAA在單體素和多體素研究中的穩定性,以及NAA的減低在大量AD患者研究結果的高度一致性;其次,和海馬萎縮一樣,NAA的減低獨立于其它的影像學標記物;檢測時間短(相對來說),不用示蹤劑,也沒有輻射;還有在與AD的其它生物學標記物綜合分析時更會發現1H-MRS體現AD病理特征的獨特貢獻。在本研究中,左側NAA/Cr不但能鑒別AD與NC,同時也能鑒別aMCI和NC,這在AD前期的診斷尤為重要,有可能影響和改變AD的發展進程,需要我們多中心大樣本更深一步的研究。
mI為神經膠質的標志物,mI增高被認為是膠質增生的指征。盡管AD病人在同時有許多共存的其他疾病的影響下,mI的代謝發生紊亂,但是在大多數的研究中,AD病人mI絕對值和mI與其他代謝物的比值顯著增加,而且在癡呆出現前和癡呆早期就已經增加。本研究發現,aMCI和AD患者雙內側顳葉與對照組NAA/mI比較均有明顯降低,尤其是右側海馬NAA/mI在aMCI和AD患者與對照組比較在NAA/Cr沒有明顯差異時,NAA/mI出現了明顯的變化。
有研究表明,AD病人mI有不同程度的升高,尤其在疾病早期。Kantarci[12]檢測了扣帶回后部、左側顳上回及枕葉內側的 NAA/Cr,Cho/Cr,mI/Cr,MCI與正常對照組間僅有扣帶回后部的mI/Cr具有統計學差異。扣帶回后部的各化合物中,mI/Cr對于MCI和正常人的鑒別敏感性最高,NAA/Cr對AD與MCI的鑒別敏感性高,兩者的結合即NAA/mI對于AD和正常人的鑒別敏感性最高。由此可見,AD病變過程中最早的1H-MRS表現是為mI/Cr的升高,然后才出現NAA/Cr的降低。
Cho類化合物:腦內各部位Cho存在于神經元和膠質細胞,包括游離膽堿、甘油磷酸膽堿及磷酸膽堿,Cho與細胞膜磷脂的分解和合成有關。Cho可反映細胞膜的穩定性和神經膠質的增生,AD和MCI病人1H-MRS檢測到的Cho含量的變化不一。在某些研究中有作者發現Cho含量增加,AD病人大腦中的膽堿水平較之對照組為高,其代謝水平與認知評分和癡呆的程度密切相關。有人卻未發現Cho含量的改變,或Cho含量的降低[3]。造成上述結果的原因可能是因為1H-MRS對Cho測量的準確性較低,尤其是皮質區Cho的信號強度較弱;此外TE(回波時間)的選擇也會影響Cho含量的測量。在本研究中雙內側顳葉及后扣帶回的Cho/Cr比值,三組間差異均沒有統計學意義。與劉瑩[13]報道結果一致,這可能與MRS所測出的Cho峰為磷酸膽堿、甘油磷酸膽堿和游離膽堿的復合峰有關。在AD腦代謝中,游離膽堿水平一般正常,磷酸膽堿水平下降,而甘油磷酸膽堿水平相對增高,但由于后兩者的均衡作用,可能會導致AD的Cho水平變化不明顯。
長期研究顯示,無論是從宏觀的腦解剖結構和微觀的細胞構筑,還是從生理、生化上均可發現大腦半球的不對稱性。這種不對稱模式在正常成人、MCI和AD病人均有發現。本研究發現左內側顳葉aMCI組與NC組代謝物不對稱指數差異顯著(P<0.05),即左內側顳葉神經元較右側丟失的更快,左側受累較早,與文獻報道一致。由于AD和MCI逐漸被社會和學術界所重視,疾病早期行為能力的減低得以評估,MCI患者的兩內側顳葉代謝的不對稱得以發現。而AD組兩側代謝物比值的變化同NC比變化不明顯,同劉瑩[13]的結論一致。說明中度癡呆的AD患者雙側半球的受累程度一致。
[1]Petersen RC,Smith GE,Waring SC,et al.Mild cognitive impairment:clinical characterization and outcome[J].Arch Neurol,1999,56(6):760.
[2]田金洲.阿爾茨海默病的診斷與治療[M].北京:人民衛生出版社,2009.124-125.
[3]Jessen F,Gur O,Block WD,et al.A multicenter1H-MRS study of the medial temporal lobe in AD and MCI[J].Neurology,2009,72:1735-1740.
[4]丁萍,苗華棟,嵇鳴,等.輕度認知功能障礙和輕度Alzheimer病的1H-MRS 研究[J]. 上海醫學影像,2008,17(1):5-8.
[5]Chantal S,Braun CMJ,Bouchard R,et al.Similar1H magnetic resonance spectroscopic metabolic pattern in themedial temporal lobes of patients with mIld cognitive impairment and Alzheimer disease[J].Brain Res,2004,1003:26-35.
[6]Franczak M,Prost RW,Antuono PG,et al.Proton Magnetic Resonance Spectroscopy of Hippocampus in Patients with Mild Cognitive Impairment:A Pilot Study[J].J Comput Assist Tomogr,2007,31(5):666-670.
[7]Kantarci K,Jack CR,Xu YC,et al.Regional metabolic patterns in mild conginitive impairment and Alzhimer’s disease:A1HMRS study[J].Neurology,2000,55:210-217.
[8]Den Heijer T,Sijens PE,Prins ND,et al.MR spectroscopy of brain white matter in the prediction of dementia[J].Neurology,2006,66:540-544.
[9]Krishnan KR,Charles HC,Doraiswamy PM,et al.Randomized,placebo-controlled trial of the effects of donepezil on neuronal markers and hippocampal volumes in Alzheimer’s disease[J].Am J Psychiatry,2003,160:2003-2011.
[10]Jessen F,Traeber F,Freymann K,et al.Treatment monitoring and response prediction with proton MR spectroscopy in AD[J].Neurology,2006,67:528-530.
[11]Modrego PJ,Pina MA,Fayed N,et al.Changes in metabolite ratios after treatment with rivastigmine in Alzheimer’s disease:a non-randomised controlled trial with magnetic resonance spectroscopy[J].CNS Drugs,2006,20:867-877.
[12]Kantarci K,Reynolds G,Petersen RC,et al.Proton MR spectroscopy in mild cognitive impairment and Alzheimer disease:comparison of 1.5T and 3T[J].AJNR,2003,24(5):243-249.
[13]劉瑩,張本恕,錢麗霞.氫質子磁共振波譜對Alzheimer病神經生化改變的分析 [J].中國神經免疫學和神經病理學雜志,2005,12(4):204-207.

