小鼠對結核分枝桿菌Ag85B-Esat6-HspX融合基因的免疫反應
袁 偉,董 娜,張麗芳,林樹柱,向志光,喬紅偉,秦 川
(中國醫學科學院,北京協和醫學院,醫學實驗動物研究所,衛生部人類疾病比較醫學重點實驗室,國家中醫藥管理局人類疾病動物模型三級實驗室,北京 100021)
結核病是由結核分枝桿菌引起的一種傳染性疾病。據世界衛生組織報道,目前全球有近1/3的人感染了結核桿菌。隨著多重耐藥菌、極度耐藥株的出現,艾滋病與結核共感染人群的增加使得活動性結核病人日益增多[1]。卡介苗(BCG)用于預防結核病已有80多年的歷史,在世屆衛生組織免疫接種擴大方案中,卡介苗作為目前唯一的結核病疫苗正在廣泛使用。它雖然可以極好地預防幼兒粟粒性結核和結核腦膜炎,但不能預防結核病的最流行形式——成人肺結核,因此研究更為有效的 TB新型疫苗對TB的防治有著重要的意義。隨著MTB基因組測序的完成和比較基因組學的研究進展,人們通過基因工程技術改造BCG,或研究亞單位疫苗、基因疫苗、載體活疫苗等新型疫苗,或與BCG聯合建立組合型疫苗,采用基礎-加強型免疫策略等,以解決BCG的免疫力不足,以及其對成人保護性差和缺乏清除潛伏菌等問題。
有效、特異的保護性抗原是疫苗成功的一個重要因素,近年來,隨著基因組學研究的進展,不斷的有新抗原被發現和鑒定,目前,研究較多的結核桿菌保護性抗原有M tb8.4、M tb32、TB10.4、MPT64和38kD蛋白(PstS-1)等,國際上正在進行臨床研究的結核病疫苗采用的抗原主要是 Ag85、ESAT-6和M tb72F等。HspX是一種相對分子質量為16000的小分子熱休克蛋白家族,由基因 hspx(rv2031c)表達,屬于結核菌休眠期調控子(DosR regulon)。HspX是結核分枝桿菌在靜止生長期或低氧狀態下產生的主要蛋白,有研究表明HspX在結核分枝桿菌感染后短時間內減緩其在體內生長速度方面可能起到某種關鍵作用[2]。本研究選擇了結核重要的保護性抗原Ag85B和ESAT-6,以及休眠期細菌特有的抗原HspX,構建了 Ag85B-Esat6-HspX重組質粒,并將其免疫BALB/c小鼠,對其免疫原性了進行評價,進而為此疫苗的效力學評價奠定基礎。
1 材料和方法
1.1 菌株、質粒及蛋白
凍干皮內注射用卡介苗(BCG)購于成都生物制品研究所。pcDNA-Ag85B-Esat6-HspX和pcDNAHspX質粒由本室構建并保存。HspX蛋白由本室純化、保存。
1.2 主要試劑
去除內毒素(endo free)的質粒抽提試劑盒為Qiagen公司產品(德國)。小鼠干擾素γ(IFN-γ)和白細胞介素2(IL-2)酶聯免疫吸附測定(ELISA)試劑盒為美國 Biolegend公司產品。小鼠預包被ELISPOT試劑盒為深圳達科為生物技術有限公司產品。
1.3 實驗動物
BALB/c小鼠(SPF級)購于北京維通利華實驗動物技術有限公司[SCXK(京)2006-0009]。鼠齡6~8周,體重18~22 g,自由飲食進食,晝夜節律12 h。
1.4 動物分組及免疫
采用隨機數字表法將40只小鼠分為4組,每組10只:生理鹽水組 (NS,100μL);BCG組 (1×106CFU/只);pcDNA-HspX組 (pcDNA-HspX,100μg)、pcDNA-Ag85B-Esat6-HspX 組 (pcDNA-Ag85BEsat6-HspX,100μg)。
分別在第0、2、4周用質粒DNA一側股四頭肌肌肉注射免疫動物(100μg/只),1×106CFU BCG第0周時在頸部皮內免疫動物1次。在免疫的第2、4周和最后一次免疫后2周,各組小鼠剪取鼠尾取血,分離血清,檢測體液免疫指標。動物在最后一次免疫后2周處死,無菌分離脾臟淋巴細胞檢測細胞免疫指標。
1.5 ELISA法檢測血清特異性抗體
HspX蛋白 100μL/孔(5μg/m L)包被酶標板,4℃過夜。1%牛血清白蛋白封閉30 m in,PBST溶液300μL/well洗板5次×3 m in/次。用PBST溶液1∶500稀釋血清樣品后,100μL/well加入酶標板,37℃孵育1 h。再次洗板后,加入100μL/well的1∶1000稀釋的辣根過氧化物酶(HRP)標記的兔抗鼠IgG,然后加入100μL/well TMB顯色液,室溫避光反應15 min顯色后,加入50μL/well終止液(2 mol/L H2SO4)終止反應,450 nm處檢測吸光度(A)值。
1.6 特異性IFN-γ和IL-2的誘導和測定
用含10%FCS的RPMI 1640培養基調整細胞濃度為5×106/m L,800μL/well加入24孔細胞培養板中,同時每孔加入80μL HspX蛋白,置5%CO2孵箱中37℃培養72 h后,收集培養液,5000 rpm離心5 m in,取上清液,-20℃凍存備檢。IFN-γ和IL-2含量的檢測用ELISA方法,以IFN-γ和IL-2的標準品作標準曲線計算二者的含量。
1.7 EL ISPOT法檢測免疫小鼠脾細胞分泌IFN-γ細胞數
IFN-γ的水平與結核病的保護性免疫反應相關,應用ELISPOT方法檢測免疫小鼠脾臟淋巴細胞針對特異性抗原分泌IFN-γ的能力。小鼠最后一次免疫2周后無菌分離脾臟,應用ELISPOT技術檢測脾細胞受到 HspX蛋白刺激后 IFN-γ的表達。ELISPOT板預先用 IFN-γ抗體包被過夜,無菌摘除脾臟,研磨后經200目尼龍網過濾,經淋巴細胞分離液分離淋巴細胞。將終濃度為5×106/m L的淋巴細胞100μL/well加入96孔ELISPOT板中,并分別給予HspX蛋白(10μg/m L)刺激,并設陰性對照,加培養基、不加刺激物;陽性對照,用 PMA(1 ng/ m L)刺激,共同孵育24 h后,按ELISPOT操作說明依次加入檢測抗體等試劑,洗板、顯色,計數斑點數。1.8 統計學處理
采用SPSS 13.0進行方差分析,將疫苗免疫組結果與生理鹽水組進行比較。P<0.05表示差異具有顯著性。
2 結果
2.1 質粒純度和含量的測定
抽提的質粒DNA在260 nm處與280 nm處的A值比值均在1.80以上,且經過0.8%的瓊脂糖凝膠電泳分析,并沒有發現RNA的污染。
2.2 免疫小鼠血清抗HspX-IgG的測定
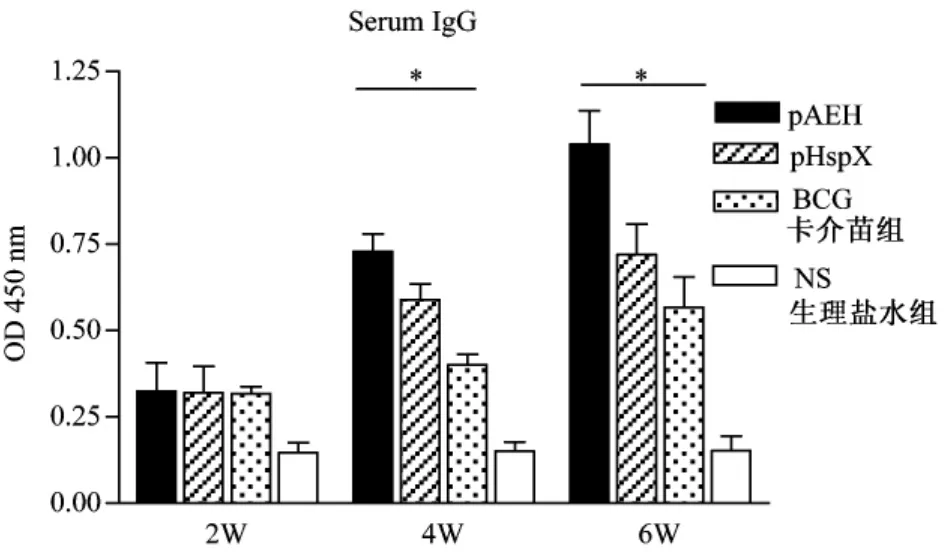
圖1 免疫小鼠體內誘導的特性性抗體水平(*P<0.05)Fig.1 Serological responses against special antigen in immunized mice(*indicates P<0.05)
用HspX抗原刺激后,ELISA法檢測總IgG抗體結果顯示(見圖1),隨著免疫時間的增加,免疫小鼠的抗體水平持續增加,DNA免疫小鼠在最后一次免疫后2周的抗體水平最高,融合基因組(即 pAEH組)免疫小鼠血清總IgG OD值均高于其他三組(P<0.05)。同時,單純 HspX質粒 DNA免疫組(即pHspX組)與BCG組或生理鹽水組相比,也產生了較高水平的IgG(P<0.05),表明潛伏期抗原能誘導較強的體液免疫反應。
2.3 免疫小鼠脾淋巴細胞特異性 IFN-γ的分泌水平
BCG及各 DNA疫苗免疫組小鼠脾淋巴細胞在體外經過 HspX抗原刺激后,可以引起特異性IFN-γ的分泌,但NS組小鼠IFN-γ分泌不明顯(圖2)。融合基因組與 BCG組、pHspX免疫組比較,差異有顯著性(P<0.05),表明 pcDNA-Ag85BEsat6-HspX免疫小鼠后產生特異性的 IFN-γ水平最高。

圖2 免疫小鼠脾淋巴細胞誘生的IFN-γ水平 (* P<0.05)Fig.2 The level of IFN-γinduced in splenolymphocytes of the immunized m ice.(* indicates P<0.05)
2.4 免疫小鼠脾淋巴細胞特異性IL-2的分泌水平
融合基因免疫小鼠后脾淋巴細胞所誘生的IL-2含量也最高,為84.63±8.76 pg/m L,高于 BCG組的 37.65±2.72 pg/m L(P<0.05)和 pHspX免疫組的42.42 ±3.61pg/m L(P<0.05)(圖3)。
2.5 ELISPOT檢測結果
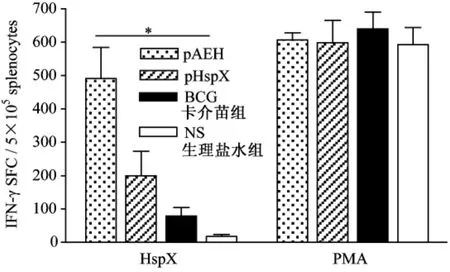
融合基因組經 HspX抗原(10μg/m L)體外刺激后分泌IFN-γ顯著升高,與pHspX組或BCG組比較,差異有顯著性(P<0.05);同時,pHspX組經HspX抗原(10μg/mL)體外刺激后分泌IFN-γ也明顯升高,與 NS組比較差異有顯著性(P<0.05)。陽性對照組(PMA刺激)分泌IFN-γ的細胞數目和水平均較高且一致,陰性對照組(不刺激)僅見極少量的IFN-γ分泌(圖4)。
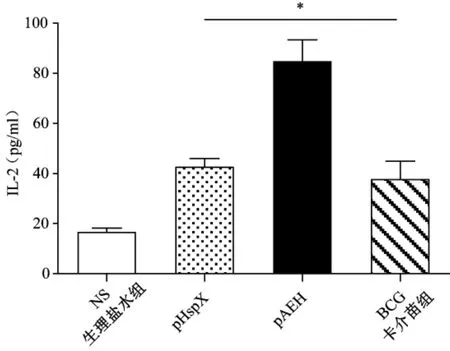
圖3 免疫小鼠脾淋巴細胞誘生的IL-2水平(* P<0.05)Fig.3 The level of IL-2 induced in splenolymphocytesof the immunized mice.(* indicates P<0.05)
3 討論
DNA疫苗是20世紀90年代發展起來的一種新型疫苗。DNA疫苗不僅可引起體液免疫反應,而且能誘導高水平的細胞免疫應答,尤其是細胞毒T淋巴細胞(CTL)反應,被認為在病毒、細菌、寄生蟲等病原體感染的防治中具有更大的優勢。DNA疫苗僅由DNA(如質粒)或RNA(如mRNA)組成,疫苗抗原的編碼基因插入適當的真核細胞質粒DNA的始動子及終止密碼之間,它可在細菌體內復制,而不能在人類宿主細胞內復制。此質粒可由大腸桿菌培養中純化而得到。DNA被肌肉細胞攝取進入細胞核內,在此抗原基因被轉錄,mRNA被轉運至細胞質內并被翻譯為蛋白質,表達特定的抗原,導致免疫反應的產生。
編碼單一結核分枝桿菌抗原的DNA疫苗的保護效應一般都不及BCG,提高DNA疫苗效應的方法除繼續篩選更為有效的保護性抗原以外,還包括多種單一抗原成分的DNA疫苗的聯合免疫,與分子佐劑如細胞因子、共刺激分子等聯合使用以及改進免疫接種方式、途徑和程序等。Ag85B和Esat6都是結核分枝桿菌的早期培養液分泌蛋白中具有較強免疫保護作用的抗原成分之一,分別含有多個不同T細胞的表位,能誘導機體產生保護性細胞免疫。
抗原85復合體是一組具有較強細胞免疫及體液免疫活性的分枝桿菌分泌性蛋白[3]。最早在結核桿菌和BCG的生長期早期培養濾液中發現,在菌體表面也有少量分布。經SDS-PAGE和等電聚焦分析可分為3個組分即Ag85A、B、C,大小分別為31、30、30.5(×103),由3個不同的基因編碼。其中有免疫作用的主要為Ag85A和B,Ag85A比Ag85B分泌得多,而 Ag85B在細菌表面分布較多。范雄林等[4]在小鼠模型上將不同結核保護性抗原的 DNA疫苗進行了免疫原性及保護效力的比較,發現Ag85B是比較理想的候選抗原。另外,在感染結核或麻風菌與卡介苗免疫的小鼠及人體上,Ag85復合體不僅可以刺激產生體液免疫,而且可激發較強Th1型細胞免疫,引起CD8+T細胞增殖和IL-2、GMCSF及IFN-γ等細胞因子水平的上升。
EAST6即6KD早期分泌性抗原性蛋白,是從結核桿菌短期培養濾液(ST-CF)中純化分離出的一種低分子量的分泌性蛋白,具有較強的細胞免疫活性。EAST6僅存在于結核桿菌群及少數幾種致病性分枝桿菌中,在90%以上的非致病性分枝桿菌中缺乏編碼該蛋白的基因(除勘薩斯分枝桿菌、海水分枝桿菌和蘇加分枝桿菌外),而且在所有BCG中也均缺乏。ESAT6是免疫記憶效應性 T細胞的主要靶抗原之一,可在再次感染的早期,誘導其迅速增值和釋放高水平的 IFN-γ,有效的激活巨噬細胞來控制結核病感染[5]。王清民等[6]對融合泛素的Esat6核酸疫苗進行了研究,發現該 DNA疫苗不僅增強了細胞免疫反應,而且對結核感染提供了很好保護。
隨著人們對潛伏感染的認識,休眠期結核桿菌開始受到重視。休眠期結核桿菌為了適應缺氧等惡劣生存環境部分基因表達上調。Leyten EM等[7]用25種 DosR Regulon編碼的休眠期抗原進行實驗,發現與結核病人相比,健康的結核菌素實驗陽性者外周血單個核細(PBMC)能識別更多的休眠期抗原,并產生更強烈的IFN-γ反應。HspX抗原可以被致敏的T細胞識別,刺激T細胞分泌IFN-γ,具有細胞免疫和體液免疫原性。
機體抗TB免疫主要依賴于T細胞及一些相關細胞因子的協助。對MTB的細胞胞免疫應答是以T細胞為介導、以巨噬細胞為效應細胞的免疫反應。有效的抗MTB免疫反應包括巨噬細胞吞噬MTB以及處理與遞呈抗原,T淋巴細胞對抗原的特異性識別與結合以及因受刺激而增殖與分化、細胞因子釋放、巨噬細胞激活和殺菌等步驟。IL-2通過T淋巴細胞增長因子和激活巨噬細胞釋放 IFN-γ消滅MTB,而IFN-γ在機體的抗MTB感染中發揮著重要作用,它可激活單核細胞和巨噬細胞,使其發揮殺菌作用。IFN-γ主要由TB患者體內的 CD4+T細胞、CD8+T細胞及NK細胞產生[8]。
本研究將休眠期抗原與生長早期抗原聯合使用,成功構建了能夠在真核細胞表達融合蛋白的重組質粒,并將該重組質粒肌肉注射于小鼠,進行免疫學評價。一方面,經過特異性抗原的刺激后,隨著免疫時間的延長,免疫小鼠的總IgG抗體水平持續增加,并于最后一次免疫后2周達到高峰。并且在第4周和第6周時,DNA疫苗免疫組OD值均高于BCG組,表明融合基因能夠誘導較強烈的體液免疫反應并能保持良好的持久性;另一方面,融合基因免疫小鼠后脾淋巴細胞誘生的 IFN-γ和 IL-2產量也均高于BCG免疫小鼠,表明該融合基因可誘導小鼠產生強烈的細胞免疫應答。同時,誘導T細胞釋放IFN-γ的能力通常被用來作為評價候選疫苗是否誘導Th1型細胞免疫反應的關鍵指標。本研究中ELISPOT檢測結果表明,應用 HspX抗原體外刺激后,融合基因組小鼠脾淋巴細胞分泌 IFN-γ的水平最高,說明該融合基因誘導機體產生了較強的細胞免疫反應。
總之,Th1型的細胞免疫應答對控制MTB的感染起著重要的作用,而且IFN-γ和IL-2都是重要的Th1型細胞因子,并已被證明在抗MTB的治療中具有一定作用[9]。本研究構建的 Ag85B-Esat6-HspX融合基因疫苗,目的就是希望其誘導的免疫向著有利于控制MTB感染的Th1型的應答方向發展,同時也為今后該疫苗的效力學評價提供一些理論和實驗依據。
[1]Gandhi NR,Shah NS,Andrews JR,Vella V,Moll AP,Scott M,Weissman D,Marra C,Lalloo UG,Friedland GH.HIV coinfection in multidrug-and extensively drug-resistant tuberculosis results in high early mortality[J].Am JRespir Crit Care Med,2010,181:80-86.
[2]Hu Y,Movahcdzadeh F,Stoker NG,et al.Deletion of the Mycobacterium tuberculosis alpha-crystallin-like HspX gene causes increased bacterial growth in vivo[J].Infec Immun,2006,74(2):861-868.
[3]Orme IM.Current progress in tuberculosis vaccine development[J].Vaccine,2005,23(17-18):2105-2108.
[4]Xionglin Fan, Qian Gao, Ruiling Fu. Differential immunogenicity and protective efficacy of DNA vaccines expressing proteins of Mycobacterium tuberculosis in a mouse model[J].Microbiol Res,2009,164:374-382.
[5]Olsen,A.W.,A.W illianms,L.M.Okkels,G,et al.Protective effect of a tuberculosis subunit vaccine based on a fusion of antigen 85B and Esat6 in the aerosol guinea pig model[J].Infect Immun,2004,72:6148-6150.
[6]Qingmin Wang,Lin Kang,Xiaohua Wang.Improved cellular response elicited by a ubiquitin-fused Esat6 DNA vaccine against Mycobacterium tuberculosis[J].Microbiol Immunol,2009,53: 384-390.
[7]Leyten EM.Human T-cell responses to 25 novel antigens encoded by genes of the dormancy regulon of Mycobacterium tuberculosis[J].Micorbes infect,2006,8:2052-2060.
[8]Das G,Sheridan S,Janeway CA.The source of early IFN-γthat p lays a role in Th1 priming[J].J.Immunol,2001,167(4): 2004-2010.
[9]LimeiWang,Yinlan Bai,Changhong Shi,et al.Immunogenicity and protective efficacy of a DNA vaccine encoding the fusion protein ofmycobacterium heat shock protein 65 with interleukin-2 against Mycobacterium tuberculosis in BALB/c mice[J].APMIS,2008,116:1071-1081.

