氟代次甲基與氧氣的反應機理研究
孫少學,魯云洲,石從云,周玉雯
(武漢科技大學 化學工程與技術學院,湖北 武漢 430081)
焚燒是處理鹵代烴類廢料的有效方法[1-2].焚燒時的高溫會使鹵代烴分解,產生大量的鹵代烴自由基.另外釋放或逸散到大氣中的鹵代烴,在太陽光紫外線的作用下也會分解為鹵代烴自由基.產生的這些自由基會與大氣中的許多物種起反應,研究這些反應對燃燒化學和環境保護都有著重要的意義.
氟代次甲基(CF)是一種典型的鹵代烴自由基,當其釋放到大氣中時,極容易與大氣中的活潑氣體O2反應.Peeters[3]等人已測定了CF與O2反應的速率常數為(1.6 ± 0.2) × 10-12cm3·mol-1·s-1,并且他們猜測4個產物通道,分別為FCO + O、CO + FO、CO + F + O和F + CO2.
但到目前為止,這些反應通道尚未從理論和實驗上得以確證.文中從理論上研究了CF與O2反應的微觀機理,確認了F + CO2、FCO + O和FO + CO等產物通道,并且與CH + O2反應的機理作比較,試圖找出F原子取代對次甲基與氧氣反應機理的影響規律.
1 計算方法
本次研究的全部計算工作均由Gaussian 03程序B.05版完成.采用密度泛函理論(DFT),在B3LYP / 6-311G(d,p)水平上對各反應通道上的所有駐點,包括反應物R、過渡態TS、中間體IM和產物P的幾何結構進行了優化.同時,我們在相同水平上采用內稟反應坐標(IRC)計算方法確認了過渡態和中間體之間的關系.為了得到更精確的能量,我們又采用QCISD的計算方法對在UB3LYP / 6-311G(d,p)水平上優化得到的各駐點幾何結構進行了單點能計算.
2 結果與討論
通過計算我們得到了該反應的三個產物通道,它們的反應路徑如下:
路徑(1):CF + O2→ TSR/1 → IM1 → TS1/2 → IM2 → TS2/3 → IM3 → TS3/P1→ P1(F +CO2),
ΔH =-132.1 kcal·mol-1;
路徑(2):CF + O2→ TSR/1 → IM1 → TS1/2 → IM2 → TS2/4 → IM4 → TS4/P2→ P2(FCO + O),
ΔH=-45.6 kcal·mol-1;
路徑(3):CF + O2→ TSR/1 → IM1 → TS1/2 → IM2 → TS2/3 → IM3→ TS3/5 → IM5→TS5/6→ IM6→ TS6/P3→ P3(CO + FO),ΔH=-57.6 kcal·mol-1.
優化得到的各駐點的結構見圖1.反應路徑的能級示意圖見圖2.對各個駐點進行的振動分析表明,反應物、中間體和產物的力常數矩陣本征值都為正,因此它們都是勢能面上的穩定點.而過渡態有且僅有一個虛頻,TSR/1、TS1/2、TS2/3、TS2/4、TS3/5、TS5/6、TS3/P1、 TS4/P2和TS6/P3的虛頻值分別為:217 i·cm-1、1 006 i·cm-1、1 747 i·cm-1、322 i·cm-1、113 i·cm-1、293 i·cm-1、557 i·cm-1、588 i·cm-1和846 i·cm-1.由過渡態理論可知這些過渡態都是真實的.內稟反應坐標(IRC)計算所得到的結果確認了能級示意圖里的各反應路徑的正確性.
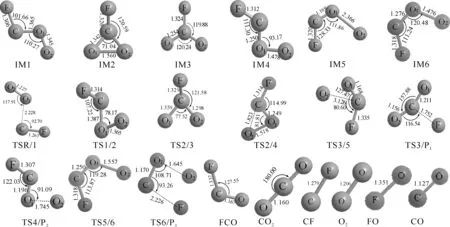
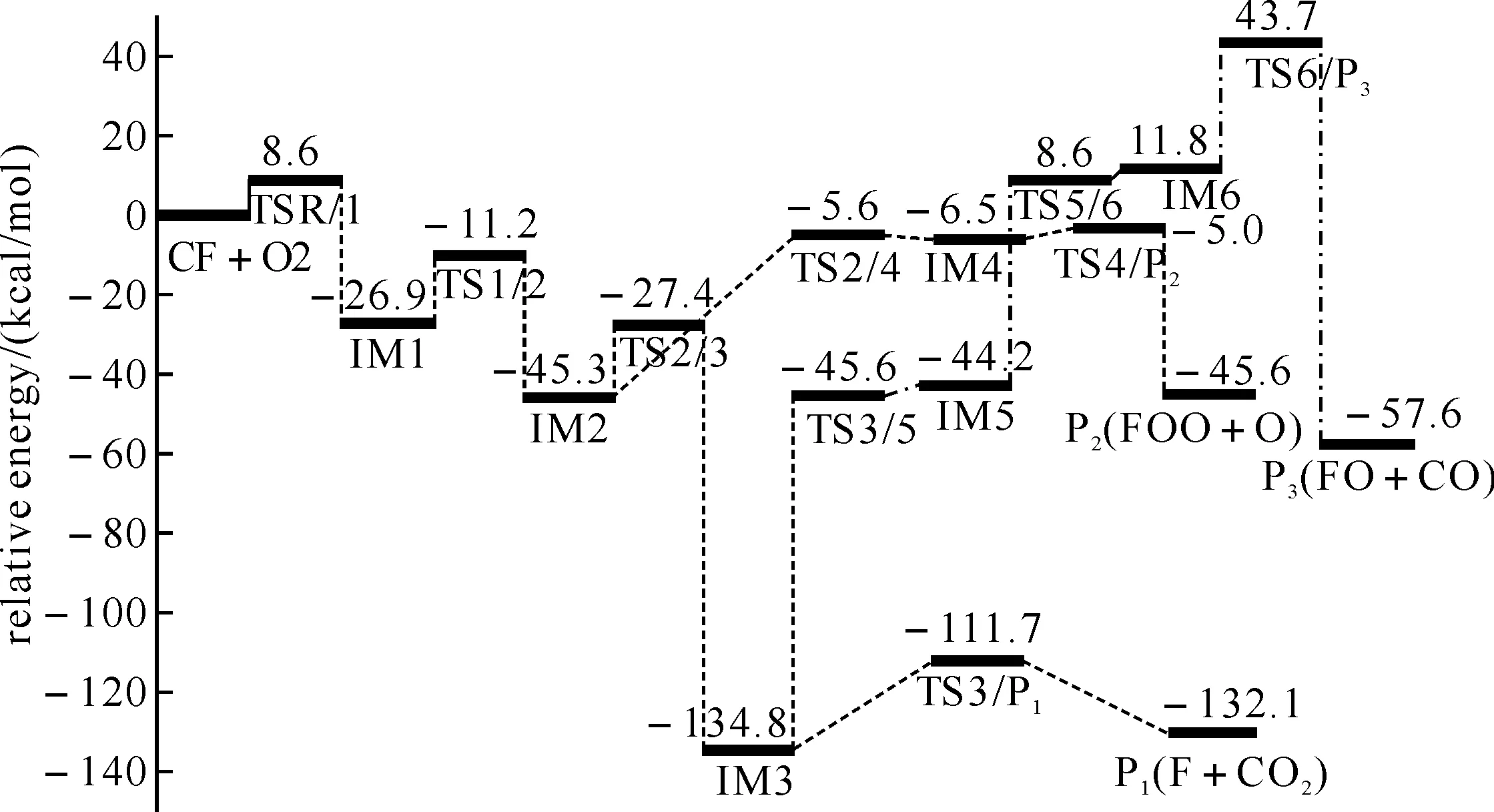
圖2 CF + O2反應在QCISD / 6-311G(d,p) // B3LYP / 6-311G(d,p)水平上的能級示意圖(包含零點能校正值)

理論計算得到的反應物、中間體和產物的振動頻率以及可得到的實驗值都列于表1.在QCISD // UB3LYP / 6-311G(d,p)水平上計算出的所有駐點的總能量和相對能量及可獲得的實驗值都列于表 2.其中相對能量是以反應物的能量為零,其它各駐點的能量值皆以反應物為基準.零點能校正值(ZPE)包含在單點能內.符號TSm/n表示連接中間體IMm與IMn的過渡態.通過比較我們發現實驗值和理論值基本一致,所以可以認為計算結果是可信的.
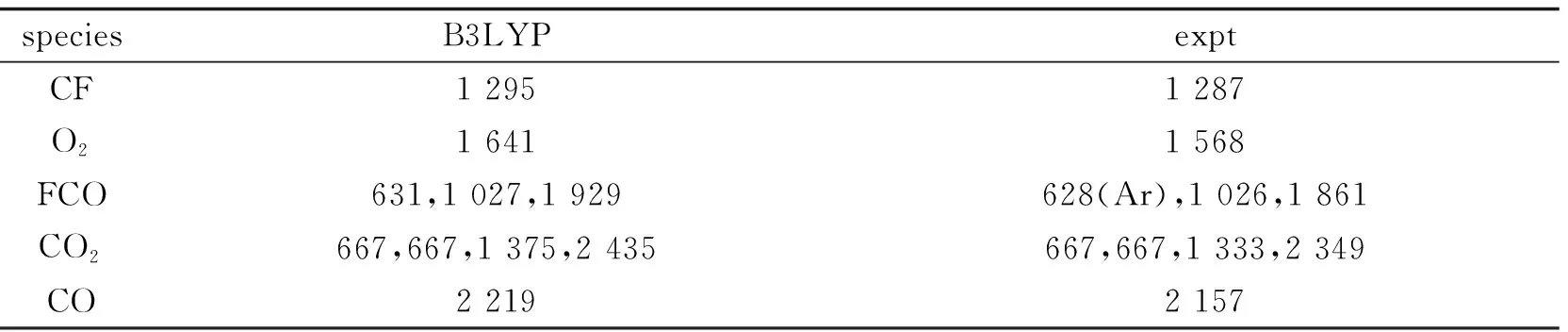
表1 CF + O2反應的反應物、中間體和產物在UB3LYP / 6-311G(d,p)
續表1
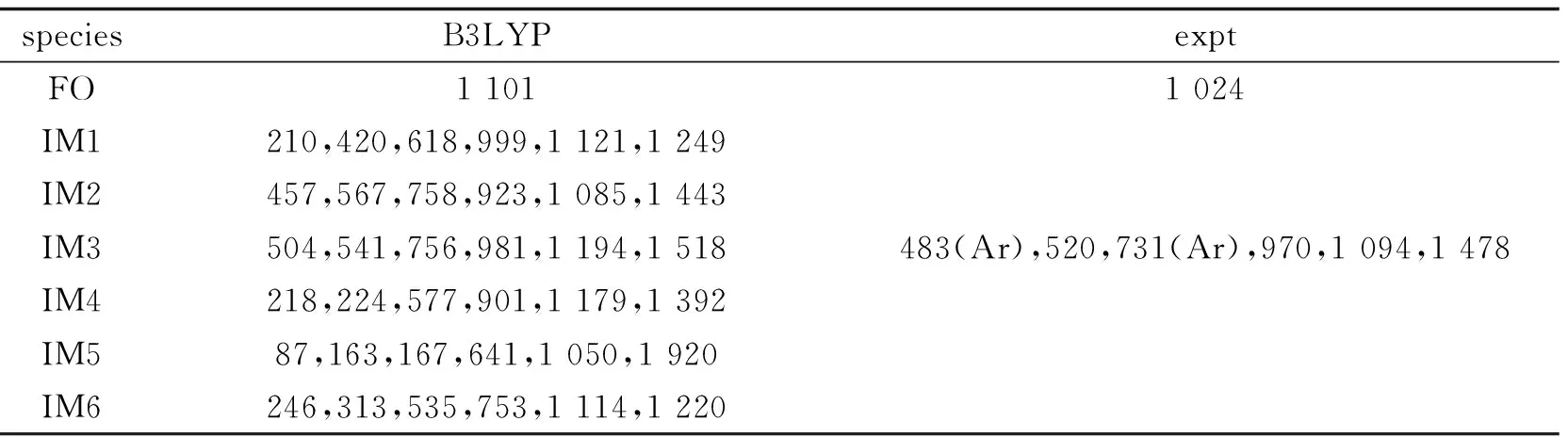
speciesB3LYPexptFO1 1011 024IM1210,420,618,999,1 121,1 249IM2457,567,758,923,1 085,1 443IM3504,541,756,981,1 194,1 518483(Ar),520,731(Ar),970,1 094,1 478IM4218,224,577,901,1 179,1 392IM587,163,167,641,1 050,1 920IM6246,313,535,753,1 114,1 220
實驗值后加有(Ar)標志的表示該值是在氬氣氣氛中測得的.
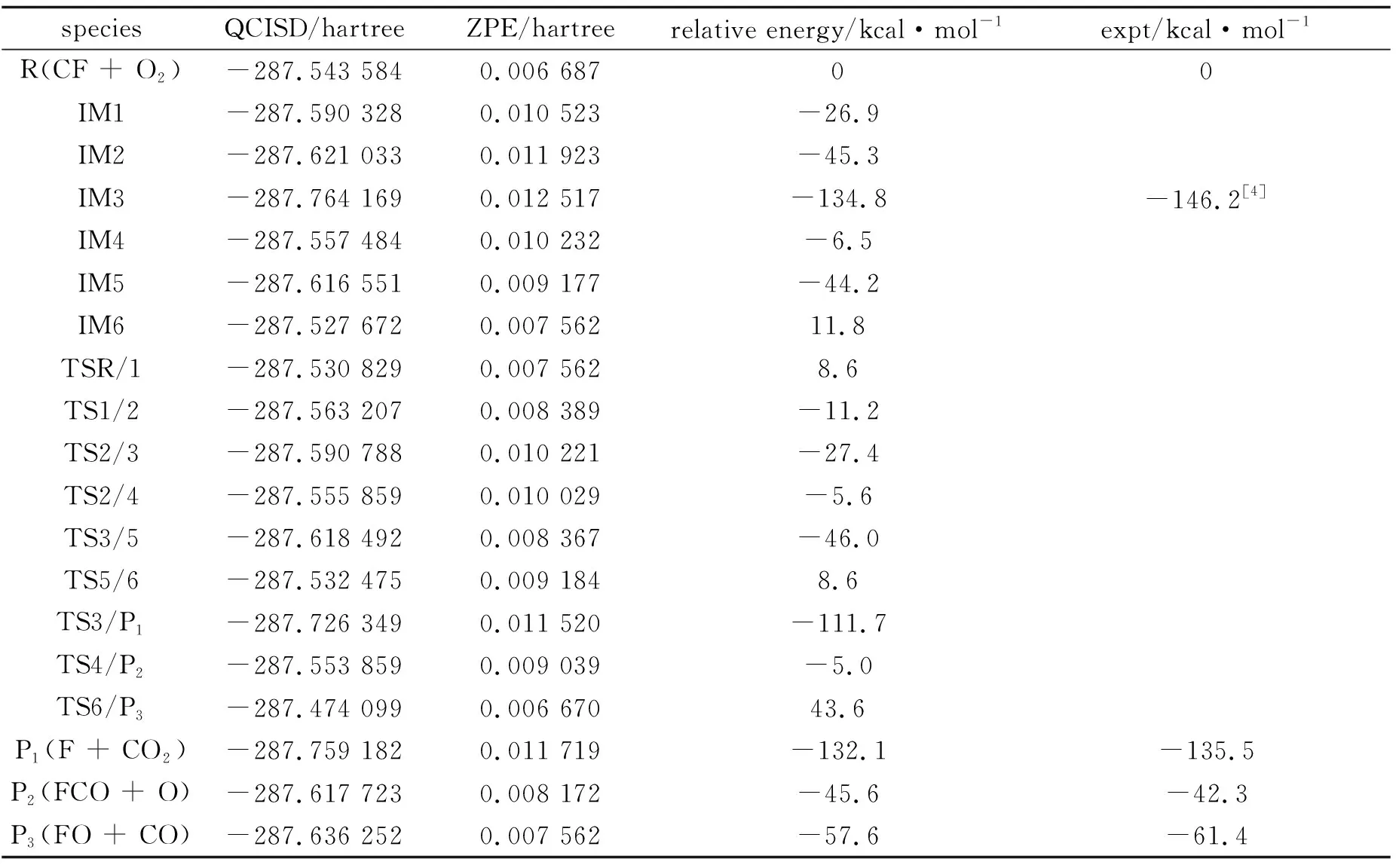
表2 CF + O2反應的反應物、中間體、過渡態和產物在QCISD / 6-311G(d,p) //
IM3的生成熱由文獻[4]提供.
2.1 CF與O2的反應機理首先CF自由基的碳原子進攻氧氣分子中的一個氧原子(標記為O1),形成鏈狀過氧化物FCOO(Cs,IM1).此步反應不是無勢壘過程,需越過一個過渡態(F-TSR/1).在過渡態F-TSR/1中,C—O1的距離為2.228×10-1nm.過渡態虛頻(217 i·cm-1)的振動模式對應的是C—O1鍵的伸縮振動.在過氧化物FCOO的形成過程中,由于CF與O2的相互影響,O1—O2鍵有所增長.
接著,IM1中的末端氧原子O2與C原子的距離縮短,并與之成鍵,形成一個含C—O—O三元環的過氧化物IM2.IM2為非平面結構,具有C2v對稱性.
從中間體IM2出發有兩種裂解方式,一是O1—O2斷裂,二是C—O2(或C—O1)鍵斷裂.當O1—O2斷裂時,非平面C2v對稱的IM2轉變成具有平面C2v對稱結構的IM3.同時C—O1鍵由1.342×10-1nm縮短為1.234×10-1nm, O1CO2鍵角由71.04°增至120.24°.IM2的另一種裂解方式是C—O2(或C—O1)鍵斷裂,轉化為中間體IM4.在此過程中,C—O1和O1—O2鍵有所縮短,CO1O2鍵角由IM2的54.48°經TS2/4的81.81°增大到IM4的93.17°.IM4 也是一個鏈狀過氧化物,與IM1相似,但IM4中CO1O2的夾角比IM1的角度(110.27°)小,且C—O1鍵(1.250×10-1nm)比IM1的(1.365×10-1nm)短,而O1—O2鍵(1.478×10-1nm)比IM1的(1.345×10-1nm)長.
平面中間體IM3中的C—F鍵發生斷裂,可生成產物P1(F + CO2).生成產物P1(F + CO2)的反應路徑可以描述成:
路徑(1):CF+O2→TSR/1→IM1→TS1/2→IM2→TS2/3→IM3→TS3/P1→P1(F+CO2).
IM4中的O—O鍵發生斷裂可生成產物P2(FCO+O).這條反應路徑可以描述成:
路徑(2):CF+O2→TSR/1→IM1→TS1/2→IM2→TS2/4→IM4→TS4/P2→P2(FCO+O).
從反應勢能面示意圖可以看出,反應還有可能生成產物P3(CO + FO).該路徑為:
路徑(3):CF+O2→TSR/1→IM1→TS1/2→IM2→TS2/3→IM3→TS3/5→IM5→TS5/6→IM6→TS6/P3→P3(CO+FO),即IM3中處在C—F鍵兩側的兩個氧原子中的一個向另一側轉移,生成中間體IM5,然后該原子向另一氧原子靠攏,生成中間體IM6,最后O—O鍵和C—F鍵斷裂,且同時生成F—O新鍵,得到產物P3(CO+FO).
2.2從能量角度對CF與O2反應機理的研究圖2為反應路徑的能級示意圖,其中標注的數值即為反應路徑上各駐點的相對能量.由圖可以看出CF與O2反應首先需要克服8.6 kcal·mol-1的能壘,經過渡態TSR/1才能形成第一個絡合物FCOO(IM1).這也表明該反應只有在高溫過程中重要.
在反應勢能面上,路徑(3)上的過渡態TS6/P3的能量遠遠高于反應物能量,因而該路徑可能很難發生,而通向產物P1(F+CO2)和P2(FCO+O)的路徑上各駐點(除TSR/1外)能量都低于反應物,因而比較容易發生.
由圖2可知,中間體IM1異構化為IM2后,分別沿著不同的路徑生成產物P1(F+CO2)和產物P2(FCO+O).生成F+CO2的路徑為IM2→TS2/3→IM3→TS3/P2→P1(F+CO2),生成產物P2(FCO+O)的路徑的為IM2→TS2/4→IM4→TS4/P2→P2(FCO+O).前者中各駐點的能量都低于后者,因此前者較后者易發生,生成的產物P1(F+CO2)較P2(FCO+O)多,F+CO2是最有競爭力的通道.
2.3 CF+O2反應與CH+O2反應的比較為了尋找鹵原子取代對次甲基與氧氣反應的影響規律,我們有必要把CF+O2反應與CH+O2反應作一比較.
黃明寶研究小組[5]在相同的計算水平上研究了CH+O2反應的H+CO2和HO+CO兩個通道的反應勢能面,而對可能存在的HCO+O通道未作研究.Okada和Bergeat[6-7]等人雖然對HCO+O都作了研究,但他們報道的研究結果有很大的不同,前者認為HCOO中間體的O—O鍵裂解過程存在有一個過渡態,但他們沒有給出過渡態的結構,后者認為HCOO的裂解過程無需越過任何勢壘.在此我們對這條通道作了研究,發現鏈狀中間體HCOO(被黃明寶[5]研究小組指定為IM1)在二重態勢能面上的O—O鍵斷裂過程的確有過渡態的存在,不過勢壘很小僅為0.001 3 kcal·mol-1.與其它的兩個通道勢能面作比較我們不難發現,HCO+O通道是CH+O2反應的主要產物通道.
2.3.1 CF+O2反應與CH+O2反應的相似之處 兩者都存在有XCO+O、X+CO2和XO+CO(X=H或F)通道.反應的第一步都是CX中的碳原子進攻氧氣分子中的一個氧原子形成鏈狀過氧化物XCOO,而且生成X+CO2的過程也非常相似,即鏈狀過氧化物XCOO異構化變為一個具有C—O—O三元環的非平面C2v對稱的中間體XCO2后,緊接著轉變為平面C2v對稱的中間體XCO2,然后C-X鍵斷裂生成產物X+CO2.
2.3.2 CF+O2反應與CH+O2反應的不同之處 首先,CF+O2與CH+O2反應的難易程度不同.這從第一步可以看出,CF+O2反應的第一步(CF+O2→TSR/1→IM1)需要克服8.6 kcal·mol-1的能壘,而CH+O2反應的第一步(CH+O2→IM1)是一個無勢壘過程.顯然后者較易發生,反應速率快.這一點也從實驗上得到了證實:實驗測得CH+O2反應的速率常數為(2.3~5.9)×10-11cm3· mol-1·s-1[6-12],而CF+O2反應的速率常數為(1.6±0.2)×10-12cm3·mol-1·s-1[3].這可能是由于F原子的半徑比H原子的半徑大,造成CF自由基與O2分子進攻較為困難的緣故.其次,XCO+O的形成路徑不同.在CH+O2反應中,初始絡合物HCOO生成后,隨即發生O—O鍵斷裂就可生成HCO+O;而在CF+O2反應中,第一個中間體FCOO形成后,須經多步的異構化過程,然后發生O—O鍵斷裂才可生成.另外,XO+CO的生成路徑也不同,在CH+O2反應中,形成的平面型中間體HCO2能發生1,2-H遷移,生成中間體HOCO,然后C—O鍵斷裂生成HO+CO;在CF+O2反應中,平面中間體FCO2形成后,經過O原子遷移等一系列復雜過程才生成FO+CO.在FO+CO形成過程中需越過能量很高的過渡態,因而生成該產物的可能性很小,而在HO+CO過程中無需越過高能量的過渡態,生成它的可能性大.兩反應的差異還表現在主要通道不同,在CH+O2反應中HCO+O為最主要的通道,在CF+O2反應中F+CO2為主要通道.
3 結論
通過量子化學計算研究,我們發現CF與O2反應首先是形成具有鏈狀結構的過氧化物FCOO.隨后FCOO經異構化和斷鍵,形成一系列的過渡態、中間體和產物.反應有3種產物通道,即F+CO2、FCO+O和FO+CO.F+CO2為最主要的通道.通過與CH+O2反應比較發現,兩反應的最大相似之處是第一步生成鏈狀過氧化物XCOO.X+CO2的生成路徑也很相似.兩者反應機理也有很大的不同,CF+O2的反應活性明顯低于CH+O2,在XCO+O和XO+CO通道的形成過程存在很大的不同.另外主要通道不同,HCO+O為CH+O2反應的主要通道,而F+CO2為CF+O2反應的主要通道.
參考文獻:
[1] Hou H,Wang B S,Gu Y S.Study on the reaction mechanism of between O(3P) and halogenated methyl radical[J].Sci China Ser B,1999,29(6):495-500.
[2] 侯華,王寶山,顧月姝.O(3p)與鹵代甲基反應的機理研究[J].中國科學:B輯,1999,29(6):495-500.
[3] Peeters J,Hoeymissen V J,Vanhaelemeersch S,et al.Absolute rate constant measurements of CF(X2П) reactions.1.reactions with O2,F2,Cl2and NO[J].J Phys Chem,1992,96:1257-1263.
[5] Huang M B,Chen B Z,Wang Z X.Theoretical study of CH + O2reactions [J].J Phys Chem A,2002,106:5490-5497.
[6] Okada S,Yamasaki K,Matsui H,et al.Studies on the reactions of CH(v= 0 and 1) with NO and O2[J].Bull Chem Soc,1993,66: 1004-1011.
[7] Bergeat A,Calvo T,Caralp F,et al.Determination of the CH + O2product channels[J].Faraday Discuss,2001,119:67-77.
[8] Anderson S M,Freedman A,Kolb C E.Fast-flow studies of CH radical kinetics at 290 K[J].J Phys Chem,1987,91:6272-6277.
[9] Becker K H,Engelhardt B,Wiesen P,et al.Rate constants for CH(X2Π) reactions at low total pressures[J].Chem Phys Lett,1989,154: 342-348.
[10] Mehlmann C,Frost M J,Heard D E,et al.Rate constants for removal of CH(D)(v=0 and 1) by collisions with N2,CO,O2,NO and NO2at 298 K and with CO2at 296 ≤ T/K ≤ 873[J].J Chem Soc Faraday Trans,1996,92(13): 2335-2341.
[11] Bocherel P,Herbert L B,Rowe B R,et al.Ultralow- temperature kinetics of CH(X2Π) reactions: rate coefficients for reactions with O2and NO( T = 13~708 K),and with NH3(T = 23~295 K)[J].J Phys Chem,1996,100:3063-3069.
[12] Taatjes C A.Kinetic isotope effect in the CH [2Π] +O2reaction[J].J Phys Chem,1996,100: 17840-17845.

