曙紅Y在牛血清白蛋白表面上的Langmuir吸附反應研究
彭毛,祁紅林,吳輝,盛立嬌,周建剛,宋功武
(湖北大學 化學化工學院,湖北 武漢 430062)
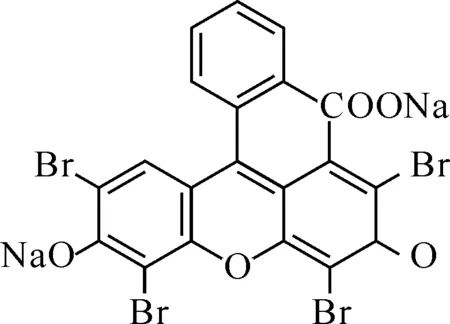
Scheme 1 EY的分子結構式
曙紅Y(Eosin Y,EY)是一種陰離子型光譜探針,主要以靜電作用力與蛋白質結合[1],已被廣泛應用于蛋白質[2]、殼聚糖[3]、藥物[4-5]及表面活性劑[6]的檢測,以及與生物大分子作用的機理研究[7]等.生物大分子擁有復雜的立體構象,折疊、螺旋、盤繞等使大分子產生大量的溝壑和空穴,同性電荷相互靠近形成很多微電場谷[8].由于電場的作用,帶有電荷的小分子探針被吸附到微相電場表面.EY分子在溶液中帶有負電荷,與帶正電荷物質存在靜電作用.本文中研究了EY與牛血清白蛋白(BSA)的結合作用,計算出了結合比,結合常數等,并進行了試驗條件討論,測定了蛋白質的工作曲線.EY的分子結構式,如Scheme 1所示:
1 實驗部分
1.1儀器與試劑UV 2300分光光度計(上海天美科學儀器有限公司);WH-3微型漩渦混合儀(上海滬西分析儀器廠有限公司);TB-85型恒溫水浴槽(Shimadzu);準確稱取一定量牛血清白蛋白(BSA)(武漢天源生物技術有限公司,66 000 g/mol),配制成2.12×10-5mol/L的水溶液,置于4 ℃下保存;曙紅Y(EY)(上海試劑三廠),儲備液濃度為1.01×10-3mol/L;試驗用水均為二次去離子水,其他無機鹽試劑未標明的均為分析純.
1.2實驗方法在25 mL 比色管中加入0.2 mL EY 溶液和一定量的BSA 溶液,稀釋至12.5 mL 刻度處,漩渦混勻,放置6 min 后用1 cm 比色皿測其在534、511 nm 處的吸光度,根據公式(1~7)計算各個參數,并繪制Langmuir等溫吸附曲線.
2 結果與討論
2.1基本原理蛋白質分子由于復雜的立體構象形成微弱靜電場[9],在其作用下,帶電荷的小分子以單分子層形式被吸附到微相電場表面.由于生化反應平衡方程與吸附劑在溶液中對吸附質分子的蛋分子層吸附一致,故使用Langmuir 單分子層等溫吸附理論解釋蛋白質分子與小分子間相互作用是可行的[10].
Langmuir等溫吸附方程為:
γ-1=N-1+(KNCL)-1
(1)
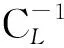
γ=η×CL0/CS
(2)
CL=(1-η)CL0
(3)
η=(AC-ΔA)/A0
(4)
AC=(ΔA-βΔA′)/(1-αβ)
(5)
η是L的有效反應率;CS是蛋白的初始濃度;CL0是染料的初始摩爾濃度.A0、ΔA分別是以水為參比試劑空白、以試劑空白為參比結合產物在結合產物最大吸收波長λ2下所測得的吸光度;AC是結合產物在λ2下經光譜修正后的實際吸光度;ΔA′是結合產物以試劑空白為參比在結合產物峰谷λ1下測得的吸光度;α、β為光譜校正常數,計算公式分別為:
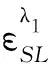
(6)
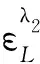
(7)
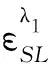
2.2吸收光譜分析EY溶液及其與BSA的反應溶液的吸收光譜圖如圖1所示.在400~600 nm 范圍內,EY在514 nm 處有一最大吸收峰,當加入BSA 后,最大吸收峰紅移至 527 nm 波長處,吸光度值降低.當以試劑空白為參比時,結合產物的吸收峰和谷吸收分別為 534 nm和511 nm,選此二波長為測定波長λ2、λ1.
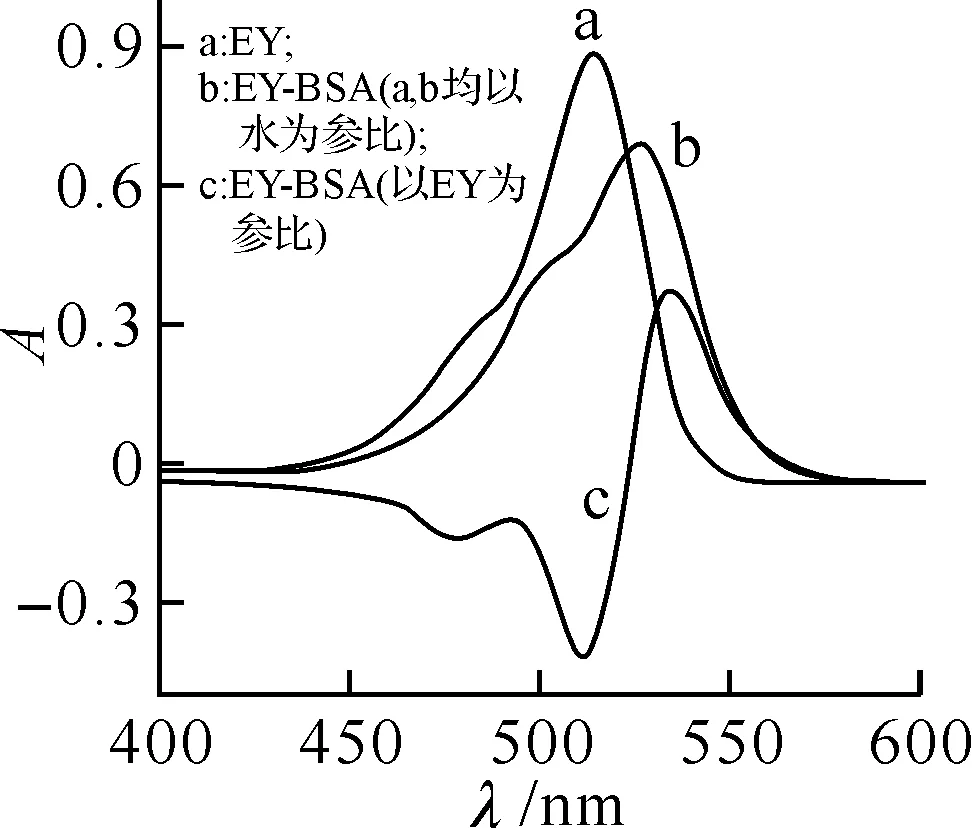
圖1 EY及EY-BSA結合產物的A值EY: 1.62×10-5 mol/L; BSA: 6.86×10-6 mol/L.
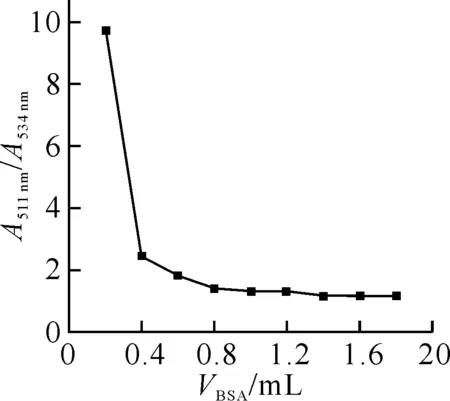
圖2 吸光度比值隨VBSA的變化曲線EY: 1.62×10-5 mol/L;BSA: 4.21×10-5 mol/L.
固定EY 的用量,向溶液中加入不同體積的BSA 溶液,以試劑空白為參比,計算其谷與峰處的吸光度比值,如圖2所示.當BSA 加入量(VBSA)大于1.4 mL 時接近最小并基本保持恒定,這表明蛋白用量超過1.4 mL 時溶液中已沒有游離的 EY,據此可以計算出α=0.634 4.以水為參比,由EY 溶液的吸收光譜中534 nm和511 nm 處的吸光度值,根據公式(7)計算出β=0.183 5.
2.3反應條件的研究
2.3.1 反應時間的影響 加入一定量的EY和BSA溶液后,在不同反應時間下測其吸收曲線,研究結合比γ隨時間的變化.結果顯示,EY與BSA的在室溫下(26 ℃)反應速度較快,在6 min 后體系基本達到穩定且在半小時內都能保持不變,因此選擇溶液放置 6 min 后進行測量.
2.3.2 離子強度的影響 加入不同量1.0 mol/L NaCl 溶液實驗離子強度的影響,反應液的離子強度的變化對EY-BSA結合物的結合比的影響結果如圖3所示.從圖中可看出,EY-BSA結合物的結合比γ隨離子強度的增加而降低.這是由于Na+、Cl-濃度高時,也能被蛋白質中的微電場所吸附,占據了部分微相表面,從而使EY 的吸附有所減少,結合比減小.
2.3.3 溫度的影響 在25~52 ℃ 溫度范圍內研究了EY-BSA結合反應的吸收隨溫度變化的情況,結果如圖4所示,可見,結合比隨溫度的升高而逐漸減小.這是由于溫度升高加快了吸附在蛋白質分子上的EY解離,造成溶液中游離態的EY濃度升高,結合比下降.這些現象符合固體表面單分子層吸附的一般規律,支持了生物大分子內微靜電場假設.
2.4結合常數的測定固定EY的用量,改變BSA(2.12×10-5mol/L)溶液的加入量.分別在30、45和60 ℃下,按實驗方法測定反應液在吸收峰(534 nm)和谷(511 nm)處的吸光度值,分別計算AC、η、CL、γ值等,繪制1/γ-1/CL曲線,如圖5所示.
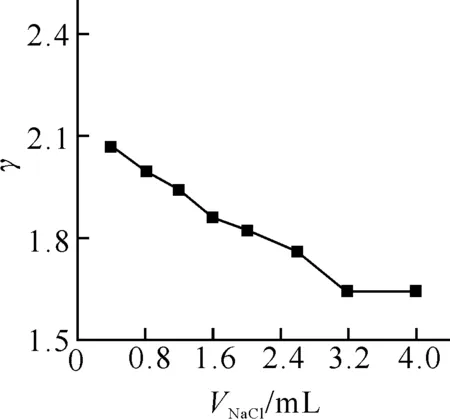
圖3 離子強度對EY-BSA體系的影響BSA: 3.19×10-6 mol/L; EY: 8.08×10-6 mol/L.
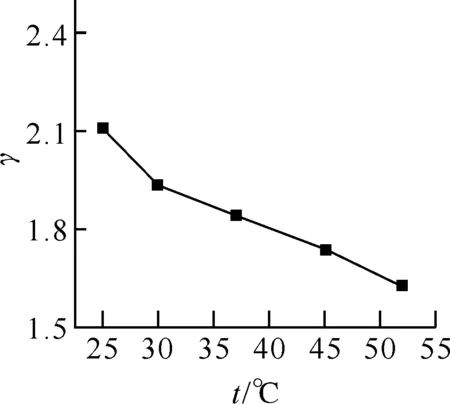
圖4 溫度對EY-BSA結合比的影響BSA: 3.19×10-6 mol/L;EY: 8.08×10-6 mol/L.
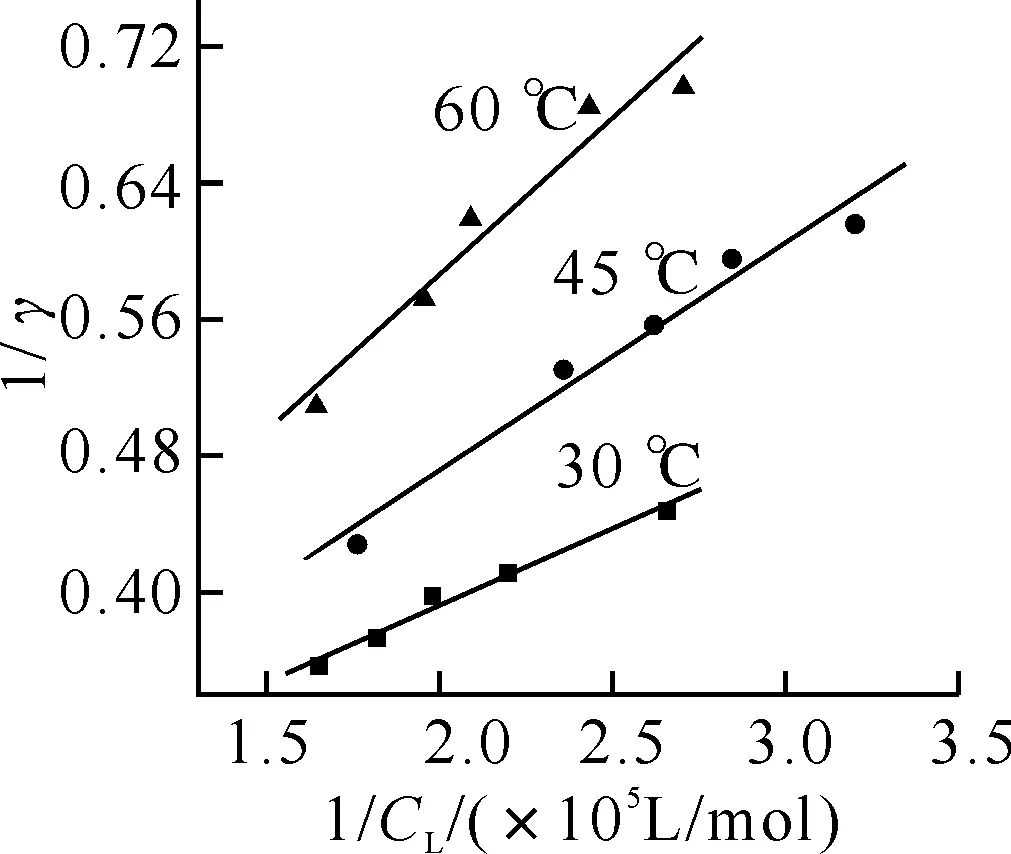
圖5 EY-BSA體系的1/γ - 1/CL 關系曲線圖BSA: 3.19×10-6 mol/L.
由圖可見,各曲線均有較好的線性關系,因此曙紅Y與BSA的結合符合Langmuir 單分子層吸附,即微相表面吸附.
根據直線的斜率和截距可分別求得各溫度下結合物的結合常數及最大結合數,見表1.可見,溫度的升高,EY的結合常數降低,這是由于溫度的升高,吸附在蛋白質表面上的EY分子的解離加速,從而導致結合常數減小.
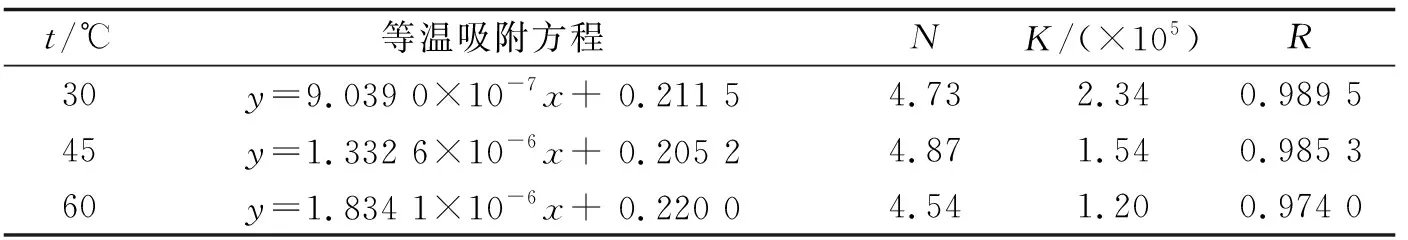
表1 EY-BSA體系在不同溫度下的結合常數
2.5蛋白質溶液的工作曲線配制系列牛血清白蛋白標準溶液,按實驗方法測量,計算AC值,測定蛋白質的工作曲線.結果表明,蛋白質在0~0.20 g/L濃度范圍內吸收是線性的:AC=1.494 9C+ 0.010 18(R=0.997 6),該方法的檢出限為 20 mg/L.
2.6金屬離子的干擾在相對誤差為±5%時,分別往一定量的結合反應體系中加入各種金屬離子,對3.19×10-6mol/L BSA溶液測定它們的干擾情況,結果列入表2中.由結果可知,這些物質的干擾較小,不影響直接測定.
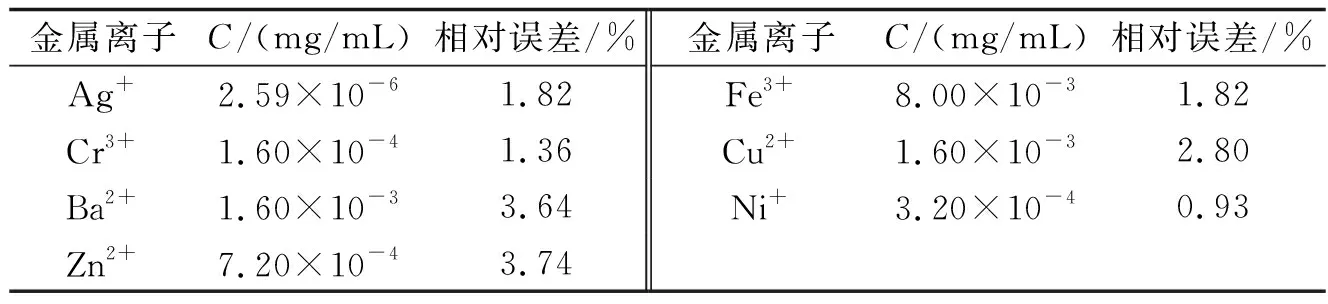
表2 金屬離子干擾情況
3 結論
本試驗探討了曙紅Y在蛋白質上的吸附聚集反應,由結果可知,溫度的升高,加快了吸附在BSA上的EY分子的解離,造成溶液本體EY濃度升高,這一現象符合固體表面單分子層吸附的一般規律.通過Langmiur單分子層等溫吸附理論研究,表明該過程符合Langmuir 等溫吸附,同時也支持了生物大分子內微靜電場假設.該方法原理簡單易懂,操作方便,結果可靠,對研究環境污染物在生物大分子上的聚集機理與毒性作用等有重要意義.
參考文獻:
[1] 楊昌英,劉義,朱軍成,等.光譜法研究吲哚美辛舒林酸及其金屬配合物與牛血清蛋白的相互作用[J].分析化學,2008,36(4):473-477.
[2] Waheed A A,Gupta P D.Estimation of submicrogram quantities of protein using the dye eosin Y[J].J Biochem Biophys Methods,2000,42(3):125-132.
[3] Du W L,Xu Z R,Han X Y,et al.Preparation,characterization and adsorption properties of chitosan nanoparticles for eosin Y as a model anionic dye[J].J Hazard Mater,2008,15(1-2):152-156.
[4] 趙小輝,牛衛芬.曙紅Y共振光散射法測定雙嘧達莫[J].應用化學,2008,25(6):693-696.
[5]El-Brashy A M,Metwally M E S,El-Sepai F A.Spectrophotometric determination of some fluoroquinolone antibacterials by binary complex formation with xanthene dyes[J].Il Farmaco,2004,5(10):809-817.
[6] Kovács-Hadady K,Fábián I.The determination of benzalkonium chloride in eye-drops by difference spectrophotometry[J].J Pharm Biomed Anal,1998,16(5):733-740.
[7] Gao D J,Tian Y,Liang F H,et al.Investigation on the pH-dependent binding of Eosin Y and bovine serum albumin by spectral methods[J].J Lumin,2007,127(2):515-522.
[8] Gao H W,Jiang J,Yu L Q.Study on spectrometric probe of protein solution with p-Iodochlorophosphonazo as adsorbate by MPASC technique[J].Analyst,2001,126(4):528-533.
[9] Gao H W,Xu W Q.Langmuir aggregation of Evans blue on cetyltrimethylammonium bromide and on proteins and its application Analytica[J].Chimica Acta,2002,458(2):417-424.
[10] 郜洪文,陳運生.探針體在蛋白質大分子上Langmuir吸附聚集及應用——蛋白質/熒光桃紅B(PB)結合反應研究[J].高等學校化學學報,2002,23(5):825-827.
[11] Gao H W.Dual-wavelength spectrophotometric determinations of copper and its composition of the complex with eriochrome blue black R[J].Recl Trav Chim Pays-Bas,1995,114(2):61-64.

