2009年北京市藥品注冊情況分析
陳旭 李錚 李慧芬 周宏 佟利家
近幾年來,藥品安全專項整治工作的開展,特別是自2007年10月開始的藥品研制現場核查工作日趨完善,使得藥品研發與注冊申報秩序逐步規范,2009年藥品注冊情況漸趨平穩。與此同時,繼《中藥注冊管理補充規定》《藥品注冊現場核查管理規定》和《新藥注冊特殊審批管理規定》之后,2009年正式頒布實施了《藥品技術轉讓注冊管理規定》,使得藥品注冊管理法規體系也趨于完善。現將全市2009年藥品注冊的基本情況及近幾年注冊的變化情況概述如下:
2009年藥品注冊申請情況與分析
2009年全年共受理藥品注冊申請203件,按藥品類別分為:中藥注冊申請19件,化學藥品注冊申請165件,生物制品19件;按注冊類別分為:新藥申請153件(占72.5%),仿制藥申請50件(占27.5%)。具體見附圖1。化學藥品主要以化學藥品3類為主,共101件(占化藥新藥申請的87%),與2008年的89件(占化藥新藥申請的76.1%)相比略有增加。中藥注冊申請均為新藥申請,主要以中藥6類為主,共12件(占中藥注冊申請的62%),與2008年基本持平。仿制藥申請共50件,除1件申請為生物制品外,其余均為化學藥品,2009年仍然延續了中藥仿制藥零申報的狀況(見附圖2、附圖3)。
近三年來,藥品注冊申請數量從2007年的251件到2008年的207件,再到2009年的203件,申請數量相對較平穩,特別是2009年注冊申請數量不僅與2008年持平,新藥和仿制藥比例也基本相同,可見新版注冊管理辦法的頒布,特別是開展了兩年多的藥品研制現場核查工作對規范藥品注冊申報發揮了良好的作用,藥品注冊情況出現了可喜變化:申報數量趨于合理、藥品研發水平和申報資料質量不斷提高,藥品注冊秩序顯現出平穩和諧發展的勢頭(見附圖4、附圖5、附圖6)。
展望2010年藥品再注冊工作
根據國家食品藥品監督管理局《關于印發藥品再注冊和批準文號清查工作方案的通知》的要求,經過核定,北京市共有藥品批準文號6000多個。2009年8月,國家食藥監管局下發了《關于做好藥品再注冊審查審批工作的通知》,明確了藥品再注冊的審查要點,全國藥品再注冊審查審批工作正式啟動。北京市藥品監督管理局2009年10月印發《關于開展藥品再注冊審查審批工作的通知》,召開了全市藥品再注冊工作會議,啟動了北京市藥品再注冊工作。按國家食藥監管局文件要求,到2010年9月30日止,所有批準證明文件到期的品種必須完成再注冊,未批準再注冊的品種將不能上市銷售。截至2009年12月31日,已接收271件再注冊申請,2010年9月30日前將完成近5800件已到期品種的再注冊審批工作。
2009年是藥品注冊工作平穩發展的一年,注冊管理法規體系趨于完善,藥品研制現場核查工作在保證申報資料真實性、準確性和完整性方面發揮了積極作用,遏制了藥品研制過程中的造假行為,藥品研制注冊秩序已大為好轉。展望2010年,隨著藥品注冊法規體系與技術評價體系的不斷完善,國家一系列鼓勵創新政策的出臺和新藥創新重大專項工作的啟動,新藥研發將呈現新局面,同時也對藥品注冊工作提出了新的更高的要求。

附圖1 2009年各類藥品注冊申請分布

附圖2 2009年中藥注冊申請類別分布

附圖3 2009年化藥注冊申請類別分布
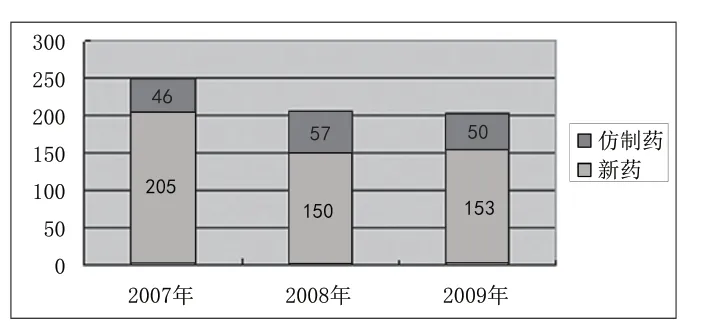
附圖4 2006年/2007年/2008年注冊申請數 量對比

附圖5 近三年中藥各類注冊申請數量對比
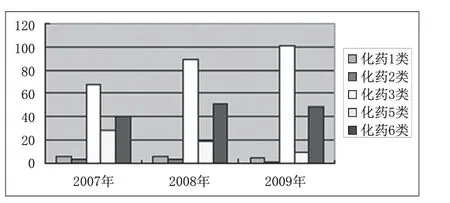
附圖6 近三年化藥各類注冊申請數量對比

