凝結芽孢桿菌發酵條件的優化
高書鋒,任 杰,張德元,陳 薇,許麗娟,魏小武
(湖南省微生物研究所,湖南 長沙 410009)
近年研究表明,益生菌可改善動物腸道菌群的平衡,增強動物機體免疫力,提高動物消化功能,促進動物生長發育和提高動物生產性能等益生作用,其作為綠色飼料添加劑取代抗生素已得到廣泛應用[1]。
凝結芽孢桿菌既產乳酸又產芽孢,具有一般乳酸菌維持腸道微生態平衡,刺激免疫,提高動物消化功能等益生作用,還具有芽孢菌抗胃酸、抗膽堿、抗熱和抗干燥等抗逆能力[2]。李國建[3]研究證實生長肥育豬飼料中添加凝結芽孢桿菌制劑可顯著提高豬的平均日增重,降低飼料成本;Adami and Cavazzoni[4]發現凝結芽孢桿菌對仔豬糞中的微生物區系有明顯的影響,且這種益生菌有利于改善動物的生產性能。凝結芽孢桿菌突出的飼喂功能和良好的加工性能,使其必將成為飼料添加劑行業中不可替代的重要成員。影響益生菌效果的因素有:菌種、活菌含量、使用階段、制劑的穩定性等,其中提高活菌數是發酵生產微生態制劑的關鍵技術,也是微生態制劑發揮生物學作用的重要因素[5]。筆者實驗室篩選出一株畜禽用益生菌,經鑒定為凝結芽孢桿菌,本研究以提高活菌數為目標,初步探討凝結芽孢桿菌搖瓶液體發酵條件,優化發酵工藝,為進一步的發酵罐生產提供依據。
1 材料與方法
1.1 材料
1.1.1 菌種凝結芽孢桿菌(Bacillus coagulans)菌種,由湖南省微生物研究所實驗室篩選保藏。
1.1.2 培養基 斜面培養基:蛋白胨10 g/L,酵母浸出物5 g/L,氯化鈉5 g/L,瓊脂20 g/L,pH=7.0~7.2;種子培養基:蛋白胨10 g/L,酵母浸出物5 g/L,氯化鈉5 g/L,pH=7.0~7.2;基礎發酵培養基:葡萄糖 10 g/L,蛋白胨 10 g/L,KH2PO41.0 g/L、MgSO4·7H2O 0.5 g/L,NaCl 5 g/L、蒸餾水 1 000 mL,pH 值7.0~7.2。
1.2 方法
1.2.1 菌液制備 (1)菌種活化:將凝結芽孢桿菌菌種活化后轉接到斜面培養基,35℃培養24 h,備用。(2)種子液制備:取3環活化菌種,接入裝有100 mL種子培養基的500 mL三角瓶中,35℃、220 r/min培養24 h。
1.2.2 活菌計數方法 活菌總數測定:采用梯度稀釋后,傾注平板菌落計數法。
1.2.3 培養條件優化 (1)培養溫度選擇 :按1%的接種量將種齡為24 h的凝結芽孢桿菌種子液分別轉接到裝液量為20%、pH=7.0的發酵培養基,分別置 30、35、40、45℃搖床發酵,轉速為 200 r/min,培養48 h,分別對發酵液活菌數進行測定,確定最佳發酵溫度。
(2)培養轉速選擇:按1%的接種量將種齡為24 h的凝結芽孢桿菌種子液分別轉接到裝液量為20%、pH=7.0 的發酵培養基,分別置 140、180、220、260 r/min搖床發酵,溫度35℃,發酵48 h,分別對發酵液活菌數進行測定,確定最佳發酵轉速。
(3)裝液量選擇:按1%的接種量將種齡為24 h的凝結芽孢桿菌種子液分別轉接到裝液量分別為5%、10%、15%、20%,初始pH=7.0的發酵培養基,置35℃、220 r/min搖床發酵,發酵48 h,分別對發酵液活菌數進行測定,確定最佳裝液量。
(4)接種量選擇:分別以1%、3%、5%、7%和10%的接種量將種齡為24 h的凝結芽孢桿菌種子液接入初始裝液量為10%、pH值為7.0的發酵培養基,置35℃、220 r/min搖床發酵,發酵48 h,分別對發酵液活菌數進行測定,確定最佳接種量。
(5)初始pH值選擇:分別以3%的接種量將種齡為24h的凝結芽孢桿菌種子液接入初始pH分別為 5.0、5.5、6.0、6.5、7.0、7.5、8.0 和 8.5,裝液量為10%的發酵培養基,置35℃、220 r/min搖床發酵,發酵48 h,分別對發酵液活菌數進行測定,確定最佳初始pH。
(6)發酵時間選擇:分別以3%的接種量將種齡為24h的凝結芽孢桿菌種子液接入初始pH為7.0、裝液量為10%的發酵培養基,置35℃、220 r/min 搖床發酵,發酵 18、24、30、36、42、48 h 后,分別對發酵液活菌數進行測定,確定最佳發酵時間。
1.2.4 培養基單因素篩選 (1)碳源篩選:以基礎發酵培養基中葡萄糖的碳含量計算碳濃度,將基礎發酵培養基中的碳源分別用其他碳源替換,接種量為3%,裝液量為10%,置35℃、220 r/min搖床發酵,發酵42 h,分別對發酵液活菌數進行測定,確定最佳碳源。
(2)氮源篩選:以基礎發酵培養基中蛋白胨的氮含量計算氮濃度,將基礎發酵培養基中的氮源分別用其他氮源替換,接種量為3%,裝液量為10%,置35℃、220 r/min搖床發酵,發酵42 h,分別對發酵液活菌數進行測定,確定最佳氮源。
(3)磷源篩選:以基礎發酵培養基中磷酸鹽的磷含量計算磷濃度,將基礎發酵培養基中的磷源分別用 KH2PO4、1/2 KH2PO4+1/2 K2HPO4和 K2HPO4替換,接種量為3%,裝液量為10%,置35℃、220 r/min搖床發酵,發酵42 h,分別對發酵液活菌數進行測定,確定最佳磷源。
(4)無機鹽篩選:去掉基礎發酵培養基中的無機鹽,添加0.002 mol/L的不同種類的無機鹽,以不加任何無機鹽的發酵培養基作為對照,接種量為3%,裝液量為10%,置35℃、220 r/min搖床發酵,發酵42 h,分別對發酵液活菌數進行測定,確定最佳無機鹽類。
1.2.5 正交實驗 根據凝結芽孢子桿菌發酵條件單因素優化實驗結果,選出最佳的碳源、氮源、磷源(葡萄糖、酵母膏和磷酸二氫鉀)及2種對發酵水平影響較大的無機鹽類(MnSO4·H2O和 MgSO4·7H2O),設計五因素四水平正交試驗,選用L16(45)正交表進行正交實驗(表1)。并對結果進行直觀分析和方差分析,優化培養基組成。
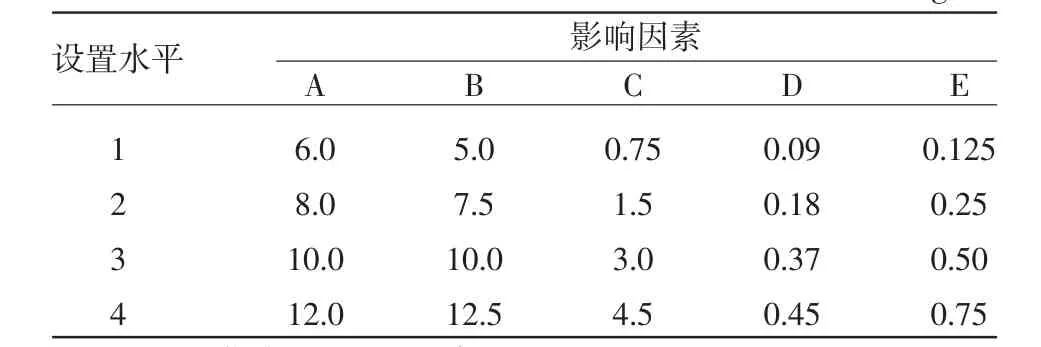
表1 發酵培養基正交實驗的因素和水平設計 (g/L)
2 結果與分析
2.1 培養條件優化
2.1.1 不同溫度對凝結芽孢桿菌發酵水平的影響由圖1可知:不同溫度對凝結芽孢桿菌發酵水平有一定影響,發酵溫度為30℃和35℃時,發酵液的活菌數較高,分別為 7.8×108cfu/mL 和 8.6×108cfu/mL,40℃和45℃發酵水平較低,分別為3.7×108cfu/mL和2.7×108cfu/mL,初步確定最佳發酵溫度為35℃。
2.1.2 不同轉速對凝結芽孢桿菌發酵水平的影響由圖2可知:不同轉速對凝結芽孢桿菌發酵水平有一定影響,其中轉速為220 r/min時,發酵液的活菌數最高,為 12.4×108cfu/mL,轉速為 140、180、260 r/min時,發酵液活菌數較低,分別為7.8×108、8.3×108、6.5×108cfu/mL,初步確定最佳發酵轉速為220 r/min。

圖1 不同溫度對凝結芽孢桿菌發酵水平的影響

圖2 不同轉速對凝結芽孢桿菌發酵水平的影響
2.1.3 不同裝液量對凝結芽孢桿菌發酵水平的影響 由圖3可知:不同裝液量對凝結芽孢桿菌發酵水平有一定的影響,裝液量為5%和10%時,發酵液活菌數相當,分別為8.8×108cfu/mL和8.5×108cfu/mL;裝液量為15%和20%時,發酵液活菌數分別為6×108cfu/mL和5.8×108cfu/mL。從一定程度上說明,溶氧量越高,發酵水平越高。鑒于裝液量太少,發酵液有一定蒸發量,易造成實驗結果偏差,因此確定最佳裝液量為10%。

圖3 不同裝液量對凝結芽孢桿菌發酵水平的影響
2.1.4 不同接種量對凝結芽孢桿菌發酵水平的影響 由圖4可知:不同接種量對凝結芽孢桿菌發酵水平影響較大,接種量為1%、3%、5%、7%、10%時,發酵液活菌數分別為 12×108,23×108,18×108,8×108、10×108cfu/mL,接種量對凝結芽孢桿菌發酵水平起著關鍵作用,過高或過低的接種量均不利于菌體的生長,因此,初步確定凝結芽孢桿菌最佳接種量為3%。
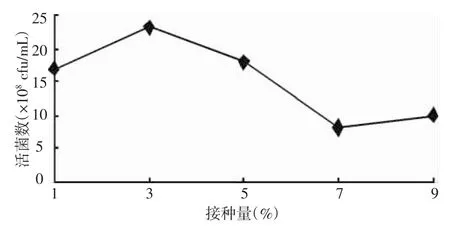
圖4 凝結芽孢桿菌液體發酵不同接種量篩選結果
2.1.5 不同初始pH對凝結芽孢桿菌發酵水平的影響 由圖5可知:不同初始pH對凝結芽孢桿菌發酵水平影響較大,發酵液初始pH=7.0時,發酵液的活菌數最高,為20.2×108cfu/mL,其次為pH=6.5和pH=7.5時,活菌數分別為15.1×108cfu/mL和12.7×108cfu/mL,pH=5.0和 pH=8.5時,活菌數最低,分別為 1.3×108cfu/mL 和 2.0×108cfu/mL。因此,初步確定發酵培養基最佳初始pH值為:pH=7.0。
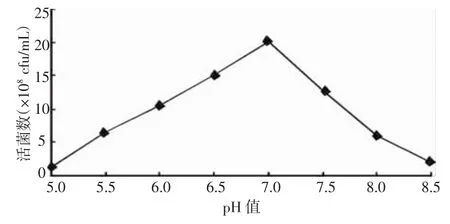
圖5 凝結芽孢桿菌搖瓶發酵不同初始pH篩選結果
2.1.6 不同發酵時間對凝結芽孢桿菌發酵水平的影響 由圖6可知:不同發酵時間對凝結芽孢桿菌發酵水平也影響較大,發酵時間為42 h時,發酵液活菌數最高,為22.1×108cfu/mL,發酵時間為36 h和48 h時,發酵液活菌數較高,為15.0×108cfu/mL和16.3×108cfu/mL,其他發酵時間的活菌數較低,初步確定最佳發酵時間為42 h。
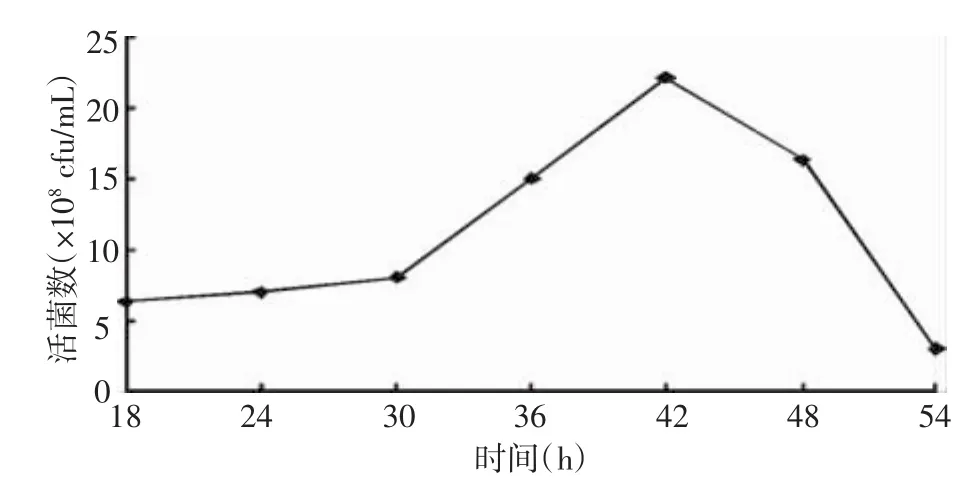
圖6 不同發酵時間對凝結芽孢桿菌發酵水平的影響
2.2 培養基組分優化
2.2.1 不同碳源對凝結芽孢桿菌發酵水平的影響由圖7可知,葡萄糖作為碳源時,發酵液活菌數最高,為26.4×108cfu/mL,淀粉作為碳源時,活菌數較高,為21.2×108cfu/mL,其他碳源發酵水平較低。
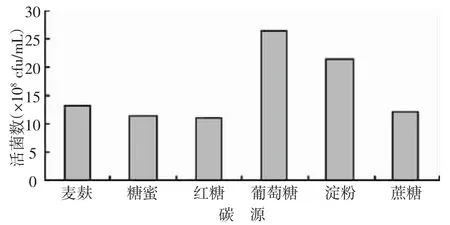
圖7 不同碳源對凝結芽孢桿菌發酵水平的影響
2.2.2 不同氮源對凝結芽孢桿菌發酵水平的影響由圖8可知,有機氮源對凝結芽孢桿菌的發酵水平起關鍵作用。以酵母膏作為氮源時,發酵液活菌數最高,為20.0×108cfu/mL,其他有機氮源,發酵水平較高,而硝酸鉀和硫酸銨兩種無機氮源,發酵水平最低,活菌數分別為1.0×108cfu/mL 和0.4×108cfu/mL。
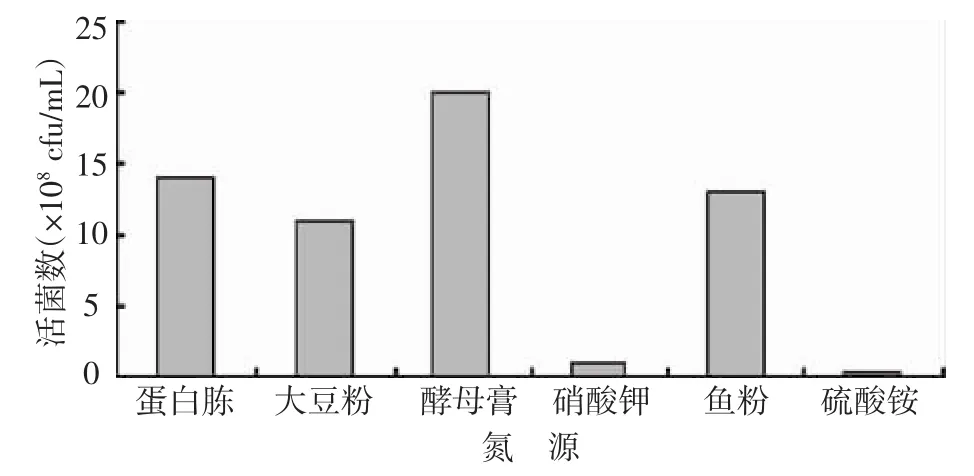
圖8 不同氮源對凝結芽孢桿菌發酵水平的影響
2.2.3 不同磷源對凝結芽孢桿菌發酵水平的影響由圖9可知,以KH2PO4作為磷源時,發酵液活菌數最高,為 22.0×108cfu/mL;K2HPO4作為磷源時,發酵液活菌數為12.0×108cfu/mL;二者合用時,發酵液活菌數最低,為7.0×108cfu/mL。

圖9 不同磷源對凝結芽孢桿菌發酵水平的影響
2.2.4 不同無機鹽對凝結芽孢桿菌發酵水平的影響 由圖10可知,分別添加硫酸鎂、硫酸錳、硫酸亞鐵和硝酸鉀4種無機鹽的發酵水平優于CK,發酵液活菌數分別為 12.1×108、10.6×108、9.4×108、8.6×108cfu/mL,而其他無機鹽發酵水平低于CK。

圖10 不同無機鹽對凝結芽孢桿菌發酵水平的影響
2.3 正交實驗結果
正交實驗設計及結果見表2,從表2的極差分析可以看出影響凝結芽孢子桿菌發酵水平主次因素關系為:B>E>C>A>D (酵母膏>MgSO4·7H2O>KH2PO4>葡萄糖>MnSO4·H2O),因素間最佳水平組合為A2B4C3D2E1,凝結芽孢桿菌的最佳發酵工藝條件為:葡萄糖8.0 g/L,酵母膏12.5 g/L,KH2PO43.0 g/L,MnSO4·H2O 0.18 g/L,MgSO4·7H2O 0.125 g/L。正交試驗方差分析結果見表3,從表3可以看出,F酵母膏=13.554>3,3 )=9.28,說明酵母膏的作用達到顯著水平,因此,在發酵過程中要嚴格控制酵母膏的用量,其他因素的作用沒有達到顯著水平。
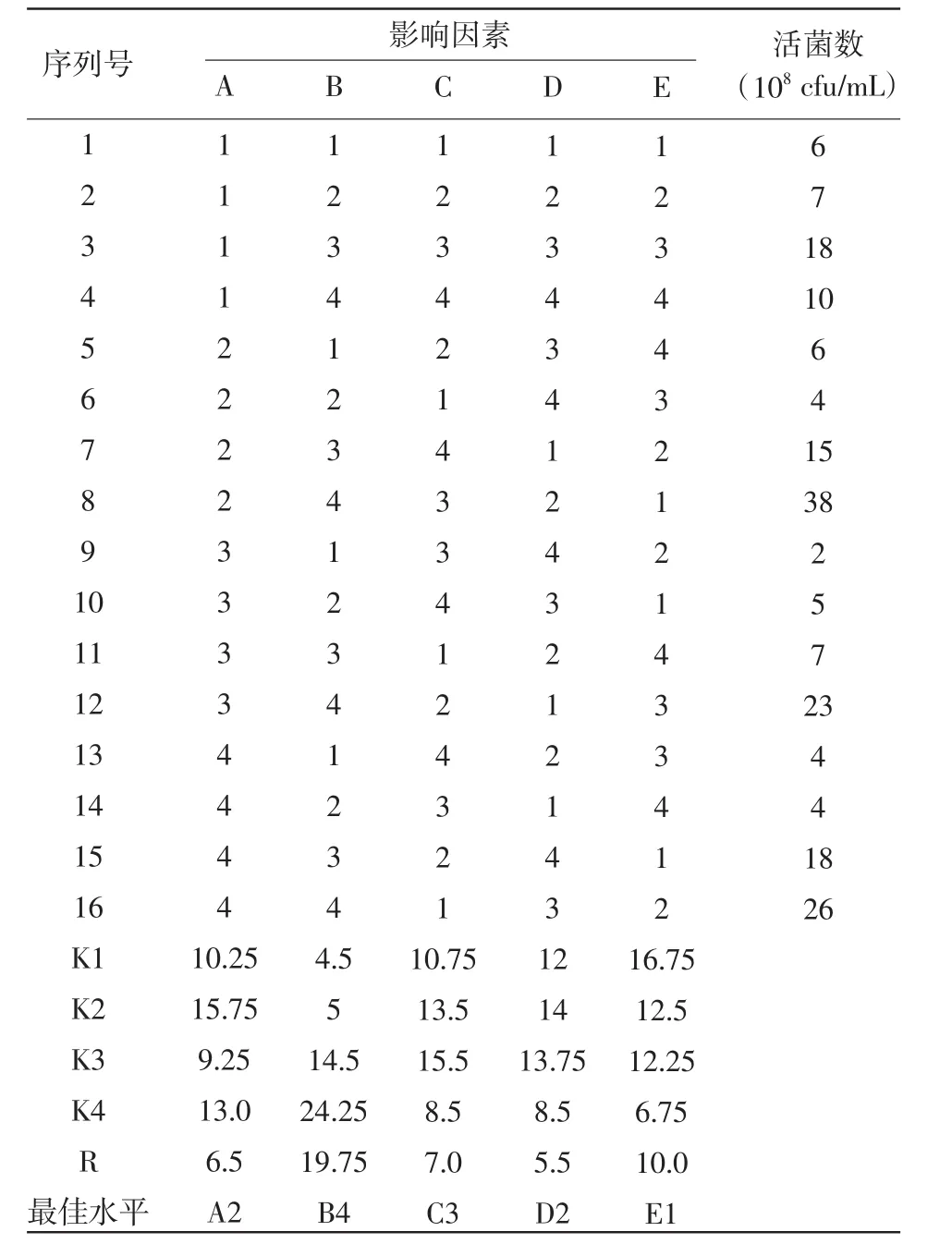
表2 培養基優化采用的L16(45)正交表的安排以及直觀分析結果

表3 正交實驗方差分析表
3 結論與討論
本實驗采用漸進法優化發酵條件,每確定一項,就在下一目標篩選中應用,這樣使得實驗結果更加準確[6]。在優化磷源實驗時,發酵水平有所下降,原因可能與斜面菌種活化生長狀況,種子液非同批次培養等情況有關。鑒于這些原因,對實驗進行了改進,建立了種子液和菌體濃度的線性關系[7],接種前測定種子液,轉換成菌體濃度后,再確定接種量。
通過對凝結芽孢桿菌培養條件和培養基組成的優化,初步確定了最佳發酵條件及培養基組成,最佳發酵條件:溫度35℃、轉速220 r/min、裝液量10%、接種量3%、初始pH=7.0、發酵時間42 h;最佳培養基組成:葡萄糖8.0 g/L,酵母膏12.5 g/L,KH2PO43.0 g/L,MnSO4·H2O 0.18 g/L,MgSO4·7H2O 0.125 g/L。在此最佳發酵培養基組成和發酵條件下進行發酵,發酵液活菌數可達38×108cfu/mL。
[1]李旋亮,吳長德,李建濤.微生態制劑的研究與應用[J].添加劑世界,2009,(7):23-26.
[2]崔東良,佟建明,王云山,等.凝結芽孢桿菌工業化發酵培養基初步研究[J].食品與發酵工業,2007,33(12):73-75.
[3]李國建.凝結芽孢桿菌替代抗生素對豬生產性能的影響[J].河南農業科學,2004,(10):72-74.
[4]Adami A.,Cavazzoni V.Occurrence of selected bacterial groups in the faeces of piglets fed with Bacillus coagulans as probiotic[J].J.Basic Microbiol,1999,(39):3-9.
[5]秦 艷,李衛芬,雷 劍,等.凝結芽孢桿菌發酵條件的優化[J].浙江農業學報,2008,20(6):471-474.
[6]王 振,王 靜,趙廷昌,等.煙草青枯病拮抗細菌芽孢桿菌AR03菌株搖瓶發酵條件的篩選 [J].中國生物防治,2006,10(22):119-123.
[7]朱艷靜,李 宇.測定菌體濃度的簡便方法 [J].工業微生物,2006,4(36):47-49.

