sCD40L聯合長春瑞濱對肺腺癌A549細胞的作用
劉珊 陳波 李燕 趙衛紅 吳劍卿
CD40分子屬于腫瘤壞死因子受體(tumor necrosis family receptor, TNFR)超家族成員。CD40及其配體CD40L(CD154)形成的共刺激信號在體內免疫激活過程中起著核心作用。除了免疫細胞外,CD40還表達于多種腫瘤細胞。研究證實,CD40信號的活化在體外對多種腫瘤細胞均有生長抑制作用。有關激發型CD40單抗的臨床試驗已初步顯示一定的作用。CD40相關的治療已成為腫瘤免疫治療和基因治療的發展方向之一[1-4]。
近年來研究[5-9]發現,CD40信號可影響腫瘤細胞對化療藥物的敏感性,且在不同的腫瘤類型、細胞系及藥物間表現出一定的差異,但具體機制不明。關于CD40信號對肺癌細胞化療敏感性的影響鮮有報道,本研究旨在觀察可溶性CD40配體(sCD40L)聯合長春瑞濱(vinorelbine)對肺腺癌A549細胞的作用,并探討其可能的機制。
1 材料與方法
1.1 材料 肺腺癌細胞株A549購自中國科學院上海細胞研究所。RPMI-1640培養基為Gibco公司產品,胎牛血清(FCS)為杭州四季青公司產品,PE標記鼠抗人CD40單克隆抗體、鼠抗人IgG1同型對照抗體及sCD40L均為Peprotech公司產品,四氮唑鹽(MTT)購自美國Sigma公司,Caspase-3活性檢測試劑盒購自南京凱基公司。長春瑞濱為江蘇豪森藥業有限公司生產。EP ICS XL型流式細胞儀為美國Beckman Coulter公司產品,550酶標儀為美國Biorad公司產品,生物倒置顯微鏡為Olympus CKX4。
1.2 方法
1.2.1 細胞培養 細胞置于含10% FCS的RPMI-1640培養基中,37oC、5%CO2溫箱培養,4 d-5 d傳代1次。每次實驗前取狀態良好的對數生長期細胞,經0.25%胰蛋白酶消化后備用。
1.2.2 細胞表面CD40表達的檢測 取A549細胞3×105個細胞與CD40單抗及相應的同型對照小鼠IgG在4oC孵育30 min。用含0.25% FCS和0.01% NaN3的PBS緩沖液洗滌2次后,重懸細胞并經流式細胞儀檢測細胞表面CD40的表達。
1.2.3 MTT比色法檢測細胞增殖 取對數生長期的A549細胞(1×104個/孔)加入96孔培養板中,加入CD40L(2 μg/mL),用含10% FCS的RPMI-1640培養基調整培養體積為100 μL,置溫箱中培養72 h后更換培養基并加入長春瑞濱(20 μg/mL),每組設8個復孔,同時設空白調零組、細胞對照組,繼續培養24 h。在終止培養前4 h每孔加入MTT(5 mg/mL)20 μL,培養終止后,棄去上清液,鹽酸異丙醇(每孔100 μL)徹底溶解甲瓚顆粒,酶標儀570 nm處讀取吸光度(A)值。細胞生長抑制率(%)=(1-實驗組A值/對照組平均A值)×100%。
1.2.4 流式細胞術檢測細胞周期及凋亡率 取對數生長期的A549細胞(5×104個/孔) 加入24孔培養板中,加CD40L(0.2 μg/mL, 1.0 μg/mL, 2.0 μg/mL),用含10%FCS的RPMI-1640培養基調整培養體積為1 mL,置溫箱中培養72 h后更換培養基并加入長春瑞濱(20 μg/mL),繼續培養24 h,以0.25%胰酶消化并收集細胞,共同預冷的PBS洗2次,加入75%乙醇,-20oC固定過夜。細胞離心后PBS洗1次,加入RNA酶(1 mg/mL)、PI(10 μg/mL)溶液、0.5% TritonX-100,室溫避光溫育30 min,加PBS,EPICS XL流式細胞儀檢測分析。實驗重復3次。
1.2.5 Caspase-3活性的檢測 取對數生長期人肺腺癌細胞A549,制成1×106個/L的細胞懸液,接種于6孔板,加CD40L(2.0 μg/mL),用含10% FCS的RPMI-1640培養基調整培養體積為1 mL,置溫箱中培養72 h后更換培養基并加入長春瑞濱(20 μg/mL),同時設細胞對照組、sCD40L和長春瑞濱單獨作用組,繼續培養24 h,用PBS洗滌細胞2次(離心2 000 rpm,5 min)收集3×106個-5×106個細胞,按照Caspase-3檢測試劑盒說明書進一步操作,酶標儀λ=405 nm測定其吸光值。通過計算OD誘導劑/OD陰性對照的倍數來確定凋亡誘導劑組Caspase-3活化程度。
1.3 統計學分析 數據分析采用Stata 7.0軟件,數據以Mean±SD表示,組間比較采用t檢驗和方差分析,以P<0.05為差異具有統計學意義。
2 結果
2.1 sCD40L聯合長春瑞濱對細胞生長的影響 A549細胞表面CD40分子的表達率為(48.1±6.2)%。顯微鏡下見sCD40L聯合長春瑞濱有最佳的抗A549細胞作用(圖1)。MTT比色法結果顯示,sCD40L可抑制A549細胞的體外增殖(P<0.05);經sCD40L預處理后,長春瑞濱對A549細胞的生長抑制率上調( P<0.05)(表1)。
2.2 sCD40L聯合長春瑞濱對細胞周期及凋亡的影響 相同長春瑞濱劑量下,sCD40L預處理與否對A549細胞周期時相影響不大,周期各時相的百分率無明顯變化(P>0.05);sCD40L預處理后并不顯著增加長春瑞濱誘導的細胞凋亡率(P>0.05)。在各組間,細胞周期各時相的百分率及凋亡率的差異無統計學意義(P>0.05)(圖2,圖3)。
2.3 sCD40L聯合長春瑞濱對Caspase-3活性的影響 sCD40L單獨作用對A549細胞的Caspase-3活性無明顯影響;相同的長春瑞濱劑量下,經sCD40L預處理后的A549較未激發組細胞的Caspase-3活性顯著下降(P<0.05)(圖4)。
3 討論
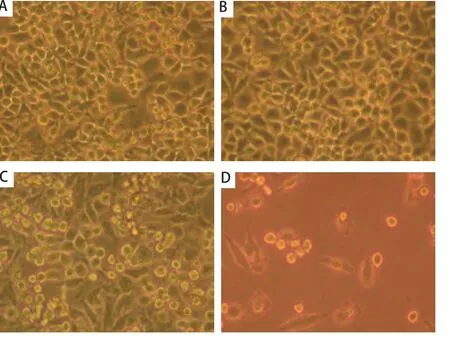
圖 1 CD40激發前后長春瑞濱對A549細胞作用的鏡下觀察。A、B、C、D:分別為各組中所觀察的一個有代表性的視野。長春瑞濱可導致細胞變小、變圓、脫壁、存活細胞明顯減少,其中以sCD40L聯合長春瑞濱組最顯著。A:空白對照組;B:sCD40L組;C:長春瑞濱組;D:sCD40L聯合長春瑞濱組。Fig 1 Effect of sCD40L combined with vinorelbine on the proliferation of A549 cells observed by microscope. A, B, C or D showed a representative microscope field. The number of survival cells was obviously reduced when vinorelbine was added accompanied shrinking of the cell volume, emerging of a spherical shape and falling off of cells from the culture capsule wall, and this phenomena was most obvious in the group of sCD40L combined with vinorelbine. A: blank; B: sCD40L; C: vinorelbine; D: sCD40L+vinorelbine.
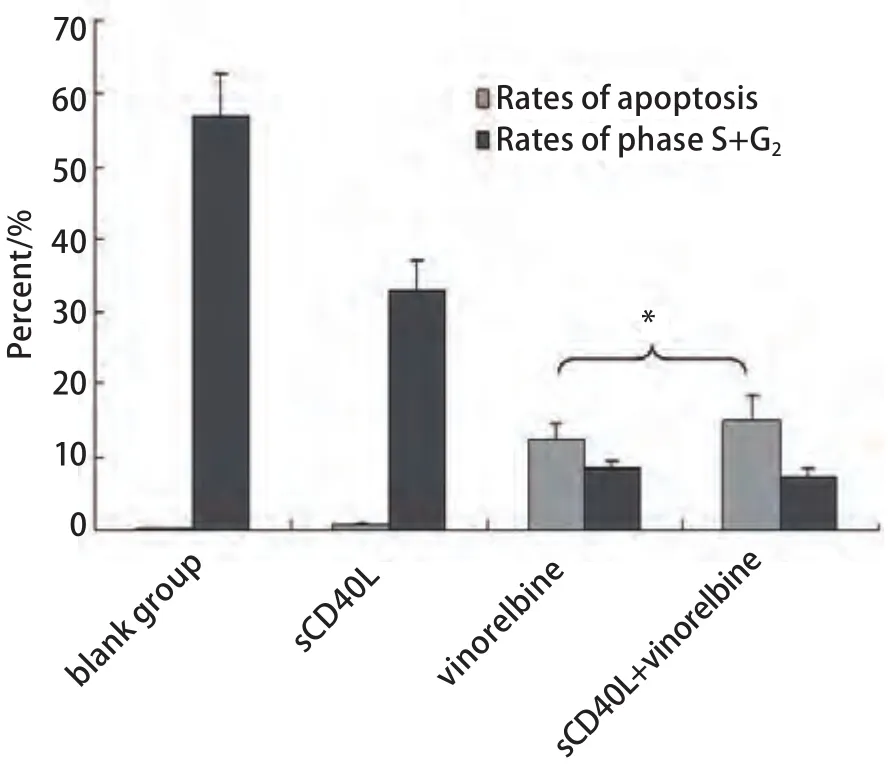
圖 2 CD40激發前后長春瑞濱對A549凋亡率及細胞周期的影響(*3個sCD40L濃度所得結果的Mean±SD,與長春瑞濱單藥組比較,P>0.05)Fig 2 Effect of sCD40L combined with vinorelbine on the cell cycle and apoptosis of A549 cells (*Mean values of the results of three sCD40L concentration groups, sCD40L+vinorelbine vs vinorelbine alone, P>0.05).
圖 3 PI染色細胞周期及凋亡情況測定Fig 3 Cells were analyzed for different phases and apoptotic rates by PI staining
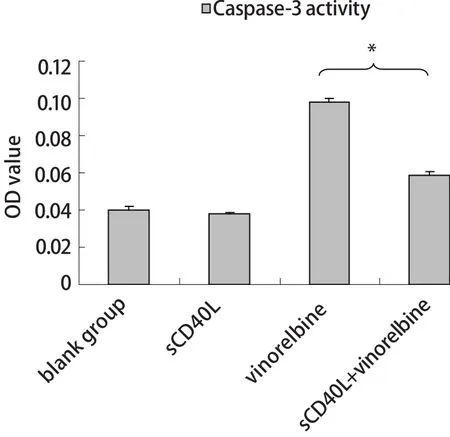
圖 4 CD40激發前后長春瑞濱對A549細胞中Caspase-3活性的影響Fig 4 Effect of sCD40L combined with vinorelbine on the Caspase-3 activity of A549 cells (%, n=3, Mean±SD)sCD40L+vinorelbine vs vinorelbine alone, *P<0.05.
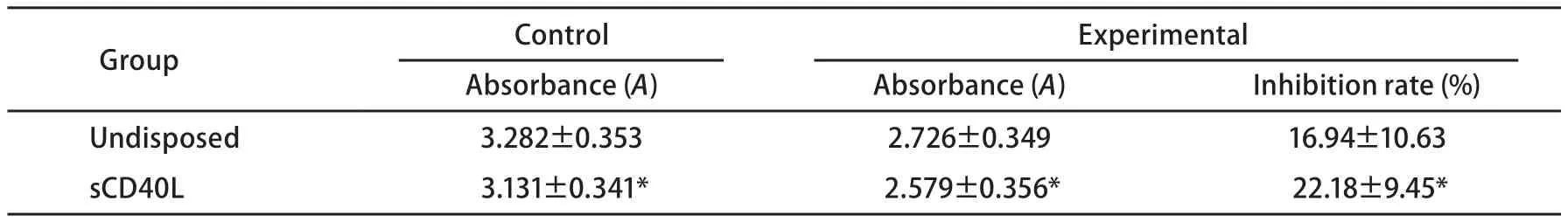
表 1 CD40激發前后長春瑞濱對A549細胞增殖的抑制作用 (n=3, Mean±SD)Tab 1 Effect of sCD40L combined with vinorelbine on the proliferation of A549 cells (n=3, Mean±SD)
目前,關于CD40信號通路在惡性腫瘤中的生物學作用存在不同意見。一方面,盡管大量研究證實激活CD40信號可抑制多種血液系統腫瘤細胞及乳腺癌、大腸癌和肺癌等實體腫瘤細胞的增殖,但也有CD40通路是腫瘤生長信號的報道[1]。另一方面,一些研究發現激活CD40信號可增強化療藥物對腫瘤細胞的殺傷力,而另一些研究報道CD40通路與腫瘤細胞耐藥有關[5-9]。這些矛盾的結論可能源于以下原因:不同腫瘤類型間固有的差異;同種腫瘤中來源不同的細胞株;藥物作用機制不同產生的差異;未知的影響因素;激活CD40信號所使用方法的不同,這也是最顯著的原因,例如研究發現sCD40L和激發性CD40單抗(agonist)單獨作用并不顯著增加腫瘤細胞凋亡,除非細胞的蛋白質合成被某些化療藥物所抑制;而由細胞表達的膜型CD40L有明顯的促凋亡作用,但卻可能抑制化療藥物引起的凋亡[10-13]。鑒于CD40信號相關生物學作用的復雜性,有必要針對肺癌細胞進一步深入研究。
本研究中,我們發現sCD40L對CD40的激活可以顯著增強長春瑞濱對A549細胞的作用,進一步研究提示其作用機制與促凋亡無關。但有關其它腫瘤細胞的研究中,CD40信號與凋亡的關系被認為是其影響藥物敏感性的核心機制,激發CD40信號可能促進凋亡也可能抑制凋亡[5,7,8]。王天立等[9]發現激發CD40信號可使順鉑(DDP)或絲裂霉素(MMC)誘導的非凋亡性細胞死亡顯著增加。李旭鹿等[14]發現大豆異黃酮(soybean isof l avone, SIF)對長春瑞濱有增效作用,但也與誘導凋亡無關,細胞為變性樣改變。付校等[15]發現自噬在長春瑞濱誘導的A549細胞死亡中發揮著重要作用。此外,本研究還發現sCD40L聯合長春瑞濱較單用長春瑞濱對A549細胞周期時相影響不大,排除了CD40信號通過抑制細胞周期而達到增效的可能。因此,我們推測sCD40L的藥物增敏作用可能與其它細胞死亡或細胞生長抑制機制有關。
長期以來,誘導凋亡被認為是化療藥物殺滅腫瘤細胞的主要機制,但越來越多的證據[16-20]顯示,其它如自噬(autophagy)、凋亡樣或壞死樣程序性死亡(apoptosis-like and necrosis-like programmed cell death)、有絲分裂災難(mitotic catastrophe)以及加速的細胞老化(senescence)等廣泛參與了化療藥物的治療作用。Caspase家族在介導細胞凋亡的過程中起著非常重要的作用,其中Caspase-3為關鍵的執行分子,它在凋亡信號傳導的許多途徑中發揮功能,其活性在凋亡發生時常明顯升高[21]。本研究發現,盡管sCD40L并不明顯影響藥物誘導的細胞凋亡,但Caspase-3的活性卻意外地顯著下降。Voorzanger-Rousselot等[7]在乳腺癌細胞系中的研究有類似發現:CD40信號的激活可顯著抑制化療藥物誘導的細胞凋亡,但Caspase-3/7的活性反而增加2倍-4倍,表明Caspase的活性與細胞凋亡不存在固定的因果關系,可能有其它調節機制。此外,Caspase-3的活性在胞膜不完整的死亡細胞中通常是明顯下降的[21],這也進一步提示本研究中sCD40L的增敏作用可能以誘導非凋亡性細胞死亡為主。這些死亡機制均是Caspase非依賴性的,可能與Cathepsins及Calpains等蛋白酶有關,并且廣泛存在于以微管為靶點的藥物作用中[22,23]。
綜上,本研究提示sCD40L對CD40信號的活化可能通過凋亡及細胞周期抑制以外的機制影響長春瑞濱對A549細胞的作用。未來的研究應進一步驗證這些潛在機制,并找出可行的調節方法。

