人淋巴瘤細胞Jurkat通過Fas/FasL途徑抑制人肺癌細胞A549的免疫逃逸
王紅梅 張國強 戴紀綱 閔家新
肺癌是世界上最常見的惡性腫瘤之一,術后復發率和轉移率均很高。近年來在手術治療、放療和化療外,研究較多的是免疫治療。對肺癌發病機制的研究發現,肺癌的發生發展與其自身的免疫逃逸機制密切相關。如果可通過某些途徑遏制或阻斷肺癌細胞的免疫逃逸,即能為肺癌的治療提供新的機會。
當機體發生腫瘤時,腫瘤細胞可以多種方式逃避免疫系統的監控而分裂生長,這就是腫瘤的免疫逃逸[1]。研究[2]表明,腫瘤細胞自身凋亡減少以及機體免疫細胞凋亡增加是腫瘤免疫逃逸的重要機制。Fas/FasL系統是介導凋亡的重要分子體系[3],當肺癌細胞與Jurkat細胞以一定比例共培養時,肺癌細胞可通過Fas/FasL途徑誘導Jurkat細胞凋亡[4]。因此,為了探討機體淋巴細胞是否可以通過Fas/FasL途徑抑制肺癌細胞的免疫逃逸,本研究以人肺癌細胞株A549和人T細胞淋巴瘤細胞株Jurkat為研究對象,觀察不同細胞比例共培養下對Jurkat細胞生長的影響;同時觀察不同比例共培養對A549和Jurkat細胞各自凋亡率的影響;最后檢測A549細胞中凋亡相關信號分子Fas、FasL及Caspase-8蛋白表達情況,探討Fas/FasL通路在Jurkat細胞誘導A549細胞凋亡及抑制肺癌細胞免疫逃逸中的作用,為臨床研究以Fas/FasL為靶點治療肺癌提供一定的實驗依據。
1 材料與方法
1. 1 材料 人肺癌細胞株A549由第三軍醫大學新橋醫院呼吸研究所提供,人淋巴瘤細胞株Jurkat(ATCC TIB-152)購自上海麥莎生物科技有限公司。Annexin V-FITC凋亡檢測試劑盒購自杭州聯科生物技術有限公司(貨號:K101-100)。兔抗人Fas、 FasL、Caspase-8單克隆抗體由美國Santa Cruz公司提供。
1. 2 方法
1.2.1 細胞培養 A549細胞及Jurkat細胞在5%CO2、37oC條件下用含10%優質胎牛血清的RPMI-1640培養基進行復蘇、傳代。將A549細胞以2×105/mL密度接種至培養瓶內,待細胞長滿至85%左右時,吸去培養基;用新鮮培養基將對數生長期Jurkat細胞制成細胞懸液,按1:1、10:1、20:1、50:1(A549/Jurkat)加入A549細胞培養瓶中共培養,同時設置對照組A549及Jurkat細胞,6 h后分別收集兩種細胞。分別用3%臺盼藍染色,計數存活細胞數量。
1.2.2 流式細胞術檢測A549及Jurkat細胞的凋亡 分別收集各組中兩種細胞,用PBS洗滌2次,加入150 μL Binding Buffer和FITC標記的Annexin-V 5 μL,室溫避光15 min,再加入PI 5 μL,避光反應5 min后,加入200 μL Binding Buffer,立即用流式細胞儀檢測A549與Jurkat細胞的凋亡率,同時以不加AnnexinV-FITC及PI的一管作為陰性對照。以上實驗每組同設至少3個樣本,該實驗至少重復3次。
1.2.3 各組A549細胞中Fas、 FasL、Caspase-8蛋白水平檢測 分別收集實驗中各組A549細胞,提取細胞總蛋白后用考馬斯亮藍試劑盒檢測蛋白濃度,調整樣本濃度基本一致后進行蛋白變性處理,保存于-20oC。分別將蛋白樣本進行凝膠電泳 (SDS-PAGE)后,半干法轉膜至PVDF膜上(15 V, 20 min),5%脫脂奶粉封閉2 h,隨后分別用兔抗人Fas(43 kDa)、FasL(40 kDa)、Caspase-8單克隆抗體和GAPDH單克隆抗體4oC孵育過夜。TBST洗膜后再加入辣根過氧化物(HRP)標記羊抗兔IgG(1:1 000),4oC孵育2 h。洗膜后用化學發光底物顯影,凝膠圖像處理系統軟件(Brad, USA)分析目的條帶的灰度值。結果判斷:以目的蛋白的灰度值與GAPDH的灰度值的比值表示各目的蛋白相對表達水平。
1.3 統計學處理 采用SPSS 13.0統計軟件進行數據分析,所有計量資料以Mean±SD表示。兩組間比較采用t檢驗,組間比較采用單因素方差分析(ANOVA)。以P<0.05為差異有統計學意義。
2 結果
2.1 A549與Jurkat細胞以不同比例共培養時對Jurkat細胞生長的影響 人肺癌細胞與Jurkat細胞共培養6 h后,臺盼藍染色細胞計數發現,隨著A549/Jurkat比例逐漸增大,Jurkat細胞生長明顯受到抑制,各組間存在著明顯差異(P<0.05, P<0.01),且比例越大抑制率越高(圖1)。
2.2 A549與Jurkat細胞以不同比例共培養時對A549及Jurkat細胞凋亡的影響 隨著A549/Jurkat比例逐漸增大,Jurkat細胞凋亡率明顯增加,而A549細胞凋亡率明顯降低,各組間存在著顯著差異,且差異具有統計學意義(P<0.05,P<0.01),提示增加的A549細胞促進了Jurkat細胞的凋亡,同時A549細胞免疫逃逸能力增強(圖2)。
2.3 A549與Jurkat細胞以不同比例共培養時對A549細胞中凋亡相關分子Fas、FasL及Caspase-8蛋白表達的影響 隨著A549/Jurkat比例逐漸減小,A549細胞中Fas、Caspase-8蛋白水平明顯上調,而FasL蛋白水平未發生明顯改變,提示增加的Jurkat細胞有效地上調了A549細胞中Fas、Caspase-8蛋白水平,從而促進其凋亡(圖3,表1)。
3 討論
Fas,又名CD95或APO-1,屬于腫瘤壞死因子受體(tumor necrosis factor receptor, TNFR)和神經生長因子受體(nerve growth factor receptor, NGFR)家族,是相對分子量為4 500的I型膜蛋白。機體中許多組織細胞可表達或經激活誘導表達Fas,以免疫系統的表達最豐富。Fas配體(FasL)是一種相對分子量約4 000的三聚體II型跨膜糖蛋白,不僅在免疫豁免器官如睪丸中表達,還可在多數腫瘤細胞表達。FasL與Fas結合后,誘導Fas形成三聚體,并將凋亡信號傳遞給Caspase-8。Caspase-8是一種蛋白酶,是半胱氨酸蛋白酶超家族中的一員。在Fas引發的凋亡過程中,一系列Caspase級聯式地活化,其中Caspase-8的活化是其第一步反應。活化后的Caspase-8會引發下游Caspase活化,進而誘導細胞凋亡[5]。研究[6]表明肺癌細胞通過高表達FasL,誘導機體表達Fas的淋巴細胞凋亡,從而逃避機體免疫清除,而Fas、Caspase-8同時也參與了這一過程。
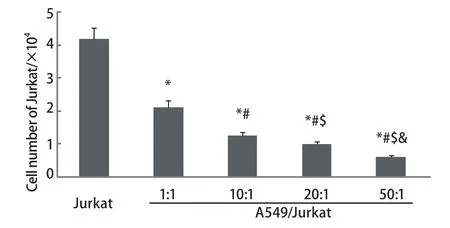
圖 1 臺盼藍染色檢測各組中Jurkat細胞存活率。A549細胞與Jurkat細胞按0、1:1、10:1、20:1、50:1進行共培養,隨著A549細胞數增加,Jurkat細胞存活率逐漸降低。*P<0.01(vs 0);#P<0.01( vs 1:1);$P<0.01(vs 10:1);&P <0.01( vs 20:1)。Fig 1 Jurkat cells survival rates in all groups detected by trypan blue dyeing. A549 cells and Jurkat cells co-cultured in proportion to 0, 1:1,10:1, 20:1, 50:1. Jurkat cells survival rates reduced along with A549 cells increased. *P<0.01 (vs 0); #P<0.01 (vs 1:1); $P<0.01 (vs 10:1); &P<0.01 (vs 20:1).
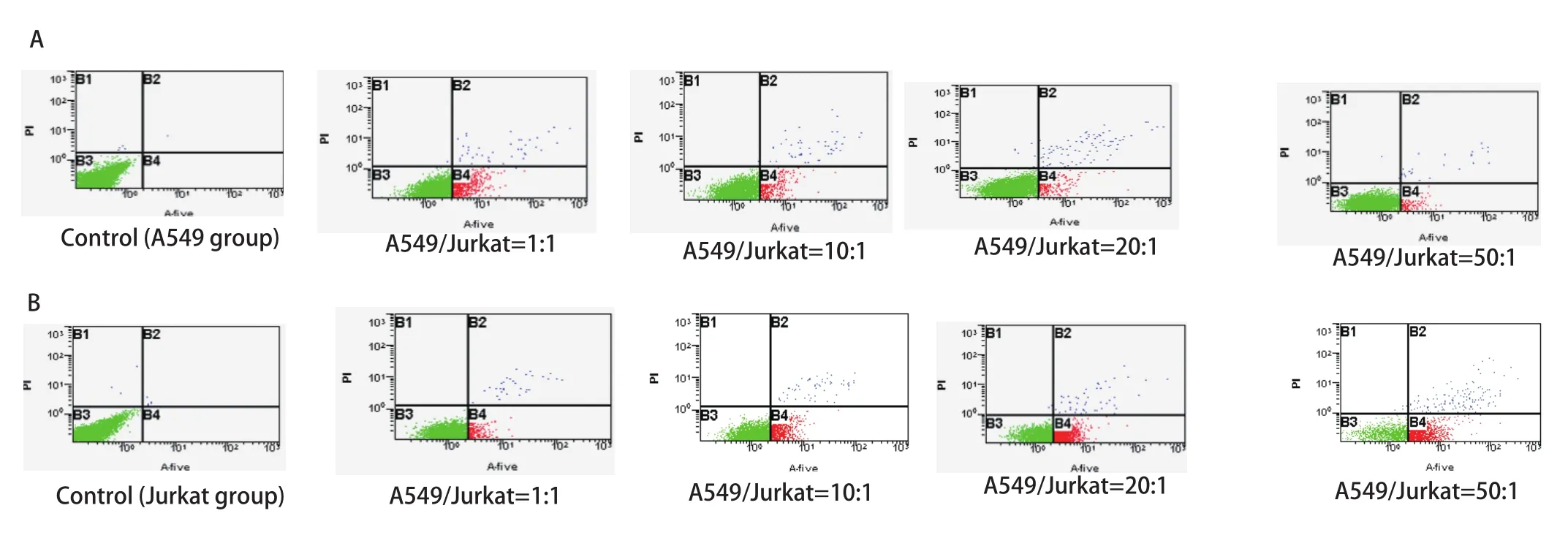
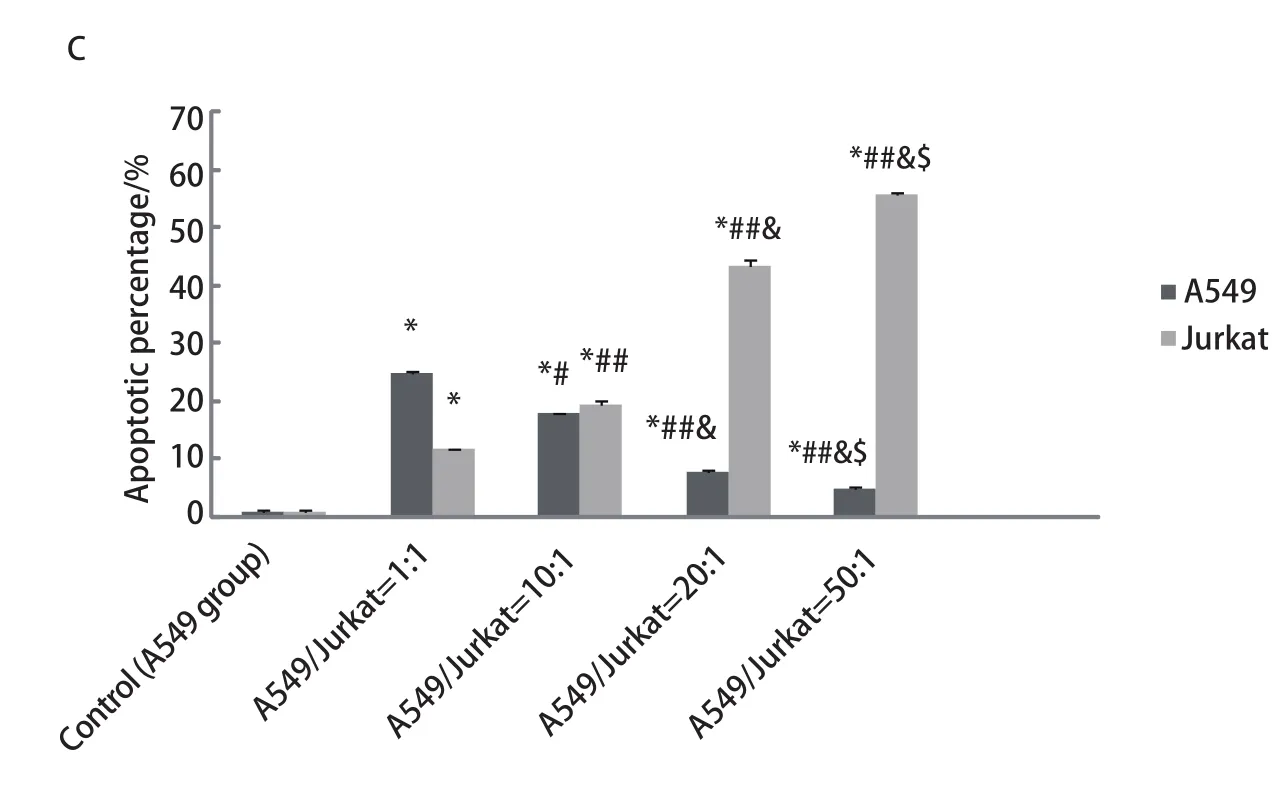
圖 2 流式細胞術檢測各組中A549、Jurkat細胞凋亡率。A:流式細胞術檢測各組中A549細胞凋亡率;B:流式細胞術檢測各組中Jurkat細胞凋亡率;C:A549與Jurkat細胞以不同比例混合時A549、Jurkat細胞凋亡率。隨著Jurkat細胞比例減少及A549細胞比例的增加,A549細胞凋亡率逐漸減少,Jurkat細胞凋亡率逐漸增加。隨著Jurkat細胞比例減少及A549細胞比例的增加,A549細胞凋亡率逐漸減少,Jurkat細胞凋亡率逐漸增加。Fig 2 Apoptotic rates of A549 cells and Jurkat cells in all groups detected by FCM. A: Apoptotic rates of A549 cells in all groups detected by FCM; B: Apoptotic rates of Jurkat cells in all groups detected by FCM; C: Apoptotic rates of Jurkat cells and A549 cells in all groups. Apoptotic rates of Jurkat cells reduced and apoptotic rates of A549 cells increased along with A549/Jurkat gradually increasing.*P<0.01 (vs 0); #P<0.05, ##P<0.01(vs 1:1); &P<0.01 (vs 10:1);$P<0.01 (vs 20:1).
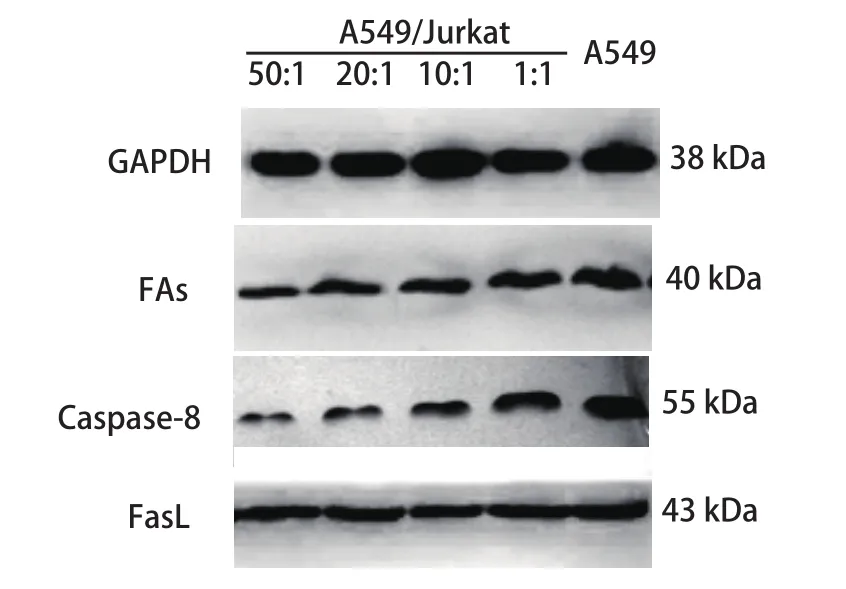
圖 3 各組A549細胞中FasL、Fas及Caspase-8蛋白檢測Fig 3 Expressions of FasL, Fas and Caspase-8 in A549 cells
通過本研究發現,增加共培養體系中Jurkat細胞數量有利于提高肺癌細胞A549中Fas、Caspase-8的表達水平,而對FasL的表達無明顯影響。我們推測Jurkat細胞數量的增加有助于抑制肺癌細胞A549的免疫逃逸,從而促進肺癌細胞的凋亡。本結果與向青等[4]研究基本一致,同時我們也注意到,當Jurkat細胞數量增加時,肺癌細胞A549的Fas反擊效應并未顯現出來,推測可能與腫瘤浸潤過程中FasL基因發生突變、FasL表達水平無明顯改變密切相關。而增加的Fas、Caspase-8則明顯增強了Fas/FasL系統的清除能力,從而有效地誘導了肺癌細胞的凋亡。
已有研究[7]表明Caspase-8在神經母細胞瘤、肝癌、宮頸癌等疾病的發生發展中起重要作用。對食管癌的研究[8]已經證實,從食管正常黏膜組織到不典型增生和食管癌組織,Caspase-8蛋白及RNA陽性表達率呈逐漸下降趨勢,而在高、中分化鱗癌中的表達率高于低分化鱗癌。 也有研究[9,10]表明Caspase-8基因經常突變或沉默,從而引起腫瘤細胞的化療抵抗,如肝癌和腎癌等。本研究結果顯示Caspase-8參與了A549細胞凋亡的發生,隨著凋亡的增加,A549細胞表達Caspase-8也增加。由此我們可以設想,通過基因技術改變機體免疫細胞或腫瘤細胞表達Caspase-8,從而遏制腫瘤生長、轉移,達到治療腫瘤的目的。
當腫瘤細胞受到Fas陽性的T細胞攻擊時,腫瘤細胞可通過減少Fas的表達逃避T淋巴細胞對其的攻擊作用[2,11];同時,腫瘤細胞可通過高表達FasL對T淋巴細胞展開反攻擊[12];并且,一些腫瘤細胞雖然表達Fas,但其卻對抗T淋巴細胞性FasL介導的凋亡效應。Fas的突變同樣可導致凋亡信號傳導的異常,其最終效應是誘導宿主對抗腫瘤細胞的死亡,最終產生免疫抑制效應。本研究提示,肺癌的發生與發展過程與Fas/FasL系統異常所致的機體免疫清除功能部分失活密切相關。同時還可以推測,隨著肺癌病程的發展,機體免疫細胞中某些基因可能發生了突變,導致Fas、FasL、Caspase-8的表達發生改變、細胞清除腫瘤細胞的能力降低以及免疫防御作用減弱,從而有利于腫瘤的擴散和轉移。
事實上,Fas/FasL通路只是肺癌細胞眾多免疫逃逸機制之一[13],其在肺癌細胞免疫逃逸中的地位及與其它相關機制的相互作用還有待進一步闡明。我們也期待肺癌的免疫治療能有新的進展。

