一株產L-乳酸菌株的篩選、鑒定及營養條件的初步研究
高江婧, 嚴群, 阮文權*
(1.江南大學生物工程學院,江蘇無錫 214122;2.江南大學工業生物技術教育部重點實驗室,江蘇無錫 214122;3.江南大學環境與土木工程學院,江蘇無錫 214122)
一株產L-乳酸菌株的篩選、鑒定及營養條件的初步研究
高江婧1, 嚴群2,3, 阮文權*2,3
(1.江南大學生物工程學院,江蘇無錫 214122;2.江南大學工業生物技術教育部重點實驗室,江蘇無錫 214122;3.江南大學環境與土木工程學院,江蘇無錫 214122)
作者對篩選的一株產L-乳酸的菌株進行了菌種鑒定,根據16S rDNA序列測定結果,結合其形態特征及生理生化性質,確定該菌株為凝結芽孢桿菌(B acillus coagulans)。進一步對其營養條件進行了研究,初步確定玉米糖化液為最適碳源,采用1 g/dL酵母粉與1 g/dL棉籽蛋白的混合氮源,L-乳酸產量不僅有所提高且成本大大降低,金屬離子Mn2+、Fe2+、Mg2+都可在一定程度上提高L-乳酸的產量。
細菌鑒定;16S rDNA;凝結芽孢桿菌;L-乳酸
乳酸是目前世界上公認的3大有機酸之一,廣泛應用于食品、醫藥、化工、制革、紡織、環保和農業等諸多領域[1]。特別是以L-乳酸為原料生產的生物可降解性塑料——聚乳酸,對于解決日益嚴重的白色污染問題有重要的意義。近年來關于L-乳酸的研究報道很多,發酵法生產L-乳酸的菌種主要有根霉和細菌兩大類。與根霉好氧發酵生產L-乳酸相比,乳酸細菌發酵法具有糖轉化率高、無通氣能量消耗、成本低等優點[2]。因此篩選L-乳酸產生菌具有重要意義。
目前文獻報道細菌乳酸發酵的較高水平有趙博等人[3]以葡萄糖為碳源,添加豆粕水解液和玉米漿作為輔料,2 L罐培養120 h,L-乳酸質量濃度可達202 g/L,糖轉化率91.3%。丁紹峰等[4]采用指數流加發酵使總乳酸質量濃度達210 g/L,其中L-乳酸質量濃度達180 g/L。雖然產量很高,但仍存在發酵周期長、生產效率低或光學純度低等缺點。作者對實驗室分離出的一株產L-乳酸的菌株進行了生理生化試驗、糖發酵試驗及16S rDNA序列測定,確定該菌株為凝結芽孢桿菌。為進一步了解該菌株發酵生產L-乳酸的能力,對其營養條件進行了初步研究。由于乳酸細菌發酵法對氮源的要求較高,從而使生產成本偏高,因此降低氮源的成本具有很大的現實意義,作者亦在降低氮源成本方面做了嘗試。
1 材料與方法
1.1 菌種的篩選與鑒定
1.1.1 菌種的篩選 采集某奶制品企業附近離地面約3~10 cm的土樣,樣品經增殖、稀釋后涂布CaCO3-溴鉀酚紫平板培養基,待長出菌落后,挑選可水解CaCO3且變色圈大的菌株,經搖瓶發酵后,選取L-乳酸產量高且光學純度高的菌株并將其保藏。
1.1.2 菌體形態觀察及生理生化實驗 參照文獻[5]。
1.1.3 糖類發酵實驗 參照文獻[6]。
1.1.4 分子生物學鑒定 染色體DNA的提取,菌株16S rDNA的擴增、16S rDNA序列的測定以及BLAST比對均參照文獻[7]。
1.2 培養基
1.2.1 分離平板培養基 CaCO3-溴鉀酚紫平板培養基。
1.2.2 搖瓶種子培養基與搖瓶發酵培養 參照文獻[8]。
1.3 培養方法
1.3.1 種子培養 從培養24 h的斜面上挑取一環菌體接入液體種子培養基,45℃、120 r/min搖床培養18 h。
1.3.2 發酵培養 將培養良好的種子按體積分數10%接種于發酵培養基中,45℃、120 r/min搖床培養72 h。
1.4 分析方法
1.4.1 乳酸質量濃度 采用高效液相色譜儀(Agillent 1100,美國)。具體色譜條件:色譜柱為美國Merck公司的ZORBAXSB-Aq,150 mm× 4.6 mm(直徑5μm),流速0.5 mL/min,檢測波長210 nm,進樣量10μL,柱溫30℃。
1.4.2 L-乳酸質量濃度 用SBA-40C生物傳感分析儀測定。L-乳酸質量濃度與乳酸總質量濃度之比即為L-乳酸的光學純度。
1.4.3 殘糖質量濃度 DNS法。
2 結果與討論
2.1 菌株的鑒定結果
經初篩得到42株產酸圈較大的菌株,經搖瓶試驗后得到菌株ES23,其L-乳酸產量最高,達到47.74 g/L,且光學純度達到99.3%,選擇該菌株做進一步研究。由圖1可知,菌株在平板上的單菌落呈圓形,稍透明,邊緣整齊,菌落呈乳白色,菌落直徑約為2.0~2.5 mm。在光學顯微鏡下觀察可知,菌體為桿狀,少數稍彎曲,單個排列,長約3.0~5.0 μm。細菌革蘭氏染色呈陽性。在一定條件下可產生芽孢,為端生。無鞭毛,能運動,為兼性厭氧菌。

圖1 菌落形態Fig.1 Colony shape
將試管中斜面培養保藏的菌株活化3代后接種到生化試驗培養基中,培養后測定其生化特性。結果見表1。菌株對不同碳水化合物的利用情況見表2。
由表1生理生化特性的測定結果可知,該菌株過氧化氫酶為陽性,VP陽性,明膠液化陰性,可分解利用淀粉。由表2可知,該菌株能利用大多數寡糖,包括纖維二糖和菊粉,但不能分解利用木糖和鼠李糖。同時做了產氣實驗,結果均不產氣。此外,糖類發酵實驗中添加了指示劑溴甲酚紫,若菌株能利用某種糖,培養基顏色可由紫變黃,根據變色時間的長短可判斷分解某種糖的快慢程度。實驗發現,該菌能迅速利用葡萄糖、麥芽糖、果糖、半乳糖和糊精;而需要較長時間才能分解乳糖、蔗糖、纖維二糖、菊粉和淀粉。
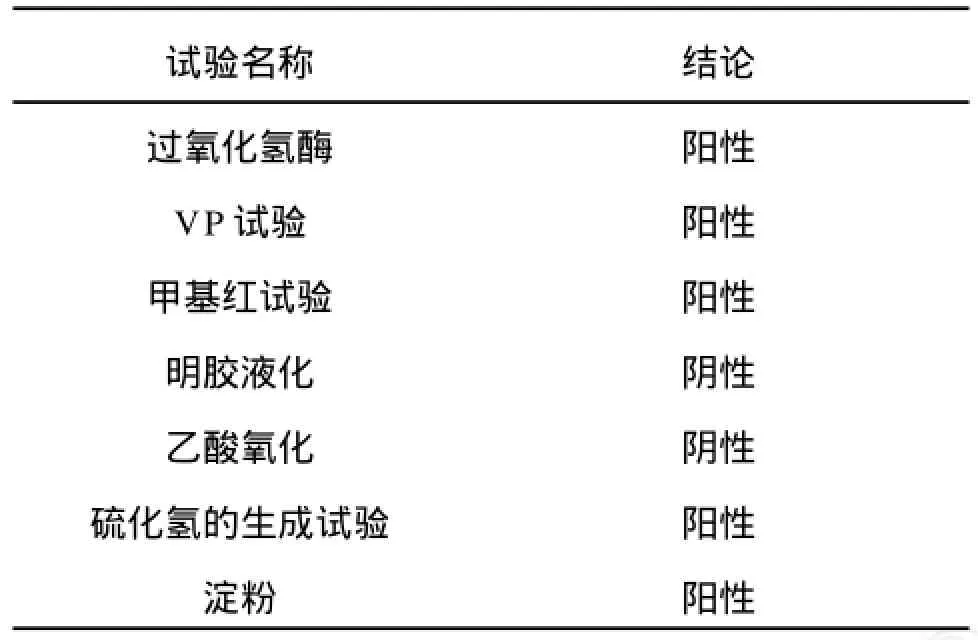
表1 菌株的生理生化實驗結果Tab.1 Results of physiological and biochemical characteristics
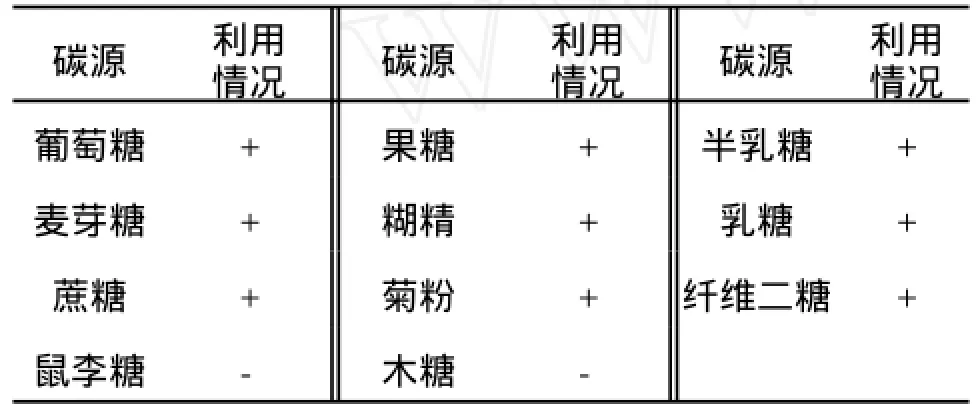
表2 菌株對不同碳水化合物的利用情況Tab.2 Utilize ability of carbon source
所測菌株的16S rDNA核苷酸序列為1 464 bp。將所測序列從GenBank數據庫中相關菌種進行比較,結果表明:該菌株與芽孢桿菌屬B acillus coagulans具有極高的同源性,為99%。結合以上生理生化結果,參照《伯杰氏細菌鑒定手冊》[9]分析比較,其生理生化指標均相同,可確定該菌株為凝結芽孢桿菌。該菌種在利用五碳糖方面與研究報道不相一致。Milind A[10]報道其分離的凝結芽孢桿菌可利用分解利用木糖發酵產乳酸,而該菌株不能分解利用五碳糖。
2.2 碳源對發酵產酸的影響
實驗選取葡萄糖、玉米糖化液、馬鈴薯淀粉糖化液,木薯糖化液,菊粉作為發酵培養基的碳源,其中初糖質量濃度為90 g/L,氮源為酵母粉與蛋白胨。并且,玉米淀粉、馬鈴薯淀粉及木薯粉均采用高溫淀粉酶及α-糖化酶進行雙酶水解。由圖2可知,葡萄糖和玉米糖化液的L-乳酸產量最高,分別為49.62 g/L和49.25 g/L,其次為馬鈴薯淀粉糖化液、木薯糖化液和菊粉。前期研究發現,該菌株可分解利用非糧作物菊粉,但幾乎不產L-乳酸,僅可從液相圖譜中檢測到乙酸、琥珀酸等雜酸。由此說明,葡萄糖是使代謝途徑大量積累乳酸的最佳碳源,考慮到成本,作者選用玉米糖化液為碳源。
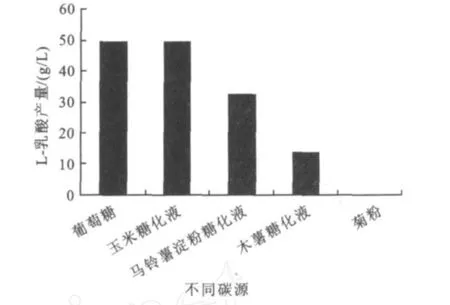
圖2 不同碳源對L-乳酸發酵的影響Fig.2 Effect of different carbon sources on L-lactic acid production
為確定碳源初始水平,以玉米糖化液為碳源,考察其對該菌株發酵生產L-乳酸的影響,結果見圖3。
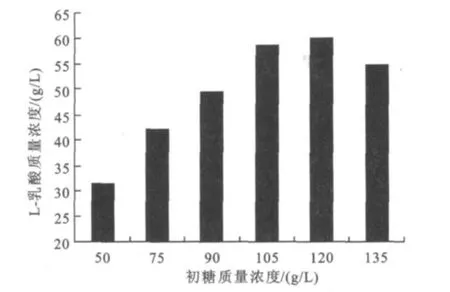
圖3 碳源質量濃度對L-乳酸發酵的影響Fig.3 Effect of concentration of glucose acid production on L-lactic acid production
當初糖質量濃度低于120 g/L時,隨著初糖質量濃度的增大,L-乳酸產量依次增大;當初糖質量濃度高于120 g/L時,L-乳酸產量下降,較高的底物質量濃度會使培養基滲透壓增大,導致菌體不能很好的生長和產酸。初糖質量濃度為105 g/L和120 g/L時,乳酸產量相差不大,分別為58.87 g/L和60.07 g/L,而后者糖的轉化率相對較低。因此最佳的碳源質量濃度為105 g/L。
2.3 氮源對發酵產酸的影響
實驗選取了一些常見氮源,包括酵母粉、蛋白胨、牛肉膏等優質有機氮源,還包括一些廉價氮源,有豆餅粉、麥根、玉米漿、棉籽蛋白,發酵結果見圖4。從圖4可以看出,所有氮源中,酵母粉單獨作為氮源時,L-乳酸產量最高,為52.03 g/L,這可能與酵母粉中富含豐富的氨基酸和維生素等生長因子有關。在廉價氮源中,玉米漿單獨做氮源時L-乳酸產量相對較高,為18.24 g/L。用牛肉膏單獨做氮源時,在所稀釋范圍內未檢測到L-乳酸,但從液相色譜圖中可以檢測到較多的丙酮酸、乙酸以及琥珀酸。由此可說明,營養環境條件的變化對該乳酸菌的代謝途徑改變很大。

圖4 不同氮源對L-乳酸發酵的影響Fig.4 Effect of nitrogen source on L-lactic acid production
雖然使用酵母粉單獨做碳源時L-乳酸產量最高,但相比其他氮源來說,酵母粉價格高昂,這將嚴重阻礙乳酸的大規模工業化生產。為減少成本,設計了幾組不同的氮源組合,將酵母粉與一些廉價氮源混合發酵,結果見表3。
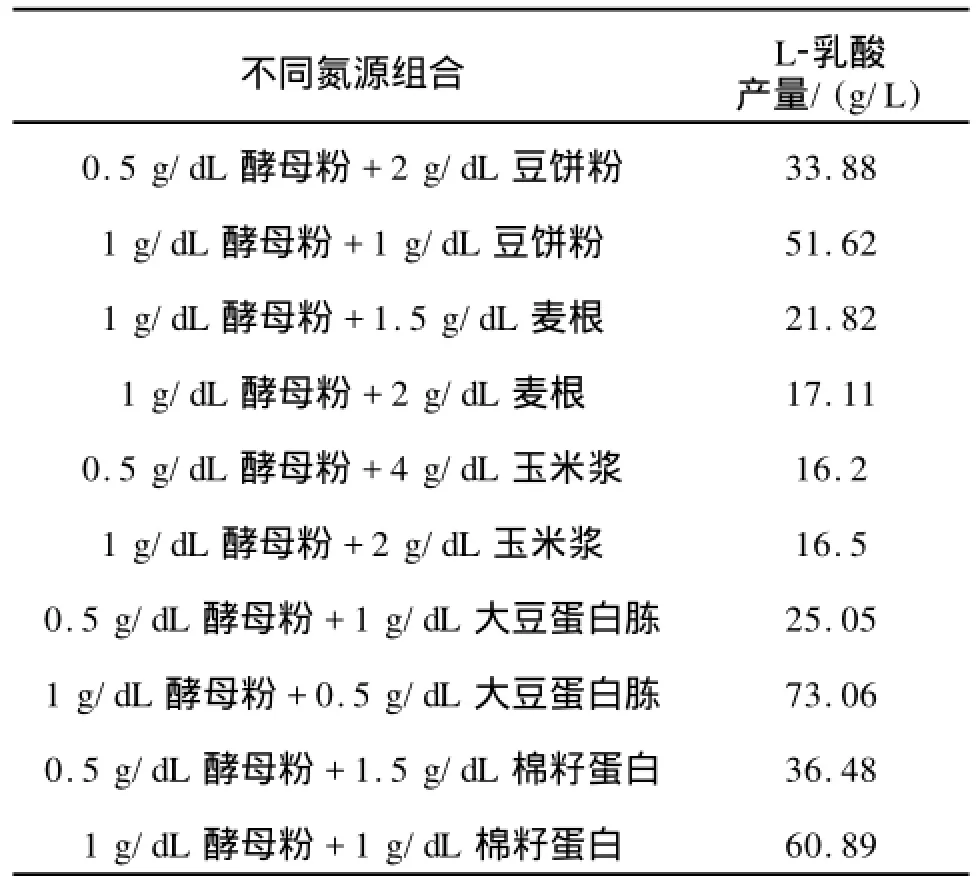
表3 復合氮源對L-乳酸發酵的影響Tab.3 Effect of mixed nitrogen sources on L-lactic acid production
由表3可知,在廉價氮源中,玉米漿單獨作氮源時L-乳酸產量較高,但與酵母粉混合后產量反而降低。豆餅粉、棉籽蛋白以及大豆蛋白胨單獨做氮源時,L-乳酸產量很低,但與酵母粉混合后,產酸量都得到了較大的提高,說明這3種氮源的營養成分與酵母粉的生長因子起到了很好的相互補充的作用。L-乳酸產量隨酵母粉添加量的增加而升高,其中大豆蛋白胨與酵母粉混合后,當酵母粉添加量由0.5 g/dL增加到1 g/dL時,L-乳酸產量增加了近3倍。雖然1 g/dL酵母粉與0.5 g/dL大豆蛋白胨混合后產酸量最高,為73.06 g/L,但大豆蛋白胨價格相比豆餅粉和棉籽蛋白來說仍較高,因而氮源應選取1 g/dL酵母粉與1 g/dL棉籽蛋白,其產酸量為60.89 g/L,此時L-乳酸產量不僅有所提高且成本降低。
2.4 金屬離子對發酵產酸的影響
微生物在生長繁殖和產物合成中都需要無機鹽和一些微量元素,這些物質在較低的質量濃度時會促進菌體的生長和產酸,而在高質量濃度時常表現出顯著的抑制作用。作者考察了MnSO4·H2O, FeSO4·7H2O及MgSO4·7H2O對L-乳酸發酵的影響。結果見表4。由表4可知,Mn2+、Fe2+、Mg2+都可在一定程度上提高L-乳酸產量,其最佳質量濃度分別為0.05,0.04,0.6 g/L。
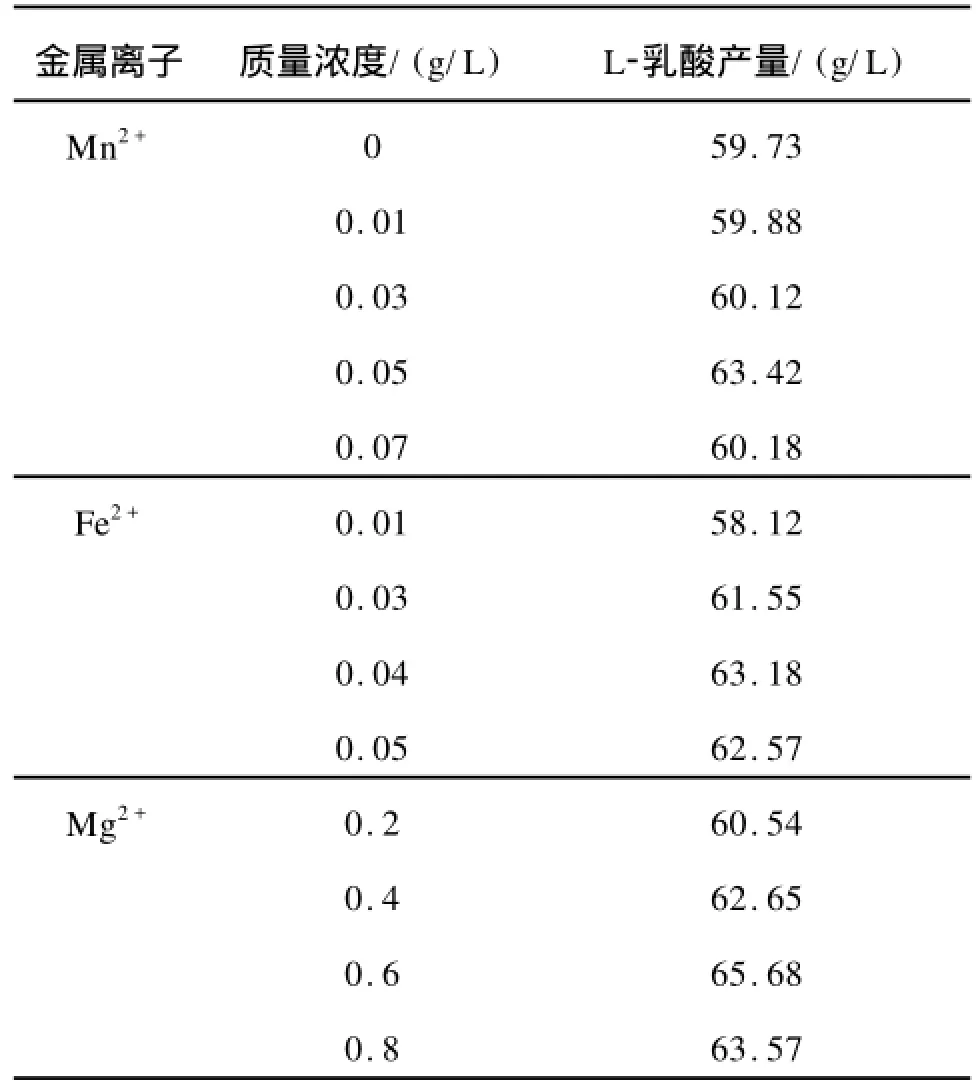
表4 金屬離子對L-乳酸發酵的影響Tab.4 Effect of metal ions on L-lactic acid production
3 結 語
作者對實驗室分離出的一株產L-乳酸的菌株進行了生理生化試驗、糖發酵試驗、16S rDNA序列測定,確定該菌株為凝結芽孢桿菌。為進一步了解該菌株生產L-乳酸的能力,對其營養條件進行了研究,初步確定玉米糖化液為最適碳源,其最佳質量濃度為105 g/L;復合氮源中1 g/dL酵母粉和0.5 g/dL大豆蛋白胨L-乳酸產量最高;而1 g/dL酵母粉與1 g/dL棉籽蛋白混合后產酸量雖較前者有所降低,但成本已大大降低。金屬離子Mn2+、Fe2+、Mg2+都可在一定程度上提高L-乳酸產量。
采用該菌株發酵生產L-乳酸的產量雖不及當前國內外所報道的產量,但該菌有很多優點,如該菌株光學純度高,產芽孢可使保藏容易,發酵溫度較高可耐高溫發酵,并且培養基可以在未滅菌的條件下發酵,這將節約因滅菌而消耗的能量,從而降低發酵成本。若對該菌株進行菌種改造,或通過發酵過程優化、代謝流量控制等措施來進一步提高其合成L-乳酸的能力,那么該菌將是很有潛力的一株發酵生產L-乳酸的菌株。
[1]錢志良,勞含章,王健,等.工業乳酸發酵的近期進展[J].生物加工過程,2003,1(1):23-27.
QIAN Zhi-liang,LAO Han-zhang,WANGJian,et al.Recent advances in indusrial lactic acid production by mircooriganisms[J].Chinese Journel of Bioprocess Engineering,2003,1(1):23-27.(in Chinese)
[2]仇俊鵬,徐巖,阮文權.L-乳酸發酵的代謝調控育種及發酵影響因素的研究[J].微生物學通報,2007,34(5):929-933.
QIU Jun-peng,Xu Yan,Ruan Wen-quan.The metabolic control breeding of L-lactic acid fermentation and optimization of media and cultivation conditions[J].Microbiology,2007,34(5):929-933.(in Chinese)
[3]趙博,周帥,馬翠卿,等.乳桿菌L actobacillussp.lxp發酵高產L-乳酸研究[J].生物加工過程,2005,3(4):74-77.
ZHAO Bo,ZHOU Shuai,MA Cui-qing,et al.Study on high yield L-lactic acid fermentation by aL actobacillus sp[J].Chinese Journal of Bioprocess Engineering,2005,3(4):74-77.(in Chinese)
[4]Ding Shao-feng,Tan Tian-wei.L-lactic acid production byL actobacillus caseifermentation using different fed-batch feeding strategies[J].Process Biochemistry,2006,41:1451-1454.
[5]諸葛健,王正祥.工業微生物實驗技術手冊[M].北京:中國輕工業出版社,1994:170-178.
[6]凌代文,東秀珠.乳酸細菌分類鑒定及試驗方法[M].北京:中國輕工業出版社,1999.
[7]李丹,陳麗,李富強,等.一株產低溫堿性蛋白酶海洋細菌Pseudoalteromonas f lavipulchraHH407的篩選與生長特性[J].食品與生物技術學報,2007,26(6):74-80.
LI Dan,CHEN Li,LI Fu-qiang.Isolation and physiological characterization of a marine psychrotrophPseudoalteromonas f lavipulchraHH407 producing cold-active alkaline protease[J].Journal of Food Science and Biotechnology,2007,26(6): 74-80.(in Chinese)
[8]路福平,戚薇.芽孢乳酸菌產乳酸條件的研究[J].天津輕工業學院學報,1998,(2):10-14.
LU Fu-ping,QI Wei.Study on optimum process produced lactic acid byBacillus coagulan[J].Journal of Tian Jin Institute of Light Industry,1998,(2):10-14.(in Chinese)
[9]Garrity G M,Bell J,Liibum G.Bergey’s Manual of Systematic Bacteriology(second edition)[M].New York:Berlin Heidelberg,2004.
[10]Milind A Patel,Mark S.Isolation and characterization of acid-tolerant,thermophilic bacteria for effective fermentation of biomass-derived sugars to lactic acid[J].American Society for Microbiology,2006,72(5):3228-3235.
(責任編輯:李春麗)
Screening,Identification of a Bacteria Strain for the Production of L-lactic Acid
GAO Jiang-jing1, YAN Qun2,3, RUAN Wen-quan*2,3
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;3.School of Environmental and Civil Engineering,Jiangnan University,Wuxi 214122,China)
A bacteria strain was isolated and identified for L-lactic acid production in this study, The isolated strain was identified asB acillus coagulansbased on the results of 16S rDNA,the physiological characteristicsandthebiochemicalproperties.Thentheoptimumnutrient conditions was determined by the single factor experiments and list as fellows:10.5 g/dL corn syrup,1 g/dL yeast extract,1 g/dL cotton-seed protein.Furthermore,it was found that the presence of Mn2+、Fe2+and Mg2+in the medium can enhance L-lactic acid production.
identification,16SrDNA,B acillus coagulans,L-lactic acid
TQ 920.1
:A
1673-1689(2010)03-0453-05
2009-03-12
江蘇省科技支撐-社會發展項目(BE 2008607)。
*通訊作者:阮文權(1966-),男,上海人,工學博士,教授,博士生導師,主要從事環境生物技術方面的研究。Email:wqruan@jiangnan.edu.cn。

