無花果曲霉固態發酵中菊粉酶的提取工藝
陳天祥, 陳寒青, 陳曉明, 于陽, 徐學明, 金征宇*
(1.食品科學與技術國家重點實驗室,江南大學,江蘇無錫 214122;2.江南大學食品學院,江蘇無錫 214122)
無花果曲霉固態發酵中菊粉酶的提取工藝
陳天祥1,2, 陳寒青1,2, 陳曉明1,2, 于陽1,2, 徐學明1,2, 金征宇*1,2
(1.食品科學與技術國家重點實驗室,江南大學,江蘇無錫 214122;2.江南大學食品學院,江蘇無錫 214122)
對無花果曲霉固態發酵中菊粉酶的提取工藝進行了研究。主要研究了溶劑種類、提取時間、固液質量體積比、振蕩頻率和提取溫度等因素對酶活的影響,確定了最佳提取工藝:以p H為4.5的0.1 mol/L醋酸緩沖液為提取溶劑,提取時間40 min,固液質量體積比1∶20.5,振蕩頻率為207 r/min,提取溫度39.6℃,菊粉酶的提取得率相對于初始提取條件可以提高50%以上。
無花果曲霉;菊粉酶;固態發酵;提取工藝
菊粉酶是一種主要來源于微生物的多糖水解酶,可催化水解菊粉中的β-2,1糖苷鍵,生產高果糖漿和低聚果糖[1-3]。低聚果糖是一種水溶性膳食纖維,具有低熱能值、抗齲齒、增殖腸道內雙歧桿菌等優點,是常用的功能性食品添加劑。利用菊粉酶水解菊粉生產果糖,相對于傳統的淀粉轉化法,果糖得率可由45%提高到90%以上。菊粉酶的生產,傳統方法一般采用液態發酵。近年來,也有學者報道使用固態發酵法生產菊粉酶[4-7]。
固態發酵相對于液態發酵具有成本低、工藝簡單、產酶活力高等眾多優點,在酶制劑生產上具有巨大的潛力。但在固態發酵中,各種發酵代謝產物在固體曲中高濃度積累,這也為下游工程的處理帶來了困難。目前對固態發酵的研究大多集中在微生物發酵方面,對如何有效地把發酵代謝產物從固體曲中提取出來研究較少,而在整個生物工藝過程中,產物的回收成本占整個生產成本的80%以上,因而研究固體曲中發酵產物的提取具有重要意義[8]。Ramadas[9]等利用雙水相法從固態發酵基質中提取淀粉葡糖苷酶;Ikasari[10]等研究了不同條件下固體曲中蛋白酶的提取效果;Castilho[11]等采用了不同的實驗模型研究了固態發酵中果膠酶的提取;Marcio Mazutti[12]等利用酵母固態發酵甘蔗渣生產菊粉酶,并研究了菊粉酶的提取條件。
作者利用無花果曲霉固態發酵生產菊粉酶,系統研究了固體曲中菊粉酶的提取工藝,主要考察了溶劑種類、時間、溫度、振蕩頻率和固液質量體積比等因素對菊粉酶提取得率的影響。
1 材料和方法
1.1 材料
1.1.1 菌種 無花果曲霉,作者所在實驗室保存。
1.1.2 主要試劑和設備 菊粉:優級純,Sigma公司,用于酶活測定;菊芋粉:由菊芋洗凈、去皮、切片,50℃烘干粉碎而得,用于培養基;SW-CJ-1F雙人單面超凈工作臺:蘇州安泰空氣技術有限公司產品;HYG-A型回轉恒溫調速搖瓶柜:江蘇太倉市實驗設備廠產品;UV-2100紫外分光光度計:尤尼科上海儀器有限公司產品;HH-6數顯恒溫水浴鍋:江蘇省金壇市儀器制造有限公司產品;THZ-82A水浴恒溫振蕩器:金壇市榮華儀器制造有限公司產品。
1.1.3 培養基
1)斜面培養基(g/L):馬鈴薯(洗滌,去皮,切碎)200,葡萄糖15,瓊脂20。
2)種子培養基(g/L):菊粉20,蛋白胨20,酵母膏10。
3)固體培養基:250 mL三角瓶中添加固體基質麩皮10 g,菊芋粉11.47%,NH4H2PO40.76 %,NaCl 0.5%,MgSO40.05%,ZnSO40.01%, KH2PO40.1%,玉米漿5.71%,吐溫-80 0.5%(均為相對于固體基質的質量分數),固液質量體積比1 g∶1.3 mL,初始p H 5.5。
1.2 方法
1.2.1 培養方法
1)斜面培養方法:30℃培養72 h。
2)種子培養方法:250 mL的三角瓶裝液30 mL,121℃滅菌15 min,接種后,30℃、200 r/min搖瓶培養24 h。
3)固態培養方法:接種后,121℃滅菌30 min, 28℃靜止培養72 h,期間翻曲3~4次。
1.2.2 菊粉酶的提取 實驗所用固體發酵曲均來自同一批發酵樣,經混勻后在-20℃冰箱保存備用。每次取出一定量發酵曲,加入一定比例溶劑,振蕩提取一定時間后,紗布過濾,獲得濾液,然后在5 000 r/min離心機上離心10 min,取上清液,并記錄體積[7]。
1.2.3 菊粉酶測定 采用3,5-二硝基水楊酸(DNS)法[8]測定,具體測定方法如下:取0.2 mL粗酶液,加入2 mL底物(質量分數2%蔗糖溶液,用p H4.5的0.2 mol/L醋酸緩沖液配制),50℃反應30 min后,沸水浴5 min使酶失活,然后冷卻至室溫,測定水解物中還原糖含量。在相同條件下,以直接在沸水浴中加熱5 min失活的酶液作對照。菊粉酶活力單位定義為:在上述條件下,以每分鐘轉化生成1μmol還原糖所需的酶量為一個酶活力單位(U)。
1.2.4 響應面試驗 采用可旋轉中心組合設計方法進行試驗設計,以液固質量體積比、振蕩頻率、溫度3個因素作為自變量,以提取的菊粉酶酶活(Y)為響應值,設計3因素5水平的響應面試驗。試驗結果利用SAS8.1軟件分析。

表1 試驗設計因素水平編碼表Tab.1 Factors and levels of experimental design
2 結果與討論
2.1 溶劑種類對菊粉酶提取的影響
溶劑種類對菊粉酶提取效果的差異主要是由于溶劑離子強度和極性的不同。各種溶劑的提取效果如表2所示。

表2 溶劑種類對提取效果的影響Tab.2 Effect of different solvents on inulinase extraction
表2顯示,溶劑的使用能減少菊粉酶的損失,其中提取效果最好的是p H 4.5的0.1 mol/L乙酸-乙酸鈉緩沖液,相對于蒸餾水提取,菊粉酶酶活提高了22.9%。這與文獻報道的結果相似,Marcio Mazutti[12]等利用p H4.8的0.1 mol/L乙酸-乙酸鈉緩沖液提取菊粉酶,相對于蒸餾水提取,菊粉酶酶活提高了14.1%。
2.2 響應面試驗結果
可旋轉中心組合試驗設計的結果如表3所示。
通過SAS軟件對試驗數據進行二次多項回歸擬合,得到二次多項式回歸模型為:
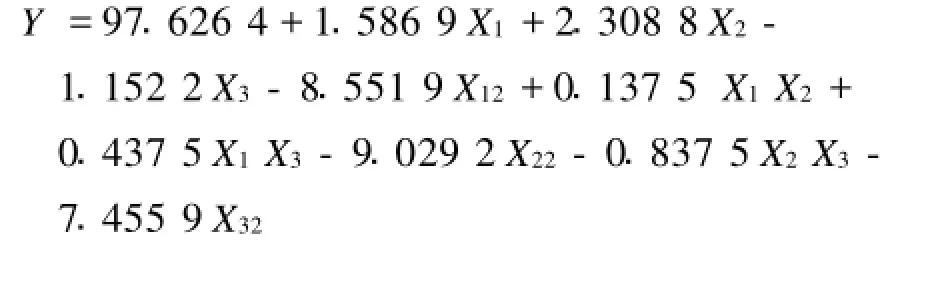
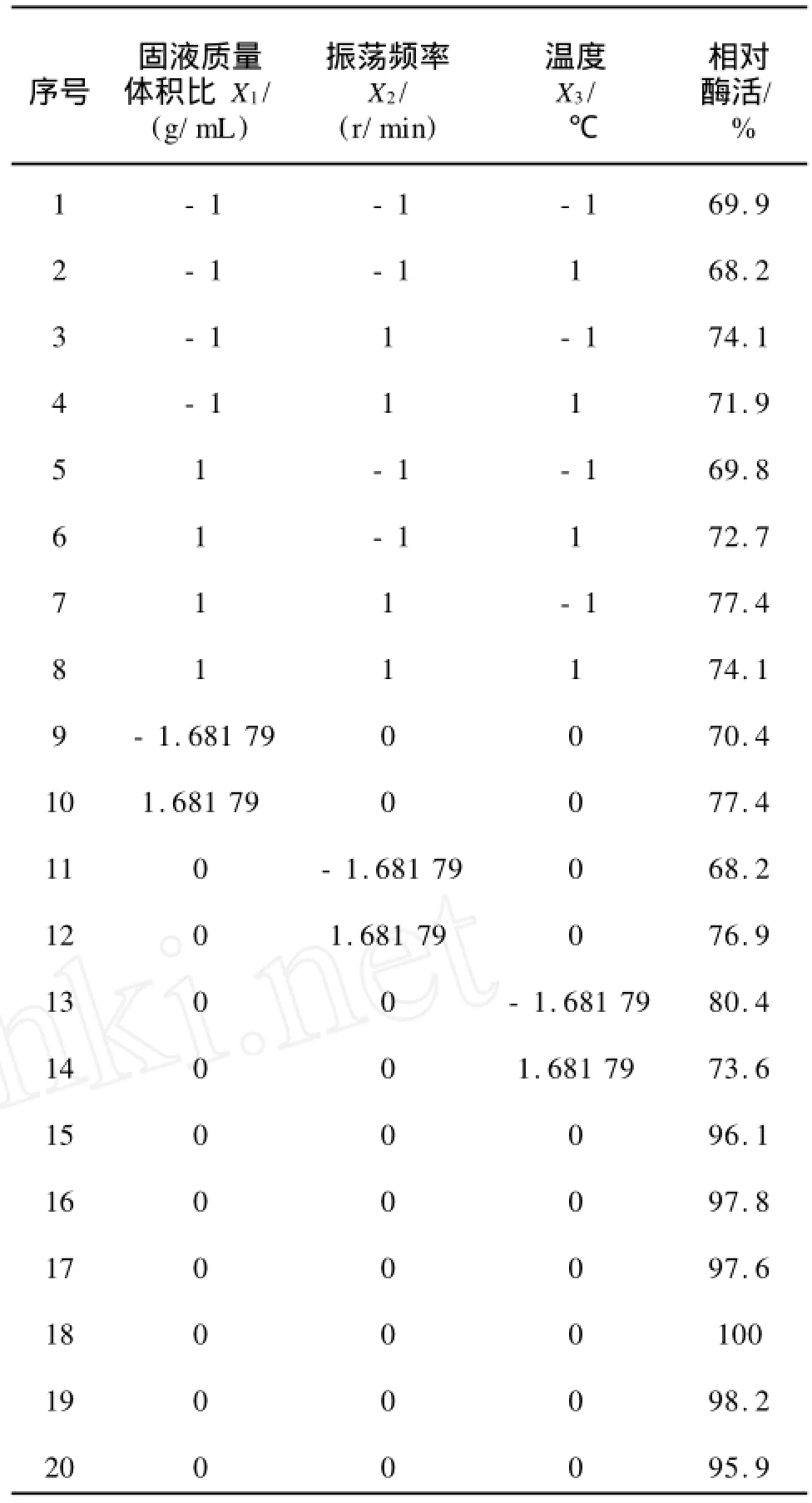
表3 試驗設計與結果Tab.3 Experimental design and results
表4方差分析結果顯示,該模型極顯著((Pmodel>F)=0.0001),SAS軟件的分析結果顯示,該模型的決定系數為98.96%,表示僅有1.04%的變更無法用該模型解釋。因此,該模型與實際情況擬合良好,具有較好的代表性,可以對實驗結果進行分析和預測。
表4方差分析顯示,X1、X2、X12、X22和X32的置信度均大于99%,對菊粉酶的提取具有極顯著影響,X3的置信度大于95%,對菊粉酶的提取具有顯著影響。X1X2、X1X3、X2X33項的置信度均小于90%,表明3項之間無明顯交互作用。
在提取過程中,酶能否充分溶散在溶劑中影響著提取效果,這不但與溶劑的加入量有關,而且還與溶劑對固體基質的溶解能力有關,提取過程中,振蕩可以加快酶在溶劑中的擴散和溶解,但是振蕩頻率過大會加大酶的機械損傷,從而使酶失活。溫度也是影響提取效果的重要因素,溫度過低可能會影響固體基質及酶在溶劑中的溶解效果,溫度過高則酶的熱穩定性下降,酶易失活。
經SAS軟件分析,當X1(固液質量體積比)=1 g∶20.5 mL,X2(振蕩頻率)=207 r/min,X3(溫度) =39.6℃時,Y值達到最大,即菊粉酶提取效果最好。
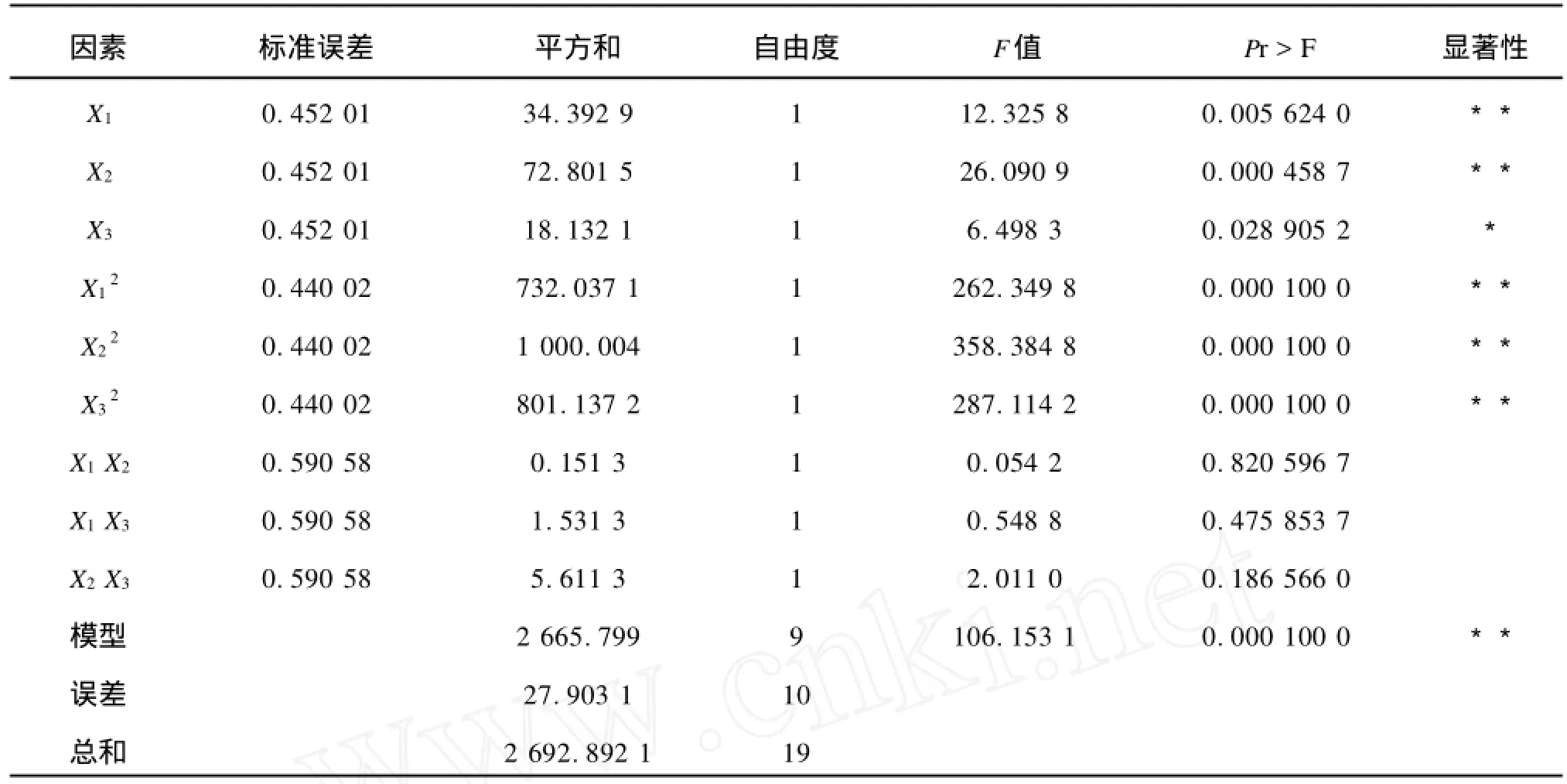
表4 方差分析表Tab.4 Analysis of variance of the regression parameters
2.3 提取時間對菊粉酶提取的影響
在確定了提取溶劑、振蕩頻率、溫度和固液質量體積比等因素后,對菊粉酶提取所需的最佳時間進行了考察。時間的長短與酶的溶散效果、所受的機械損傷程度、熱失活程度等都有關系,由圖1可知,菊粉酶最佳提取時間為40 min。
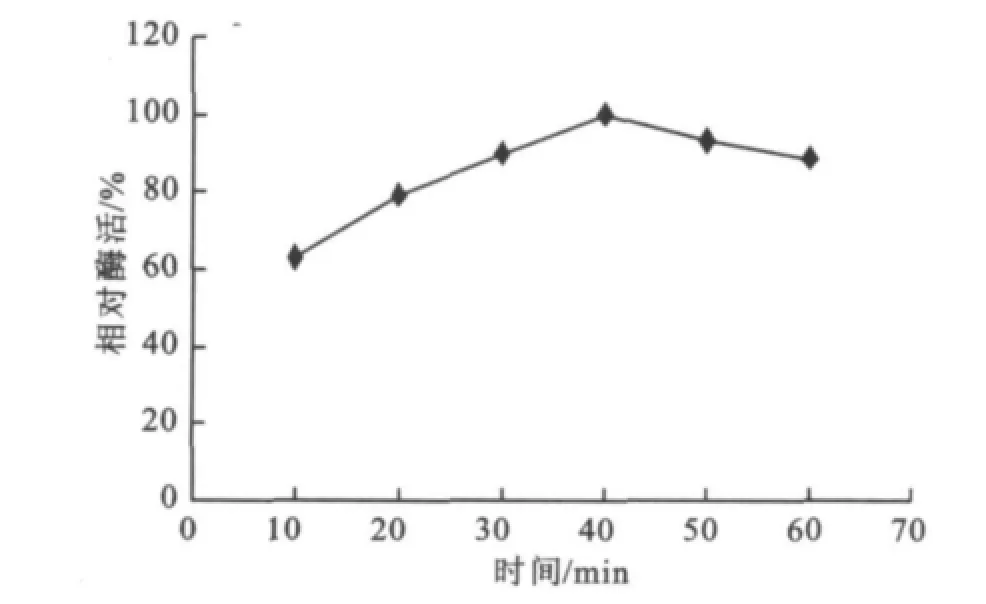
圖1 提取時間對菊粉酶提取的影響Fig.1 Effect of time on the extraction of inulinase
根據以上所優化的提取條件,對提取效果進行驗證,即在提取溶劑為p H 4.5的醋酸緩沖液,固液質量體積比為1 g∶20.5 mL,振蕩頻率為207 r/ min,溫度39.6℃,提取時間40 min條件下對菊粉酶進行提取,相對于最初的以水為提取溶劑,固液質量體積比為1 g∶20 mL,振蕩頻率為150 r/min,溫度常溫,提取時間60 min條件下,菊粉酶的提取得率提高了50%以上。
3 結 語
對無花果曲霉固態發酵中菊粉酶的提取工藝進行了研究,主要考察了溶劑種類、提取時間、溫度、振蕩頻率、固液質量體積比等影響菊粉酶提取效果的因素。菊粉酶最佳的提取工藝為:以p H4.5的0.1 mol/L醋酸緩沖液為提取溶劑,提取時間40 min,固液質量體積比1 g∶20.5 mL,振蕩頻率207 r/min,提取溫度39.6℃,菊粉酶的提取得率,相對于初始提取工藝,可提高50%以上。
[1]謝秋宏,相宏宇.一步酶法水解菊粉生產高果糖漿[J].吉林大學自然科學學報,1997(2):103-105.
XIE Qiu-hong,XIANG Hong-yu.Production of high—fructose syrup by inulinase fromJerusalem artichokes[J].Acta Scientiarium Naturalium Universitatis Jilinensis,1997(2):103-105.(in Chinese)
[2]王靜.Aspergillus f icuum菊粉酶及其酶解菊芋制備低聚果糖的研究[D].無錫:江南大學,2003.
[3]彭英云.Aspergillus f icuumSK004產外切菊粉酶及其酶解菊粉制備高果糖漿的研究[D].無錫:江南大學,2005.
[4]Chen X,Wang J H,Li D S.Optimization of solid-state medium for the production of inulinase byKluyveromycesS120 using response surface methodology[J].Biochemical Engineering Journal,2007,34:179-184.
[5]Selvakumar P,Pandey A.Solid state fermentation for the synthesis of inulinase fromStaphylococcus sp.andKluyveromyces marxianus[J].Process Biochemistry,1999,34:851-855.
[6]Mazutti M,Bender J P,Luccio M D,et,al.Optimization of inulinase production by solid-state fermentation using sugarcane bagasse as substrate[J].Enzyme and Microbial Technology,2006,39:56-59.
[7]陳雄,王金華,李世杰.克魯維酵母固體發酵高產菊粉酶的研究[J].食品科學,2005,26:54-57.
CHEN Xiong,WANG Jin-hua,LI Shi-jie.High yield of inulinase fromKluyveromycesS120 by solid-state fermentation [J].Food Science,2005,26:54-57.(in Chinese)
[8]Pessoni R A B,Figueiredo-Ribeiro R C L,Braga M R.Extracellular inulinases fromPenicillum janczewskii,a fungus isolated from the rhizosphere of Vernonia herbacea(Asteraceae)[J].Journal of Applied Microbiology,1999,87:141-147.
[9]Ramadas M,Holst O,Mattiasson B.Extraction and purification of amyloglucosidase produced by solid state fermentation withAspergillus niger[J].Biotechnology Techniques,1995,9:901-906.
[10]Ikasari K,Mitchell D A.Leaching and characterization of Rhizopus oligosporus acid protease from solid-state fermentation[J].Enzyme and Microbial Technology,1996,19:171-175.
[11]Castilho L R,Alves T L M,Medronho R A.Recovery of pectolytic enzymes produced by solid state culture ofAspergillus niger[J].Process Biochemistry,1999,34:181-186.
[12]Bender J P,Mazutti M A,Luccio M D,et,al.Extraction of inulinase obtained by solid state fermentation of sugarcane bagasse byKluyveromyces marxianusNRRL Y-7571[J].Applied Biochemistry and Biotechnology,2008,149:195-203.
(責任編輯:朱明)
Extraction Technology of Inulinase fromAspergillus f icuum by Solid State Fermentation
CHEN Tian-xiang1,2, CHEN Han-qing1,2, CHEN Xiao-ming1,2, YU Yang1,2, XU Xue-ming1,2, J IN Zheng-yu*1,2
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The target of this study is to develop a efficient extract process of inulinase fromAspergillus f icuumby solid state fermentation.For this,the extract process parameters were carefully investigated and listed as follows:0.1 mol/L sodium acetate buffer of p H 4.5 was used for extraction solvent,the ratio of solid to liquid of 1:20.5,temperature of 39.6 C,stirring rate of 207 r/min,extraction time of 40 min.By the optimum conditions,the enzyme recovery yield was increased by more than 50%,when compared with that of the initial conditions.
Aspergillus f icuum,inulinase,solid-state fermentation,extraction technology
Q 814.1
:A
1673-1689(2010)03-0421-05
2009-06-25
國家863計劃項目(2006AA10Z333),中國博士后科學基金項目(20070420968),江蘇省博士后科研資助計劃項目(0801007B)。
*通信作者:金征宇(1960-),男,江蘇揚州人,工學博士,教授,博士生導師,主要從事碳水化合物研究。Email:jinlab2008@yahoo.com

