大學化學中若干平衡問題的理解和思考
吳振玉 裘靈光 宋繼梅 李村 朱維菊
(安徽大學化學化工學院 安徽合肥230039)
大學化學中若干平衡問題的理解和思考
吳振玉 裘靈光 宋繼梅 李村 朱維菊
(安徽大學化學化工學院 安徽合肥230039)
在教學中,通過引導學生對一些平衡問題的基本概念進行深入思考和討論,指導學生對有關數學問題進行嚴密推導和論證,既提高了學生解決實際問題的能力,又培養(yǎng)了學生嚴密的科學思維和嚴謹的科學態(tài)度。
在大學化學教學中,有關平衡問題的概念和理論涉及熱力學平衡、酸堿平衡、沉淀溶解平衡、氧化還原平衡、配位平衡等問題。在教學中,引導學生對一些基本概念進行較為深入的思考和討論,對其中涉及的一些數學問題,利用其實際物理和化學意義,根據需要對數學公式進行變通和化簡,或對涉及的數學問題進行嚴格的推導和論證,以激發(fā)學生的學習興趣。下面以緩沖溶液pH計算與質子平衡和化學平衡與自發(fā)變化為例進行簡單介紹。
1 緩沖溶液pH計算與質子平衡
PBE(質子平衡式,proton balance equation)法是計算溶液氫離子濃度的基本依據,通過此法可以得到計算溶液中氫離子濃度的精確計算式,還可以根據一定的條件分別得到近似式和最簡式。相關文獻[1-6]雖然對PBE的變通寫法和化簡方法做了一些討論,但是很少有直接利用PBE計算緩沖溶液pH的方法介紹。因此,我們在教學中引導學生在這方面進行了討論和思考。以下以一元弱酸HA及其鹽NaA(設其初始濃度分別為ca和cb,并設HA電離部分及A-水解部分的濃度分別為x和y)組成的緩沖體系為例,演示PBE的變通寫法和直接利用PBE推導緩沖溶液pH計算的精確式、近似式和最簡式的變通及化簡方法。
首先,寫出PBE,利用平衡常數關系找出PBE中各物種的表達式(為簡便起見,公式推導中省略c?)。
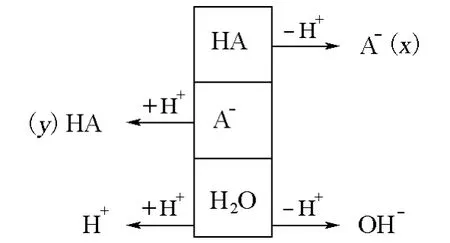
根據PBE的意義可知,該體系的質子平衡式如下:

由HA的電離平衡和A-的水解平衡可知ca、cb與x和y的關系如下:
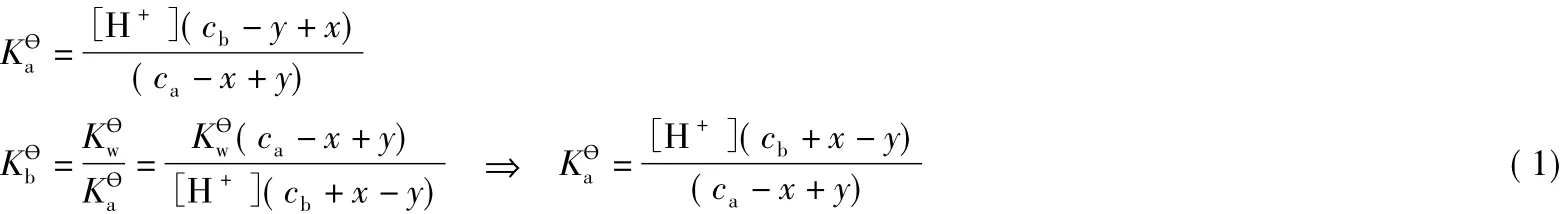
解(1)得:

把式(2)帶入PBE中,得到緩沖溶液pH的精確式計算如下:

式(3)和式(3')即是緩沖溶液pH計算的精確式。


式(4)經整理后為:

當pH>8時,忽略x(電離生成的H+很少,即對應的x也很小),即式(1)和式(2)中去掉x,把去掉x后的式(2)帶入PBE的表達式,結果仍然如式(3)。式(3)可整理為如下形式:
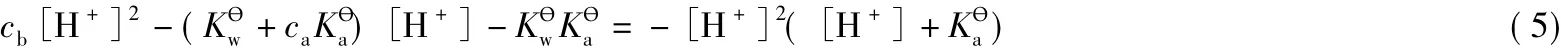
當pH>8時,[H+]2([H+]+)≈0,所以式(5)可變?yōu)?

式(6)即緩沖溶液pH的另一種近似計算式。把精確式(3')整理為如下形式:

通常情況下,緩沖溶液pH不會太小,而且其ca或cb均較大,遠遠大于或,也比大得多,即把以上條件帶入式(7),得到緩沖溶液pH計算的最簡式如下:

以上直接利用PBE推導所得緩沖溶液pH計算的精確式、近似式和最簡式與文獻[1]一致。通過以上推導引導學生理解和思考緩沖溶液pH計算的問題,不僅可以使學生更好地理解PBE的概念,明白緩沖溶液pH計算中精確式、近似式和最簡式的關系,而且可以學會如何對具有實際物理和化學意義的數學公式進行變換,達到解決問題的目的。
2 化學平衡與自發(fā)變化
在大學化學教材中[6-10],化學平衡與自發(fā)方向這一內容涉及許多基本概念。引導學生對相關概念進行歸納總結,區(qū)分其異同,可以準確地理解和掌握這些基本概念。
2.1 自發(fā)變化與系統(tǒng)(體系)
一般的大學化學教材[1,7]中,都是用類似“不需外力,任其自然,即可自動進行”的語言描述自發(fā)變化,并列舉溫度傳遞、濃度擴散、水往低處流、鐵生銹等自發(fā)變化的實例。但是學生對如反應CaCO3(s)CaO(s)+CO2(g)高溫自發(fā)的描述不容易理解,既然是高溫,必定借助了外力進行加熱,怎么又說是自發(fā)呢?針對上述問題引導學生從“體系(系統(tǒng))與環(huán)境”這個熱力學的基本概念出發(fā),就能夠更好地加深理解。上例中高溫自發(fā)的前提是指我們選擇的體系本身已處于高溫,符合“不需外力,任其自然,即可自動進行”的自發(fā)變化條件,而不需要借助外力再進行加熱或降溫。可引導學生從本例討論“體系(系統(tǒng))”與“環(huán)境”的劃分。
2.2 各種平衡常數
在確定化學勢中各物質的標準態(tài)后,把反應系統(tǒng)中各物質的化學勢代入系統(tǒng)的Gibbs自由能表達式中,并引入條件fB≈pB,ax,B≈xB,ac,B≈cB,am,B≈mB,可以推導出各種標準平衡常數(熱力學平衡常數)。即:①純氣相反應中的標準平衡常數;② 溶液中反應的標準平衡常數、和;③固體溶液中的反應,其標準平衡常數與溶液中反應的熱力學平衡常數類似。
應用注意:多相反應的標準平衡常數中,氣體用相對分壓p/p?表示,溶液中的溶質用相對濃度c/c?表示,因為對于純態(tài)凝聚相aB=1,所以純態(tài)凝聚相不出現在平衡常數表示式中。另外,還要注意標準平衡常數與Δr對應,經驗(或實用)平衡常數Kp,Kc,Kx并不與Δr產生直接的聯(lián)系,在應用計算中要考慮逸度系數及活度系數時,需要用以逸度或活度表示的平衡常數。
從以上思路引導學生對各種平衡常數進行歸納總結,有助于學生理解和記憶這些繁雜的概念。
2.3 Δr、ΔrGm與K?、Q(反應熵)
在學習化學反應等溫方程式時,學生很容易混淆概念,把處于Δr時的反應系統(tǒng)與已經達到化學平衡時的反應系統(tǒng)等同起來。事實上,反應系統(tǒng)處于Δr時,Q=1;處于平衡時,Q =K?,ΔrGm=0。反應系統(tǒng)處于Δr時,其反應的自發(fā)方向取決于該反應的K?是大于1還是小于1;大于1則正向自發(fā),小于1則逆向自發(fā)。例如酸堿平衡中的和,沉淀溶解平衡中的,配位平衡中的等遠遠小于1,因此處于Δr時的反應系統(tǒng),朝著生成弱酸、弱堿、沉淀或配合物的方向自發(fā)進行。
2.4 K?與和
一般教材中都會講到幾種平衡常數的換算關系,特別是對于氣相反應中的與,但是化學反應等溫方程式中的K?通常并沒有給出下標,以限定是標準壓力平衡常數還是標準濃度平衡常數。因而學生經常會問:對氣相反應而言化學反應等溫方程式中的K?用或是否都可以?顯然,對于同一個反應體系,除個別情況(反應前后氣體分子數不變)下,和并不相等,而同一個反應體系的Δr是確定的,因此和不能隨便使用。在教學中可以引導學生從標準平衡常數的導出來討論這個問題,通過文獻閱讀和分析可知:由于推導不同標準平衡常數時,所用的各物質化學勢中的標準態(tài)不同[6-10],因而與不同標準平衡常數對應的ΔrG也不同。通常對氣相反應取壓力標準平衡常數及對應的(T)而得到Δr;溶液中的反應用濃度標準平衡常數;對復相(或多相)反應,氣體和溶質則分別取相對分壓力、相對濃度以及對應的(T),而得到Δr,所以對復相(或多相)反應,K?不指明是標準壓力平衡常數還是標準濃度平衡常數。總之,對氣相反應而言,一般用,如果用帶入等溫方程式,則需要乘一個相應的換算系數。
2.5 為什么化學反應通常不能進行到底
在等溫等壓下,當反應物化學勢的總和大于產物化學勢的總和時,為什么化學反應通常不能進行到底?為了解答這一問題,教材[7]中以理想氣體混合物的反應D(g,T,p)+E(g,T,p)2F(g,T,p)為例,做了簡單推導。教學中為了培養(yǎng)學生嚴密的科學思維和嚴謹的科學態(tài)度,引導學生利用學習過的微積分知識對該例進行嚴格的數學證明,以嚴格的數學語言回答化學反應通常不能進行到底的原因,具體證明如下:

設反應從D,E開始,且其物質的量各為1mol,則在任何時刻,有:
從上式消去nE,nF,得:
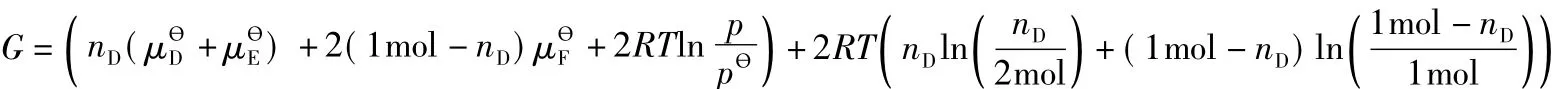
令:
得:
則:

令:

則:
得:
令:
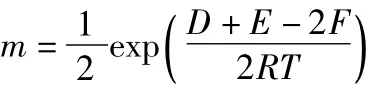
則:
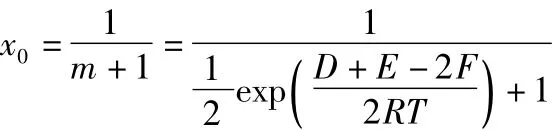
從反應的實際意義可知:D>0,E>0,F>0,R>0,T>0;且均為有界的正數。所以:
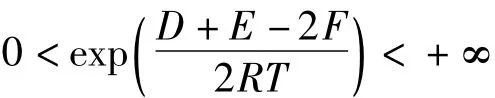
可得:x0∈(0,1)。
因為:
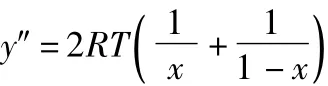
所以:
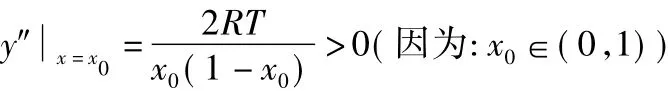
根據數學定理可知:x=x0為G=y=f(x)在x∈(0,1)上唯一的極小值點,即:G=y=f(x)在x∈(0,1)上有最小值。
由實際化學反應的意義可知:G=y=f(x)在x=0和x=1處的定義為:
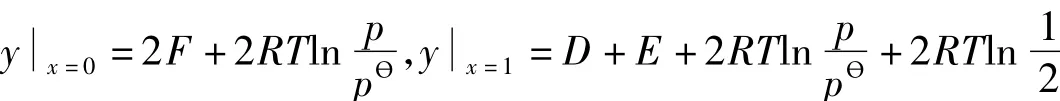
且:yx=1>yx=0。
綜上所述,可以得到G=y=f(x)的圖像(圖1)。
在本例中,反應進程ξ等于1-x,所以圖1就是文獻[7]中圖6.1及圖6.2 PTS曲線的嚴格數學證明。
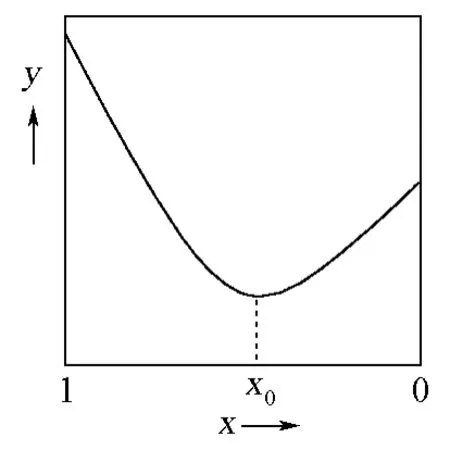
圖1 G=y=f(x)的函數圖像
[1] 武漢大學.分析化學.第3版.北京:高等教育出版社,1995
[2] 寇興明.四川師范大學學報(自然科學版),1998,21(2):238
[3] 雷良萍.大學化學,1988,3(1):55
[4] 章旭坤.化學通報,1988,51(2):43
[5] 陳玲然,張懋森.麗水師范專科學校學報,1987,9(S2):62
[6] 浙江大學.無機及分析化學.第2版.北京:高等教育出版社,2008
[7] 傅獻彩,沈文霞,姚天揚,等.物理化學(上).第5版.北京:高等教育出版社,2005
[8] 黃子卿.物理化學.北京:高等教育出版社,1955
[9] Atkins P,de Paula J.Atkins物理化學.第7版.影印版.北京:高等教育出版社,2006
[10] 北京師范大學無機化學教研室.無機化學.第4版.北京:高等教育出版社,2002

