PWS病灶皮脂腺增生與血液雄激素水平的相關性研究
胡曉潔 陳達 金云波 馬剛 陳輝 江成鴻 徐楓 李偉 林曉曦
葡萄酒色斑(Port wine stains,PWS)是一種常見的先天性毛細血管畸形,發病率約為0.3%。PWS好發于面頸部顯露部位,臨床表現為點、片狀紅斑,異常的外表常給患者造成巨大的心理壓力[1-2]。目前,激光可以有效清除部分患者的面部紅斑,恢復正常容貌。但是還有部分PWS患者病灶組織逐漸增厚,造成更嚴重的皮損,激光技術無法清除該類患者的面部紅斑[3]。
減少病灶增厚,則可能增加激光對PWS的治愈率。因此,PWS病灶增厚機制已逐漸成為該領域中研究的焦點。對增厚的PWS病灶的病理組織學研究發現,皮膚附屬器大量增生是導致病灶增生重要因素之一,尤以皮脂腺增生較為顯著。大量研究表明,雄激素是調節皮脂腺代謝的重要影響因素之一[4]。為探討增厚的PWS中皮脂腺增生與雄激素的關系,我們對PWS患者的血液中雄激素水平進行了探索。
1 資料與方法
1.1 一般資料
2009年2月至2010年2月,上海交通大學醫學院附屬第九人民醫院整形外科血管瘤與血管畸形治療中心,收治39例頭面部PWS的成年患者。其中,女性21例,病灶增厚13例,平均27.8歲(19~41歲),病灶平坦 8 例,平均 27.1 歲(19~45 歲);男性18例,病灶增厚 10例,平均 36.8歲(19~52歲),病灶平坦 8例,平均24.4歲(18~30歲)。
1.2 病理學檢測與分組
選取面部PWS病灶進行病理組織活檢,HE染色,并進行端粒酶免疫組化檢測。
根據大體觀察以及病理組織檢測結果,將PWS患者分為兩組,一組為PWS病灶平坦無增厚,無皮脂腺增生;另一組為PWS病灶增厚并伴有皮脂腺增生。
1.3 血清雄激素睪酮測定與統計學分析
對PWS患者進行血液雄激素檢測。獲取血液標本,應用化學發光免疫分析法,使用Architech系統,Testosterone試劑盒(Abbott Ireland Diagnostics Division Lisnamuck,Longford Co.Longford Ireland),檢測獲得血液中的睪酮濃度,并將檢測數據進行統計學分析。
2 結果
2.1 組織學檢查
PWS病灶未增厚患者的組織學提示,真皮層病灶內含有大量的異常擴張的毛細血管,血管內充滿紅細胞,病灶內的皮脂腺組織未見明顯增生。端粒酶免疫組化染色見少量陽性顆粒,提示病灶內皮脂腺細胞增生不活躍(圖1)。
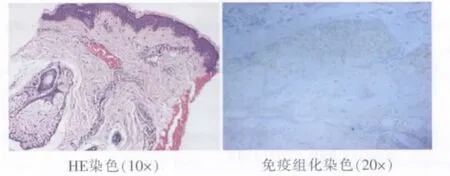
圖1 無增厚的面部PWS病灶組織學檢查
PWS病灶增厚患者的組織學提示,真皮層病灶內含有大量異常擴張的毛細血管,病灶內的皮脂腺肥大、增生明顯,腺體呈現多葉狀,每一葉可再分為許多小葉,如葡萄串狀。端粒酶免疫組化染色見大量陽性顆粒,提示病灶內皮脂腺細胞增生活躍(圖2)。

圖2 增厚的面部PWS病灶組織學檢查
2.2 血液雄激素檢測
女性PWS病灶平坦組,血液雄激素睪酮濃度為0.415±0.122 pg/mL;女性PWS病灶增厚組,血液雄激素睪酮濃度為0.625±0.245 pg/mL;兩組有顯著性差異(P<0.05)。
男性PWS病灶平坦組,血液雄激素睪酮濃度為4.561±1.166 pg/mL;男性PWS病灶增生組,血液雄激素睪酮濃度為6.353±1.688 pg/mL;兩組有顯著性差異(P<0.05)。
3 討論
PWS俗稱紅胎記,又稱鮮紅斑痣,發病率約為0.3%,是一種常見的先天性毛細血管畸形。PWS不會自行消退,好發于面頸部顯露部位,臨床表現為點、片狀紅斑,或肥厚突起高于皮面,或呈現鵝卵石狀,或結節狀,異常的外表嚴重影響患者的心理健康和社交生活[1-2]。
各種方法,如冷凍、文身、手術切除后植皮、同位素、磨削等治療手段,都曾被用來去除PWS病灶,以期能重現患者自身正常容貌,但均未獲得理想效果[5]。激光技術的應用,使得PWS的治療有了突破。上世紀80年代提出了“選擇性光熱分解理論”,并出現了脈沖染料激光,激光技術始用于PWS的治療[1,6-7]。
但是,激光技術用于治療PWS尚有局限性,對部分患者甚至毫無作用。2007年,Jasim等[7]總結認為,少于20%的患者治療后病灶會完全消退,70%患者治療后獲得50%以上的改善,另有約20%~30%的病例完全無效。深入研究發現,這些難治性病灶都存在病灶增厚并伴有皮脂腺增生。脈沖染料激光的療效主要取決于PWS病灶的血管口徑,一般認為脈沖燃料激光對直徑為50~100 μm的血管療效較好。常用的585 nm或595 nm脈沖染料激光對皮膚的穿透深度僅有0.68 mm左右,如果病灶超過一定厚度,即便異常血管的管徑在激光治療的敏感區域內,激光治療也不會產生任何療效。顯然,脈沖染料激光的療效和病灶的厚度直接相關。臨床實踐發現,治療效果差或對激光治療無反應的部位,或為暗紫色,或分布于四肢軀干,或位于面中央,其組織學特點均表現為PWS增生增厚,凸出高于皮面,嚴重者可伴有結節狀病灶,屬于病灶增厚型的PWS,證實了PWS病灶的增厚嚴重限制了激光治療效果[4]。
本研究的組織學結果提示,病灶中血管網內毛細血管和后微靜脈擴張,存在異常表現的毛細血管和后微靜脈,這是所有PWS病灶的共同特點,畸變的毛細血管和后微靜脈是產生面部紅斑的病理基礎。治療時,當激光的能量被病變的血管中的血紅蛋白吸收后,可以破壞這些畸變的毛細血管內皮細胞,致面部紅斑消退。與未增厚的PWS病灶相比,皮膚附屬器的增生是增厚的病灶病理組織學另一個主要特點,且皮脂腺增生尤為顯著。增厚的PWS病灶中出現了大量活躍、增生的皮脂腺,肥大的皮脂腺成了PWS病灶的主要結構之一,使得病灶增厚,最終削弱了激光的治療效果。
皮脂腺生理性增生機制的研究已經明確[4,8-10],其中雄激素是最重要的影響因子之一。雄激素包括:脫氫表雄酮(Dehydpi-andosterone,DHEA)、硫酸脫氫表雄酮(Dehydroepiandosterone sulfate,DHEAs)、雄烯二酮、睪酮及雙氫睪酮(Dihydrotestosterone,DHT)。其中DHEA、DHEAs、雄烯二酮是雄激素前體,睪酮是具有活性的雄激素。雄激素可以擴散進入靶組織和非靶組織,在雄激素受體存在的靶組織細胞中行使其生物學功能。皮脂腺是雄激素重要的合成組織和靶器官,皮脂腺的增殖代謝主要受到雄激素調控。雄激素進入細胞內與雄激素受體 (Androgen receptor,AR)結合,形成激素-受體復合物,進入細胞核內,激發相關基因的轉錄,誘導功能不同的蛋白質合成,產生不同的生理效應。雄激素在皮脂腺代謝中的主要作用是增加皮脂腺的活性,雄性激素分泌旺盛,可刺激皮脂腺增生、肥大,分泌過多皮脂。深入研究病灶皮脂腺細胞的生理功能與雄激素關系,將有助于了解PWS病灶增厚的病理機制和改善PWS的治療手段。為此,我們對面部PWS患者血清中雄激素睪酮的濃度進行了檢測與比較。
考慮到雄性激素在不同性別中的濃度,存在一定的差異。因此,我們按照性別對患者進行分組測定與比較,以排除性別因素對結果分析的干擾。另外,生理學研究也提示,性激素在成年人群與未成年人群中的表達存在較大差異,所以我們將病例選擇控制在成年人群。我們發現,盡管大多數患者的雄激素血液濃度在正常范圍內,但是PWS增厚皮脂腺增生患者與病灶平坦的同性患者的雄激素濃度有顯著差異,提示病灶組織的增厚與血液中雄激素水平增高存在相關性。因此,我們認為,PWS增厚皮脂腺增生,不僅受到雄激素濃度的調控,同時雄激素受體表達,以及雄激素與受體的結合過程中的變化都有可能影響PWS病灶皮脂腺的代謝。
明確雄激素與PWS病灶之間的作用關系,尚需進一步了解雄激素受體水平以及雄激素與受體結合狀態的變化情況,我們將在后續研究中對此進行探索。
[1]Cordisco MR.An update on laser in children[J].Curr Opin Pediatr,2009,21(4):499-504.
[2]Miller AC,Pit-Ten Cate IM,Watson HS,et al.Stress and family satisfaction in parents of children with facial port-wine stains[J].Pediatr Dermatol,1999,16(3):190-197.
[3]Nagore E,Requena C,Sevila A,et al.Thickness of healthy and affected skin of children with port wine stains:potential repercussions on response to pulsed dye laser treatment[J].Dermatol Surg,2004,30(1):1457-1461.
[4]Zouboulis ChC,Degitz K.Androgen action on human skin-from basic research to clinical significance[J].Exp Dermatol,2004,13(4):5-10.
[5]Clodius L.Surgery for the extensive facial port-wine stain[J].Aesth Plast Surg,1985,9(2):61-68.
[6]Chapas AM,Eichhorst K,Geronemus RG.Efficacy of early treatment of facial port wine stains in newborns:a review of 49 cases[J].Lasers Surg Med,2007,39(7):569-570.
[7]Jasim ZF,Handley JM.Treatment of pulsed dye laser-resistant port wine stain birthmarks[J].J Am Acad Dermatol,2007,57:677-682.
[8]Chen W,Thiboutot D,Zouboulisw CC.Cutaneous androgen metabolism:basic research and clinical perspectives[J].J Invest Dermatol,2002,119(5):992-1007.
[9]Fritsch M,Orfanos CE,Zouboulis CC.Sebocytes are the key regulators of androgen homeostasis in human skin[J].J Invest Dermatol,2001,116(5):793-800.
[10]Thiboutot D.Regulation of human sebaceous glands[J].J Invest Dermatol,2004,123(1):1-12.

