包裝材料對醫院制劑質量的影響
徐建東
上海市皮膚病性病醫院(200050)
國家食品藥品監督管理局于2005年6月1日起實施的《醫療機構制劑配制管理辦法》進一步加大了對醫院制劑的質量要求和抽檢力度。隨著各大醫院對自制制劑質量的重視,2006至2008年上海市藥監局對全市各大醫院制劑抽查的結果得出的結論是因檢測偏差引起的制劑質量不合格比例明顯下降,而因包裝材料問題引起的制劑不合格比例卻明顯上升,本文就因包材對制劑質量產生影響的因素作一分析。
1 包裝材料成分對自制制劑質量的影響
裝材料成分為低密度聚乙烯,對于含油類液體制劑如樟腦薄荷腦滴鼻液、液狀石蠟滴鼻液等制劑易發生滲漏現象,造成制劑外觀不合格。
2 溫度對存放于不同包裝材料中樟腦薄荷腦滴鼻液質量的影響
2.1 標準液的制備
精密稱取樟腦對照品適量,加液體石蠟溶解,并稀釋成每1mL中約含樟腦10mg的溶液。
2.2 樣品溶液的制備
精密量取本品3mL,置10mL量瓶中,加液體石蠟稀釋至刻度,搖勻。
2.3 標準曲線的繪制
精密量取標準液0.5、1.0、2.0、3.0、4.0與5.0mL分別置10mL量瓶中,加液體石蠟稀釋至刻度。搖勻,照分光光度法(《中國藥典》2005年版,二部附錄IV A)[1],以液體石蠟為空白,于292nm的波長處測定吸收度。求得回歸方程為:△A=0.1599C—8.469×10-3,r=0.9991。結果表明,樟腦在0.5~5mg范圍內,線性關系良好。
2.3.1 溫度對儲存于塑料瓶中樟腦薄荷腦滴鼻液質量的影響。結果見表1。
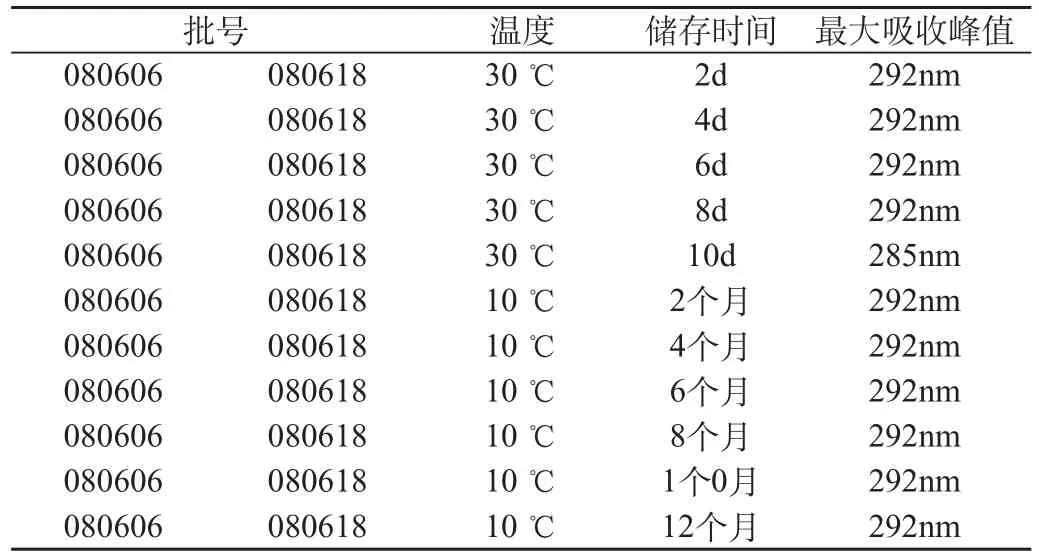
表1 溫度對儲存于塑料瓶中樟腦薄荷腦滴鼻液質量的影響
2.3.1.1 樟腦薄荷腦滴鼻液在高于30℃的環境下儲存10d后,樟腦的最大吸收峰值由292nm偏移至285nm,該制劑中樟腦的有效成份發生變化,制劑由合格轉變為不合格。
2.3.1.2 樟腦薄荷腦滴鼻液在低于10℃的環境中儲藏2、4、6、10、12個月后,樟腦的最大吸收峰值不發生偏移,制劑質量穩定。
2.3.2 溫度對儲存于玻璃瓶中樟腦薄荷腦滴鼻液質量的影響。結果見表2。
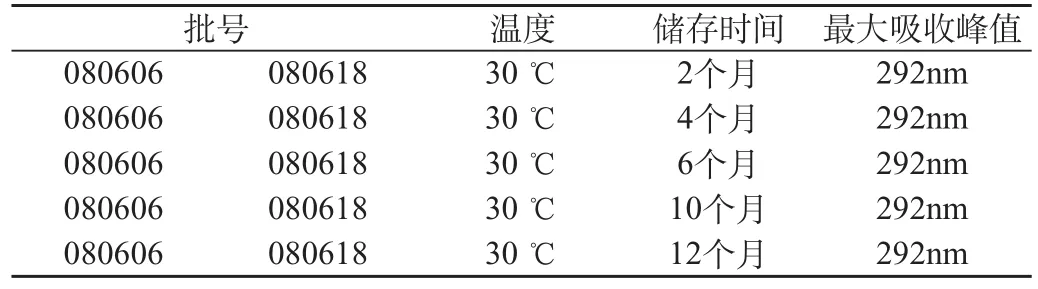
表2 溫度對儲存于玻璃瓶中樟腦薄荷腦滴鼻液質量的影響
樟腦薄荷腦滴鼻液存放于玻璃瓶中,儲藏溫度30℃,儲藏2、4、6、10、12個月后,樟腦的最大吸收峰值不發生偏移,制劑質量穩定。
3 溫濕度對包裝材料微生物限度的影響
3.1 供試液的制備
取包材樣品20個,每個樣品中各加入pH 7.0無菌氯化鈉-蛋白胨緩沖液(以下簡稱緩沖液)5mL,充分振搖后將洗液集中于已消毒瓶中,再取緩沖液5mL,清洗一次,收集洗液。
3.2 微生物限度檢測
參照中國藥典2005年版 附錄Ⅺ J微生物限度檢查法檢查。結果見表3。
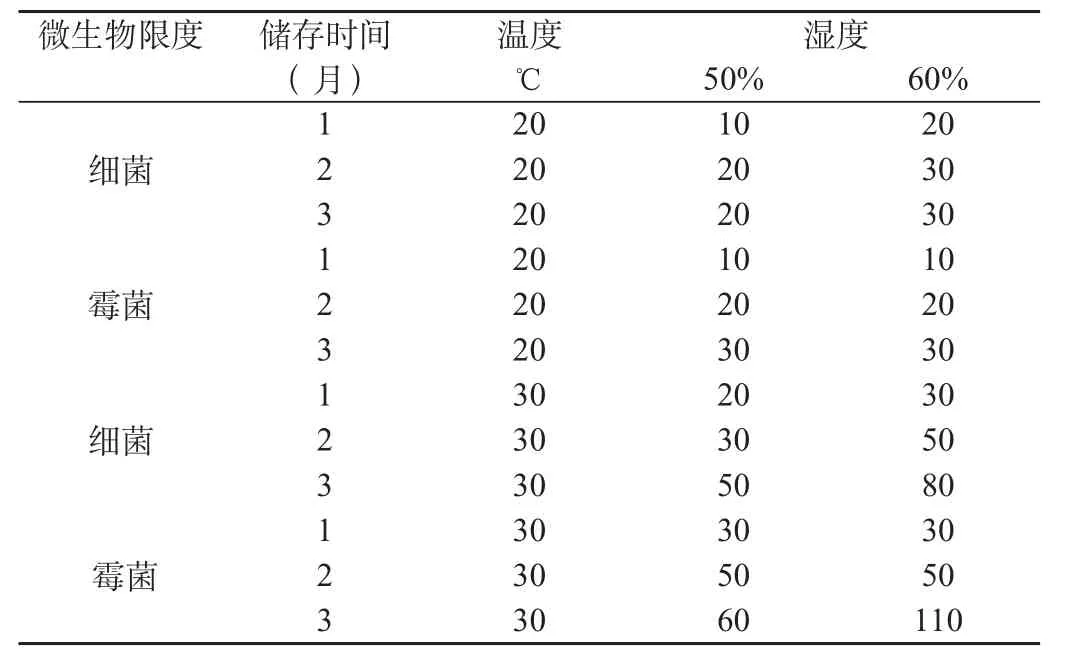
表3 微生物限度檢測表
4 討 論
發生制劑滲漏現象是由于包材致密性不夠,建議更換其他成分的包材。
包裝材料在不同的儲存溫度對制劑質量的影響很大,因溫度造成的制劑不穩定可通過穩定性試驗選擇適宜的制劑儲存溫度。
儲存于玻璃瓶中樟腦薄荷腦滴鼻液的質量不受溫度和儲存時間的影響。
溫度對儲存于塑料瓶中樟腦薄荷腦滴鼻液的質量影響很大,溫度30℃,10d后樟腦最大吸收峰值發生偏移;溫度低于10℃樟腦最大吸收峰值不發生偏移。
由于包材成分與制劑有效成分發生反應是在儲存一段時間后發生,所以一定要加強醫院自制制劑的留樣觀察。為了避免包裝材料微生物限度不合格造成制劑質量不合格,包材應存放于潔凈、通風、溫度低于30℃,濕度不超過60%的環境,定期檢測包材微生物限量,確保制劑質量。
[1]國家藥典委員會編.中華人民共和國藥典(二部)[S].2005年版.北京:化學工業出版社,2005:附錄93-101.

