新型水蛭肽嵌合蛋白治療腦出血后腦水腫的實驗研究
楊 輝,周遠大,何海霞
(1.重慶醫科大學附屬第一醫院藥劑科,重慶 400016; 2.重慶醫科大學附屬第一醫院臨床藥理教研室,重慶 400016)
腦出血(intracerebral hemorrhage,ICH)的發病率、病死率、致殘率均較高,嚴重威脅人類健康和生命[1]。原發性腦出血時,出血后血腫的占位效應及分解產物會導致周圍腦組織腦血流下降、繼發性腦水腫、顱內壓增高等連鎖反應,使病情惡化。水蛭肽嵌合蛋白(TNHH)是采用基因工程技術構建的雙功能嵌合蛋白,由重組中性粒細胞抑制因子(neutrophil inhibltory factor)、纖維蛋白的結合肽和水蛭素活性肽段嵌合,具有中性粒細胞抑制因子的功能和凝血酶的活性,由重慶富進生物醫藥公司采用大腸桿菌表達系統制備而成。TNHH對大鼠動脈阻塞性腦缺血損傷有明顯的保護作用[2]。本試驗采用TNHH對腦出血大鼠進行治療,觀察腦出血后大鼠腦含水量、神經功能損傷與髓過氧化物酶(myeloperoxidase,MPO)之間的關系以及TNHH治療的效果,探討其治療作用的可能機制。
1 材料與方法
1.1 材料
動物:健康合格清潔級SD大鼠96只,雄性,體重180~230 g,由重慶醫科大學試驗動物中心提供。
儀器:動物立體定位儀(上海第二軍醫大學);BP61型電子分析天平(德國Sartorius);VXH-3型微型漩渦混合器(上海躍進醫療器械廠);低溫醫用冰箱(日本SANYO);Uvimini-1240型紫外分光光度計(日本SHIMADZU);微量注射器(寧波市三愛儀器廠);紅外恒溫干燥箱(上海躍進器械廠)。
主要試劑與藥品:注射用TNHH,由重慶富進生物醫藥公司提供,系凍干制劑,規格為 3 mg/支,純度大于 95%,批號為20050401;部分凝血活酶活性時間(APTT)試劑盒,購自上海太陽生物技術公司;MPO測定試劑盒,購自南京建成生物工程研究所。
1.2 方法
1.2.1 動物分組與給藥
將96只大鼠隨機分為假手術組(A組)、腦出血模型組(B組)、TNHH組(C組),每組32只,A組只進針不注血。A組和B組靜脈注射等容量生理鹽水,C組靜脈注射TNHH 2 mg/kg。分別于造模前30 min及造模后每12 h給藥1次,于6,24,72,168 h時分別用Longa標準[3]測定神經功能缺損。各組大鼠在處死前進行神經功能缺損評分,0級為無體征,記0分;Ⅰ級為動物不能完全伸直其前肢,記1分;Ⅱ級為動物一側肢體癱瘓,有追尾現象,記2分;Ⅲ級為動物不能站立、打滾,記3分;Ⅳ級為無自發性活動,有意識障礙,記4分。評分在1~4分之間且取腦時可見腦內血腫形成的大鼠入選實驗組,表明腦出血模型制作成功。
1.2.2 模型制備
參照改良的自體尾動脈血兩次注血法制作腦出血模型[4]。術后用醫用骨蠟封閉骨孔,縫合頭部皮膚,整個過程采用無菌操作。大鼠清醒后無偏癱體征(Longa評分)或血液沿針道反流者棄用。A組操作與制作模型步驟相同,但不注血。
1.2.3 測定指標及方法
腦含水量(干濕重法):各時間點每組動物處死后迅速取出全腦,置冰臺上,去除小腦和腦干。從進針點將大腦冠狀位切成前后兩部分,前部腦組織留做HE染色,后部腦組織再從矢狀縫切開成左右兩半,分別稱其濕重后,置100℃恒溫干燥箱24 h后稱其干重。腦含水量(%)=(濕重-干重)/濕重×100%。
MPO:各組大鼠分別于不同時相點斷頭取腦,用4℃的冰鹽水沖洗干凈腦表面的血液,后用濾紙吸干凈,以進針點作冠狀切面,取血腫周圍新鮮腦組織200 mg,按照1∶9的比例加入磷酸鹽緩沖液(PBS),冰浴下勻漿,4℃ 條件下3 000 r/min離心15 min后,取上清液,即為待檢樣品。測定MPO活性,具體操作按試劑盒說明書進行。
APTT:在不同時相點Longa評分后,經頸動脈取血1.8 mL,迅速加入盛有0.2 mL的0.109 mol/L枸櫞酸鈉抗凝液的硅化玻璃管中,輕輕顛倒混勻,3 000 r/min離心15 min,收集上層液體,測定APTT,以判斷TNHH對凝血功能的影響。
HE染色:將腦水腫測量剩余的進針點前部腦組織用甲醛固定后石蠟包埋,切取片厚5 mm,常規HE染色,觀察水腫細胞形態及炎癥細胞浸潤等情況。
1.2.4 統計學處理
采用SPSS統計軟件包進行數據分析,各組數據以均數±標準差表示,兩兩比較用 t檢驗。P<0.05為差異有統計學意義。
2 結果
HE染色:光學顯微鏡下觀察,A組大鼠大腦各部分細胞排列整齊,形態結構完整,基質無水腫,無炎性細胞浸潤;B組血腫周圍神經元數目明顯減少,排列紊亂,基質水腫明顯,細胞形態不完整,有大量炎性細胞及肥大變形的膠質細胞浸潤;C組與同時相點B組比較,血腫周圍水腫帶及炎癥細胞浸潤等均有不同程度的改善。
神經功能缺損評分:結果見表1。B組大鼠神經功能缺損在24 h時最明顯,各個時相點顯著高于A組;C組大鼠各個時相點神經功能缺損均顯著低于B組,但仍高于A組。
腦含水量:結果見表1。B組大鼠腦含水量從6 h開始逐漸增多,72 h達高峰,與A組大鼠相比有顯著性差異,168 h時差異則不顯著;C組大鼠從6~72 h腦含水量與B組相比均顯著下降,168 h時差異則不顯著(P>0.05),與A組比較無顯著性差異。
表1 各組大鼠不同時間觀察指標比較(±s)
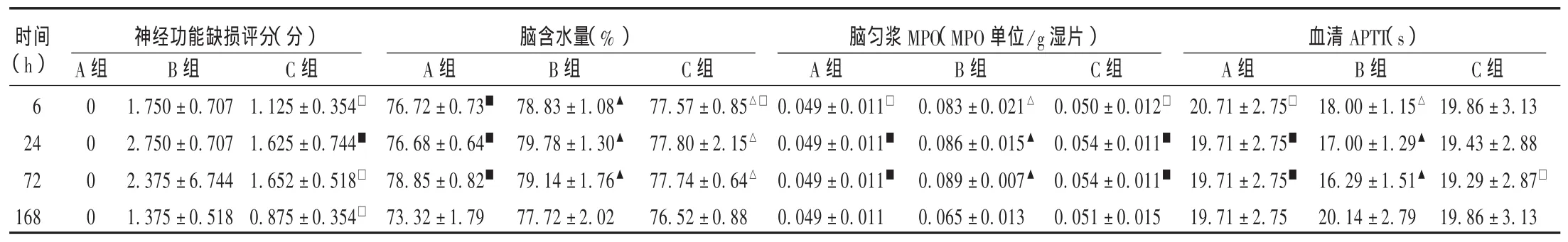
表1 各組大鼠不同時間觀察指標比較(±s)
注:與 A 組比較,△P<0.05,▲P<0.01;與 B組比較,□P<0.05,■P<0.01。
時間(h)神經功能缺損評分(分) 腦含水量(%) 腦勻漿MPO(MPO單位/g濕片) 血清APTT(s)A組B組B組C組C組A組B組C組A組B組C組6 24 72 168 A組 0 0 0 0 1.750±0.707 2.750±0.707 2.375±6.744 1.375±0.518 1.125±0.354□1.625±0.744■1.652±0.518□0.875±0.354□76.72±0.73■76.68±0.64■78.85±0.82■73.32±1.79 78.83±1.08▲79.78±1.30▲79.14±1.76▲77.72±2.02 77.57 ±0.85△□77.80±2.15△77.74±0.64△76.52±0.88 0.049±0.011□0.049±0.011■0.049±0.011■0.049±0.011 0.083±0.021△0.086±0.015▲0.089±0.007▲0.065±0.013 0.050±0.012□0.054±0.011■0.054±0.011■0.051±0.015 20.71±2.75□19.71±2.75■19.71±2.75■19.71±2.75 18.00±1.15△17.00±1.29▲16.29±1.51▲20.14±2.79 19.86±3.13 19.43±2.88 19.29±2.87□19.86±3.13
腦勻漿MPO:結果見表1。B組大鼠腦勻漿MPO從6 h開始逐漸增多,72 h達高峰,與A組大鼠相比有顯著性差異,168 h時差異則不顯著;C組大鼠從6~72 h腦勻漿MPO與B組相比均顯著下降,168 h時差異則不顯著,與A組比較無顯著性差異。
血清APTT:結果見表1。B組大鼠血清APTT值從6 h開始逐漸縮短,72 h時最明顯,與A組大鼠相比有顯著性差異,168 h時差異則不顯著;C組大鼠血清APTT測定僅在72 h時與B組相比有顯著性差異,其余各觀察時間點與B組、A相比差異均不顯著。
3 討論
對于腦出血,目前臨床尚缺乏有效的防治手段,因此對出血性腦損傷的病理生理機制研究顯得尤為重要。本研究參照改良的自體尾動脈血兩次注血法制作腦出血模型[4],術后腦出血模型組大鼠均出現神經功能缺損體征,腦含水量明顯增加,表明大鼠腦出血模型是成功的。
既往研究表明[5],出血后腦損傷有多種機制,如凝血酶的毒性、血腫周圍水腫帶及炎癥細胞浸潤、血腫分解產物、繼發性顱內高壓等,其中前兩者尤為重要。凝血酶作為一種細胞外信號分子,介導神經毒性作用是通過其受體實現的[6]。急性腦出血后血液凝固過程中可釋放大量凝血酶,直接滲透或緩慢釋放到組織間隙,作用于局部神經膠質細胞、神經元和血管內皮細胞膜上凝血酶受體,促進細胞內信號轉導,誘導多種炎性細胞因子的表達,而這些炎性細胞因子促進白細胞黏附于血管內皮細胞或神經細胞,從而加重炎性損傷。
中性粒細胞抑制因子可減少血腫周圍水腫帶中性粒細胞的積聚、滲出,減輕中性粒細胞介導的炎性反應和減少微血栓的形成,防止液體從血腦屏障滲出,從而有效減輕腦水腫,減輕神經功能的損害[7]。水蛭素是凝血酶特異抑制劑,可直接減輕凝血酶的神經毒性。本研究顯示,TNHH可明顯改善腦出血大鼠神經功能缺損體征,減輕腦出血后腦含水量和病理損害,降低急性腦出血后血腫周圍組織白細胞特征性成分MPO的活性,與腦出血模型組相比有顯著性差異(P<0.01或 P<0.05)。可見,TNHH能明顯減輕腦出血后腦水腫,值得進一步開發。
[1]Deinsberger W,Vogel J,Kuschinsky W,et al.Experimental intracerebral hemorrhage:description of a double injection model in rats[J].Neurol Res,1996,18(5):475-477.
[2]楊 輝,王 寧,周遠大,等.3種基因工程藥物對大鼠動脈阻塞性腦損傷治療作用的比較研究[J].中國藥房,2004,15(6):337-338.
[3]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]王敏忠,劉雪平,付慶喜,等.大鼠緩慢注射自體血腦出血模型的改良[J].中風與神經疾病雜志,2008,25(3):330-332.
[5]Lee KR,Kawai N,Kim S,et al.Mwchanisma of edma formation after intracerebral hemorrhage:efects 0f thrombin on cerebral blood-brain barrier permeability,and cell survial in a mt model[J].J Neurosurg,1997,86(2):272-278.
[6]Dery O,Covera CU.Steinhoff M,Proteinase-activated receptors:novel mechanisms of signaling by serine protease[J].Am J Physiol,1998,274:1 429.
[7]Zhang Li,Zhang Zhenggang,Zbang Ruilan.Effects of a selective CD11b/CD18 antagonist and recombinant human tissue plasminogen activator treatment alone and in combination in a rat embolic model of stroke[J].Stroke,2003,34(7):1 790-1 798.

