一種細胞核質蛋白分離方法的建立
徐小燕,楊雪,夏蒲,邢亞楠,關一夫,鄭華川
(中國醫科大學 1.基礎醫學院生物化學與分子生物學教研室;2.基礎醫學院病理生理學教研室;3.附屬第一醫院腫瘤外科,沈陽110001)
隨著蛋白質組學的發展,確定蛋白質在細胞內定位的的重要性日益彰顯。在研究細胞不同組份的時候,細胞核和細胞質這兩個細胞組份最受關注,這就要求研究者對細胞的核、質蛋白進行有效的分離提取,從而可以將分離出來的核蛋白用于轉錄調控方面的研究,降低蛋白表達的背景噪聲,為蛋白功能研究奠定實驗基礎[1]。本研究利用培養的癌細胞系,建立了一種比較經濟、便捷的細胞核質蛋白分離方法,約90 min就可以完成培養細胞的細胞核蛋白和質蛋白的分離。
1 材料與方法
1.1 材料
RPMI 1640、MEM、DMEM 和 Ham F12購自海克隆生物化學制品有限公司,胎牛血清、青霉素和鏈霉素購自 Thermo公司,一抗 Bag-1、GRP78、parafibromin、lamin B以及β-actin購自Santa Cruz公司,抗ING5抗體購自Proteintech公司,HRP連接的二抗IgG購自DAKO公司,Thermo NE-PER誖Nuclear and Cytoplasmic Extraction試劑盒購自 Thermo公司,Ambion PARISTM試劑盒購自Ambion公司。胃癌細 胞 系 MKN28、MKN45、 KATOIII、HGC-27、GT-3TKB 和 AGS,肺癌細胞系 H-446、H-460、MS-1、PC14、AoI和SQ-5分別由神奈川癌中心高野康雄教授饋贈。
RLN裂解液(配方來自Qiagen公司的RNeasy誖Mini試劑盒)的主要成分為50 mmol/L Tris-HCl(pH 7.4)、140 mmol/L NaCl、1.5 mmol/L MgCl2和 0.5%Nonidet P-40(1.06 g/ml)。RIPA裂解液的主要成分為 50 mmol/L Tris-HCl (pH 7.4)、150 mmol/L NaCl、1%Triton X-100、1% 脫氧膽酸鈉、0.1%SDS和1 mmol/L EDTA(pH 8.0)。蛋白酶抑制劑的主要成分為苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、抑肽酶(aprotinin)、亮抑酶肽(leupeptin)和抑肽素(pepstain A)。
1.2 細胞培養
分別使用含有10%胎牛血清、1×105U/L青霉素 、100 mg/L 鏈 霉 素 的 RPMI 1640(MKN28、MKN45、 KATOIII、H-446、H-460、MS-1 和 PC14)、MEM(HGC-27、AoI 和 SQ-5)、DMEM(GT-3TKB)和Ham F12(AGS)培養基在 37 ℃、5%CO2、飽和濕度的環境下培養癌細胞。
1.3 利用Ambion PARISTM試劑盒進行核質蛋白分離提取
收集1×107個新鮮培養的細胞,用PBS洗1次,冰上放置。冰上預冷的100~500μl的細胞分離緩沖液重懸細胞,冰上靜置5~10 min。4℃條件下500 g離心樣品1~5 min,小心吸取胞質成分。冰上預冷的細胞分離緩沖液清洗核沉淀。細胞破碎緩沖液裂解核沉淀后收集核蛋白。
1.4 利用 Thermo NE-PER誖Nuclear and Cytoplasmic Extraction試劑盒進行蛋白提取
按照說明書操作,收集細胞,PBS洗2遍,加入收集細胞10倍體積的細胞質蛋白抽提試劑A,渦旋儀渦旋5 s,把細胞沉淀完全懸浮并分散開,冰上靜置10~15 min。加入細胞體積一半的細胞質蛋白抽提試劑B,渦旋5 s,冰上靜置5 min,渦旋5 s,4℃條件下12 000~16 000 g離心5 min,立即吸取上清,抽提得到的即為細胞質蛋白。完全吸盡殘余上清,向沉淀加入2.5倍體積的細胞核蛋白抽提試劑B,渦旋15~30 s,把細胞沉淀完全懸浮并分散開。然后放回冰浴中,每隔1~2 min再高速劇烈渦旋15~30 s,共30 min。4℃條件下15 000 g離心10 min,立即吸取上清,抽提得到的即為細胞核蛋白。
1.5 本實驗室建立的核蛋白提取方法
收集2×107個細胞,用細胞體積3~4倍的RLN裂解液 (含 8.5%PMSF、0.1%Aprotinin、0.1%Leupeptin和0.035%Pepstain A蛋白酶抑制劑),冰上靜置20 min。4℃條件下3 000 g離心10 min,提取上清。加入原收集細胞4倍體積的RLN裂解液,吹打混勻,洗核沉淀。4℃條件下3 000 g離心10 min。徹底棄掉上清,加入RIPA裂解液100μl,在需要加入RIPA裂解液前數分鐘內加入上述蛋白酶抑制劑。吹打混勻后,冰上靜置10 min。冰浴超聲工作5 s,間歇5 s,共3次。4℃條件下12 000 g離心20 min。提取上清即為所需的核蛋白。
1.6 Western blot
將收集的細胞按照上述3種方法提取胞質蛋白和核蛋白后,采用Bradford法測定提取液中的蛋白濃度。各取50μg蛋白定量上樣,行聚丙烯酰胺凝膠電泳,濃縮膠電壓80 V,分離膠電壓110 V,150 mA電流半干轉膜120 min。用含5%脫脂奶粉的封閉液于室溫下搖動封閉1 h,分別加入一抗Bag-1(1∶500稀釋)、GRP78(1∶500稀釋)、ING5(1∶500稀釋)、parafibromin(1∶100 稀釋)、lamin B(1∶1 000稀釋)和β-actin(1∶1 000稀釋),4℃過夜。室溫下加入二抗(1∶5 000稀釋)孵育2 h。TBST洗膜,ECL法顯色,暗室中壓片、顯影、定影。
2 結果
利用Thermo的試劑盒提取核質蛋白后進行Western blot檢測,結果如圖1所示,在MKN28等5種胃癌細胞系中,36 kDa Bag-1存在于 MKN28、AGS、MKN45和 KATO-Ⅲ的胞質中,32 kDa異構體存在于HGC27細胞質中,β-actin為質蛋白檢測的內參。雖然在AGS和HGC-27細胞核蛋白中有內質網的標志性蛋白GRP78出現,但32 kDa和36 kDa異構體在AGS細胞核中、50 kDa異構體在HGC27細胞核中呈強表達。
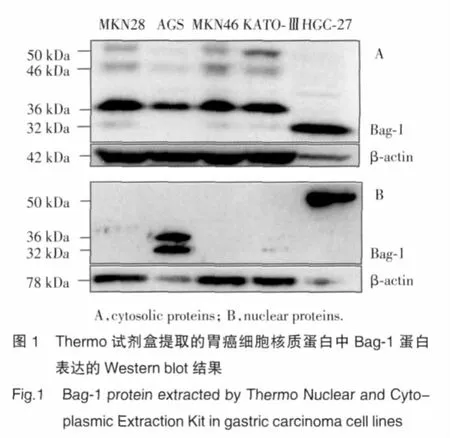
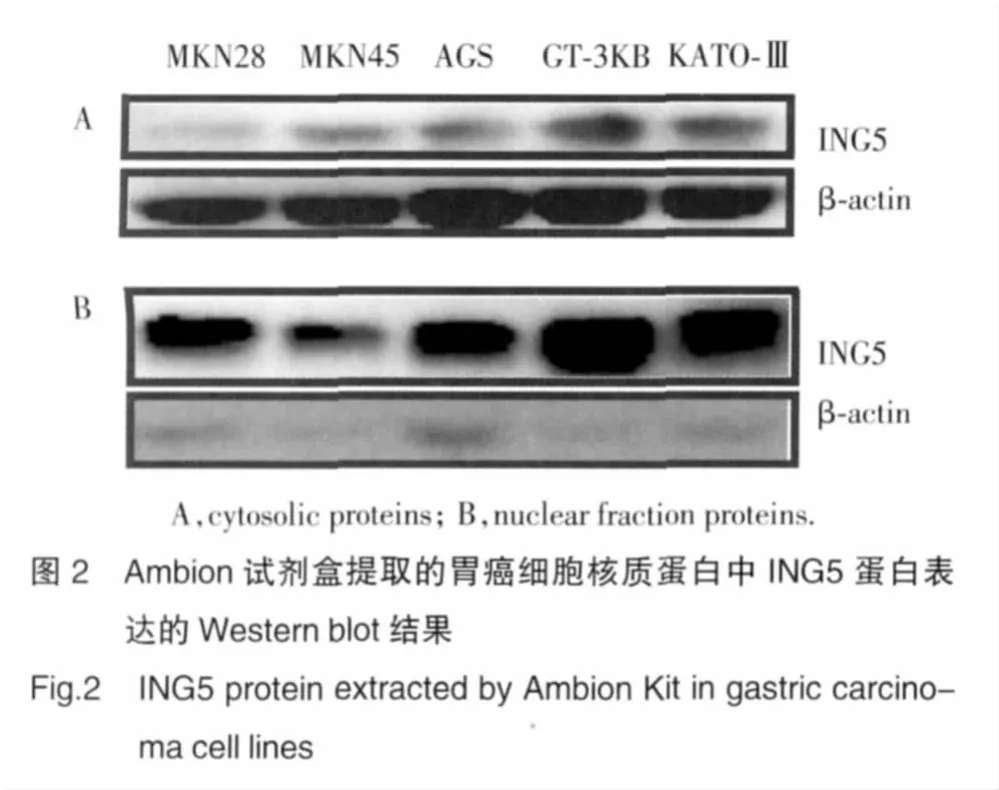
利用Ambion的試劑盒提取核質蛋白后進行Western blot檢測,結果如圖2所示,在MKN28等5種胃癌細胞系中,ING5蛋白主要在細胞核中表達。我們用質蛋白內參β-actin標記核蛋白的污染程度,結果發現其在核內表達極少。ING5蛋白在細胞質里有少量表達,但是我們通過免疫組化方法已經確認了這種表達來自于核蛋白污染。
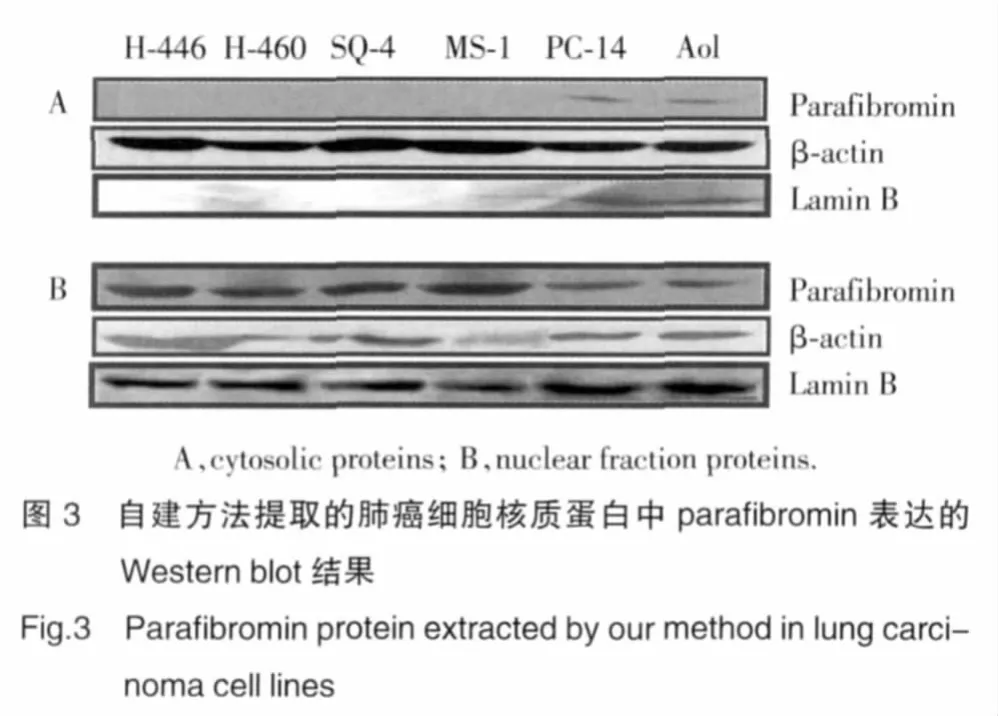
利用本實驗室自建的方法提取核質蛋白后進行Western blot檢測,結果如圖3所示,在H-446等6種肺癌細胞系中,parafibromin主要是在6種肺癌細胞系的細胞核中表達。雖然PC-14和AoI兩種細胞的細胞質中有parafibromin表達,其表達水平與核蛋白內參lamin B表達一致,提示可能是核蛋白污染所致。β-actin在細胞質中高表達,在核成分中低表達,lamin B在胞核成分中高表達,在胞質中低表達,說明本實驗室此次分離抽提的核質蛋白較成功。
3 討論
本研究室自建的方法中,首先使用僅含有非離子表面活性劑Nonidet P-40的RLN裂解液,在不破碎核的前提下,通過破壞細胞膜釋放質蛋白,然后使用含有陰離子表面活性劑SDS和脫氧膽酸鈉以及非離子型Triton X-100的強RIPA裂解液,配合超聲破碎核膜并粉碎DNA長片段。為避免兩組分污染,吸取含胞質成分的上清時不能劇烈過度抽吸,底部最好保留一些上清,然后把殘余的上清液輕輕抽取后棄掉并用RLN裂解液洗滌。此外,我們還可以通過RIPA裂解液的高離子強度和滲透壓來加速核膜破裂,提高核蛋白的提取率[2,3]。值得注意的是裂解液應于4℃保存,使用時置于冰上并加入蛋白酶抑制劑。應用超聲波處理時應注意避免溶液中氣泡的存在,提取超聲波敏感的蛋白質酶時宜慎重。
內參蛋白一般指由管家基因編碼表達的蛋白,它們在各組織和細胞中的表達相對恒定,選擇的內參一般與檢測目的蛋白的分子量相差5 kDa以上。Western blot實驗中內參檢測不但可校正蛋白質定量和上樣過程中的實驗誤差,也可檢測Western blot操作系統是否正常。常用的細胞質蛋白內參有:細胞骨架蛋白β-actin、β-tubulin和甘油醛-3-磷酸脫氫酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH);常用的核蛋白內參有:組蛋白H(histone H)、核纖層蛋白(nuclear lamina protein)、K70、K80、Lamin A和B等[4,5]。本研究中選擇β-actin作為胞質蛋白定量內參,內質網的標志性蛋白GRP78和β-actin作為細胞質蛋白污染內參[6],Lamin B作為胞核蛋白定量和污染內參。本研究結果顯示,利用Thermo試劑盒抽提的核蛋白中有內質網的標志性蛋白GRP78出現,說明有輕微的質蛋白污染;利用Ambion試劑盒抽提的核蛋白中用胞質蛋白的內參β-actin的抗體檢測,β-actin的表達極低,說明此次核質蛋白分離的較成功,核蛋白中質蛋白污染少;而分別在利用本研究室自建的方法抽提的細胞核蛋白和質蛋白中使用胞質蛋白內參β-actin和胞核蛋白內參Lamin B的抗體進行檢測,胞質蛋白中β-actin豐富表達,Lamin B微弱表達,胞核蛋白中Lamin B高表達,β-actin微弱表達。因此,可用胞核蛋白內參檢測胞質蛋白中是否混入細胞核組分,可用質蛋白內參檢測胞核蛋白中是否污染。
本研究室自建的方法與試劑盒相比,操作方法簡單,僅需自行配置RLN和RIPA兩種裂解液,各成分均為實驗室常規使用的試劑,而且價格僅是試劑盒價格的百分之一,裂解液配制后冷藏存放,可隨取隨用,為實驗節省大量開支,具有在實驗室中推廣使用的價值。
[1]El-Haschimi K,Pierroz DD,Hileman SM,et al.Two defectscontribute to hypothalamic leptin resistance in mice with diet-induced obesity[J].JClin Invest,2000,105(12):1827-1832.
[2]Yu M,Zheng H,Tsuneyama K,etal.Paradoxical expression of maspin in gastric carcinomas:correlation with carcinogenesisand progression[J].Hum Pathol,2007,38(8):1248-1255.
[3]徐小燕,夏蒲,邢亞楠,等.凍結破碎法提取組織蛋白方法初探[J].中國醫科大學學報,2010,39(5):336-339.
[4]Ruan W,Lai M.Actin,areliablemarker of internal control?[J].Clin Chim Acta,2007,385(1-2):1-5.
[5]Liu NK,Xu XM.beta-tubulin is a more suitable internal control than beta-actin in western blot analysis of spinal cord tissues after traumatic injury[J].JNeurotrauma,2006,23(12):1794-1801.
[6]鄭華川,張鴻,關一夫,等.CCl4誘發galectin-3基因敲除小鼠肝損傷中GRP78和BAD表達 [J].中國醫科大學學報,2008,15(9):652-654.

