高氧誘導新生鼠肺纖維化中CDK2及P27的表達和意義
于曉巖,孫艷麗,胡瑜,富建華
(中國醫科大學附屬盛京醫院兒科,沈陽110004)
慢性肺疾病(chronic lung disease,CLD)是患有心肺疾病的新生兒,特別是早產兒,由于長時間吸入高濃度氧或高容量、高壓力的機械通氣等治療因素共同作用于未成熟肺,而導致的一種嚴重的肺部并發癥。其特征性病理變化為:早期肺泡炎性反應和晚期不可逆的肺間質纖維化。到目前為止,關于CLD確切發病機制尚無定論,因此也缺乏有效的防治手段,故探索CLD肺纖維化的發生機制成為當今新生兒領域亟待解決的問題。現研究認為,肺成纖維細胞異常增殖,造成細胞外基質(extracellular matrix,ECM)合成及降解失衡是高氧致CLD肺纖維化發生的根源,而調節細胞增殖的最終環節又發生在細胞周期水平上。因此,本實驗采用高氧誘導新生大鼠肺纖維化模型,研究細胞周期依賴蛋白激酶2(cyclin-dependent kinase-2,CDK2)及細胞周期蛋白依賴激酶抑制因子(cyclin-dependent kinase inhibitors,P27)的動態表達變化及其對CLD肺纖維化的影響作用。
1 材料與方法
1.1 材料
選用足月新生Wistar大鼠64只(由中國醫科大學附屬盛京醫院實驗動物部提供)。主要試劑:兔抗大鼠CDK2單克隆抗體、小鼠抗大鼠P27單克隆抗體購自Santa Cruz公司;SP免疫組化試劑盒購自北京中杉金橋公司;RNAisoTMPlus、PrimeScriptTMRT Reagent Kit、SYBRRPremix Ex TaqTM均購自 Takara 大連寶生物技術有限公司;引物由Takara大連寶生物技術有限公司合成。主要儀器:氧箱,測氧儀(美國生產型號為OM-ME),Dapex氣體分析儀,美國Universal Imagining Porppration圖像分析系統。
1.2 方法
1.2.1 模型的制備:將新生大鼠依據吸入氧濃度隨機分為實驗組和對照組,每組32只,雌雄不限。實驗組生后即置于氧箱中,持續輸入氧氣,維持氧濃度為0.90(用測氧儀檢測),CO2濃度<0.5%(用鈉石灰吸收,Dapex氣體分析儀檢測),溫度為25~27℃,濕度50%~70%(用變色硅膠吸收水蒸汽)。每天定時開箱0.5 h,添加水、飼料及更換墊料,并與對照組交換代母鼠,以避免因氧中毒而致喂養能力下降。對照組置于空氣中,具體方法及控制因素同實驗組[1]。
1.2.2 標本的收集:于實驗后3、7、14、21 d分別從兩組中隨機抽取8只,用10%的水合氯醛麻醉后立即打開胸腔,分離肺組織。將左肺置于4%多聚甲醛中固定,石蠟包埋,常規制備5μm切片用于HE染色,右肺置于-80℃冰箱凍存,用于實時定量PCR檢測和Western blot分析。
1.2.3 肺組織纖維化評分:按Ashcroft等人的方法于10倍光鏡下進行雙盲纖維化評分[2]。評分標準:0分為正常肺組織;1分為肺泡或細支氣管壁少許纖維化,2~3分為中度纖維化而肺泡結構無改變;4~5分為有明確的肺泡結構改變(肺泡壁明顯增厚),纖維束或纖維小結形成;6~7分為有嚴重肺泡結構改變和大片纖維化;8分為完全纖維化。
1.2.4 肺組織CDK2及P27蛋白表達檢測:采用SP免疫組織化學方法。石蠟切片常規脫蠟至水,采用抗原熱修復法,正常山羊血清封閉,兔抗大鼠CDK2單克隆抗體及小鼠抗大鼠P27單克隆抗體(1∶200)4℃過夜,生物素標記的山羊抗兔和山羊抗小鼠IgG抗體37℃30 min,鏈霉素抗生物素-過氧化物酶37℃10 min,DAB顯色,鏡下控制顯色時間,蘇木素復染,水化30 min,常規脫水,樹膠封片。結果判定:應用美國Universal Imaging Porpomtion圖像分析系統,應用Meta Morph軟件分析圖像平均灰度值,并用來表示CDK2及P27表達的強度,平均灰度值與蛋白表達水平呈反比。
1.2.5 肺組織CDK2及P27基因表達檢測:實時定量PCR技術用TRIzol一步法提取肺組織RNA。采用SYBRGreenⅠ熒光染料嵌合法檢測CDK2 mRNA及P27 mRNA。先構建目的基因(CDK2基因和P27基因)和管家基因(GAPDH)的RNA標準品,制作標準曲線,利用標準曲線對樣品中的目的基因和管家基因分別進行定量。通過管家基因的校正,檢測各組肺組織中CDK2及P27目的基因的相對表達量。CDK2 mRNA的相對表達量=CDK2基因拷貝數/GAPDH基因拷貝數。P27 mRNA的相對表達量=P27基因拷貝數/GAPDH基因拷貝數。校正結果以生理鹽水對照組為1,其余組與之相比較。PCR反應體系的組成參照說明書進行。反應條件為逆轉錄反應37℃ 15 min,85℃ 5 s,PCR 擴增 95℃ 10 s,1 個循環,55 ℃ 5 s,60 ℃ 34 s,40 個循環。CDK2、P27 和GAPDH 引物序列如下:CDK2-F 5′-CATCAAGCTGGCTGACTTTGGA-3;CDK2-R 5′-GTGGAGTAGTACT TGCGCCC AGAA-3′;P27-F 5’-TTGGTGGAC -CAAATGCCTGA-3’;P27-R5’-GCTCCACAGTGCCAGCA TTC-3’;GAPDH-F 5′-AAATGGTGAAGGTCGGTGTG-3′;GAPDH-R 5′-TGAAGGGGTCGTTGATGG-3′。CDK2產物片段 126 bp,P27產物片段 169 bp,GAPDH產物片段144 bp。
1.2.6 Western blot分析:取大約100 mg肺組織置于0.5 ml蛋白裂解液中,于冰上超聲波粉碎機下將組織粉碎,勻漿于1 000 r/min,4℃,離心5 min,取上清即為蛋白提取物。采用BCA法對蛋白樣品進行定量。用蒸餾水將蛋白樣品調成相同濃度,加入相同體積上樣緩沖液,沸水煮10 min進行蛋白變性。取50μg總蛋白進行SDS-PAGE凝膠電泳,濃縮膠電壓90 V,分離膠電壓110 V,90 min;電泳后將蛋白轉至硝酸纖維素膜上,電壓80 V,1 h;脫脂奶粉封閉1 h,加入兔抗大鼠CDK2抗體和小鼠抗大鼠P27抗體(1∶1 000),4℃過夜;然后加入二抗室溫孵育2 h,BCIP/NBT顯色液顯色,約10 min,蒸餾水終止反應。以β-actin作為內參.結果通過天能圖像分析系統進行分析,CDK2蛋白含量=樣本CDK2蛋白灰度值/同一樣本β-actin灰度值,P27蛋白含量=樣本P27蛋白灰度值/同一樣本β-actin灰度值。
1.3 統計學分析
應用SPSS14.0軟件進行數據處理,所有數據均以x±s表示,組間比較應用t檢驗,相關分析采用Spearman分析,P<0.05為差異有統計學意義。
2 結果
2.1 光鏡下各組肺組織纖維化評分比較
見表1。
2.2 免疫組化檢測各組肺組織CDK2及P27蛋白表達
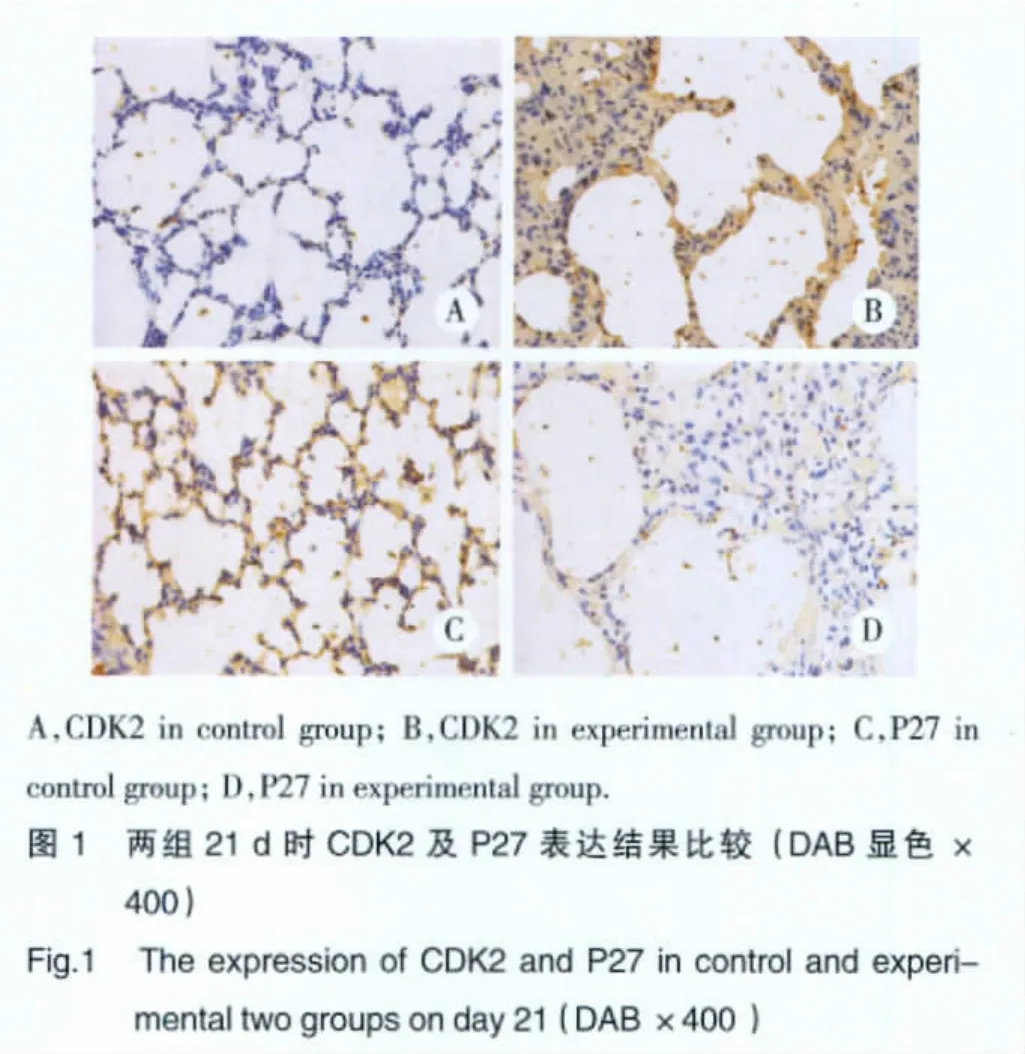
見表 2,圖 1。
2.3 實時定量PCR檢測各組肺組織CDK2及P27基因表達
見表 3,圖 2。
2.4 肺組織CDK2、P27基因表達與肺組織纖維化評分的相關性
高氧暴露下新生鼠肺組織CDK2基因的表達與纖維化評分呈正相關:(r=0.702,P<0.05);P27 基因表達與纖維化評分呈負相關:(r=-0.765,P<0.05)。

表1 實驗組和對照組肺組織纖維化評分(n,x±s)Tab.1 Lung fibrosis scores of control and experimental groups(n,x±s)

表2 實驗組和對照組肺組織CDK2及P27蛋白表達的平均灰度值(x±s)Tab.2 Mean intensity of CDK2 and P27 protein of controland experimentalgroups(x ±s)
表3 實驗組和對照組肺組織CDK2、P27基因表達(x±s)Tab.3 Relative expression of CDK2 and P27 genes in control and experimental groups(x ±s)
2.5 Western blot蛋白定量分析
各組在33 kDa處和27 kDa處可見特異性蛋白條帶,對各條帶進行灰度分析發現:對照組變化均不明顯,實驗組CDK2 3 d時與對照組無差異,7 d時表達升高,14 d 時明顯升高(0.51±0.05),與對照 14 d相比(0.39±0.06),差異有統計學意義(P<0.05),21 d時達到高峰(0.64±0.08),與對照 21 d相比(0.40±0.06),差異有統計學意義(P<0.05);實驗組 P27 3 d時與對照組無差異,7 d時表達開始開始降低,14 d時明顯降低(0.48±0.07),與對照 14 d相比(0.60±0.06),差異有統計學意義(P<0.05),21 d時達到最低值(0.36±0.05),與對照 21 d相比(0.59±0.09),差異有統計學意義(P<0.05)(圖 2)。

3 討論
盡管高氧致早產兒CLD的發病機制尚未清楚,但其肺組織纖維化的最終病理結局已公認,有關其纖維化的發生機制認為與下列因素有關:(1)ECM合成及降解失衡,其中膠原的過度合成和沉積超過基質蛋白酶的降解能力在CLD的發生發展中發揮重要作用;(2)復雜的細胞作用,肺巨噬細胞、肺上皮細胞及肺間質成纖維細胞是研究的熱點,其中肺成纖維細胞是公認的纖維化發生的效應細胞;(3)龐大的細胞因子網絡,其中研究最多的就是可促進細胞增生和膠原蛋白合成的轉化生長因子β(transforminggrowth factor-β,TGF-β)。特別是其下游更具特異性的促纖維化而不影響其他生物學活性的新靶點成為近年研究的熱點。
正常細胞增殖需經歷G1、S、G2和M期4個時相,S期為DNA合成期,M期為有絲分裂期。期間存在多個檢控點調節各時相間的轉換。在所有檢控點中,尤以G1→S最為重要。它通過接受細胞周期蛋白構成的網絡調節系統作用,發揮細胞周期調控功能[3]。靜止期細胞處于G0期,受到生長信號刺激進入G1期,準備DNA合成。此時,細胞周期蛋白(cyclin)表達上調,結合并激活相應的細胞周期蛋白依賴性激酶(cyclin dependent kinase,CDK),二者的復合物使視網膜母細胞瘤蛋白(Rb)磷酸化,從而釋放出重要的核轉錄因子(E2F),引起一系列與S期有關靶分子的表達。通過G1晚期的限制點后,細胞進入S期,此時發生復制。細胞周期蛋白依賴性激酶抑制因子(cyclin dependent kinaseinhibitor,CDKI)發揮負性調控作用。
近年來,隨著細胞周期調控機制的闡明,細胞周期調控因子在惡性腫瘤發病機制中的作用受到人們重視[4]。多種腫瘤組織及細胞內均發現CDK2及P27的異常表達[5]。研究發現,膽管癌細胞中CDK2呈高表達,與對照組相比有顯著統計學差異[6]。Sui等[7]研究發現,P27在卵巢癌中的表達較卵巢良性和良惡交界性腫瘤中減少。也有研究發現,CDK2的表達與垂體腺瘤的侵襲性呈正相關,而P27的表達與垂體腺瘤的侵襲性呈負相關[8]。靶向CDK2的siRNA能抑制肝細胞生長因子誘導的HepG2細胞增殖[9]。病毒載體介導的P27過表達可以誘導體外腫瘤細胞周期停滯及凋亡[10]。
目前有關CDK2及P27異常表達對肺纖維化影響作用的研究報道較少。但有研究發現[11],正常大鼠腎臟有P27表達,其對腎臟細胞的增殖、分化、凋亡等有重要的調控作用,而在腎間質纖維化大鼠模型中P27的表達與纖維化程度呈明顯負相關。血管平滑肌細胞異常增殖時CDK2蛋白表達上升[12]。說明CDK2高表達及P27低表達均與纖維化密切相關。在本實驗中我們也發現,高氧致CLD新生鼠中,對照組隨著日齡的增加,肺泡發育逐漸成熟,作為正常細胞周期活動的必要蛋白,CDK2及P27在對照組中呈陽性表達。實驗組隨著吸氧時間的延長,CDK2蛋白和基因的表達呈逐漸上升的趨勢,14 d和21d時CDK2明顯高于同時間對照組(P<0.05),其基因表達與纖維化程度呈正相關;P27蛋白和基因的表達呈逐漸下降的趨勢。14 d和21 d時明顯低于對照組(P<0.05),其基因表達與纖維化程度呈負相關。體外實驗發現,體外培養人肺成纖維細胞增殖和表型轉化時CDK2基因表達增加[13]。用結締組織生長因子(connective tissue growth factor,CTGF)刺激體外培養肺成纖維細胞,細胞明顯增殖,且P27表達下調[14]。體外培養的特發性肺纖維化患者的成纖維細胞中,P27表達明顯低于正常人[15]。在本研究中,高氧后肺組織中CDK2表達上調及P27表達下調,提示細胞周期蛋白異常表達導致肺成纖維細胞過度增殖,這一機制可能在CLD肺纖維化發生中發揮極為重要的作用。在高氧致CLD中,TGF-β1是如何啟動這一機制,而CDK2及P27又是如何發揮作用的有待進一步深入研究。
[1]富建華,薛辛東.慢性肺疾病早產鼠轉化生長因子β1基因和蛋白動態表達及其對肺發育的抑制作用[J].中華兒科雜志,2005,43(6):463-465.
[2]Ashcroft T,Simpson JM,Timbrell V,et al.Simplemethod of estimatingseverityofpulmonaryfibrosisonanumericalscale[J].Clin Pathol,1988,41(4):467-470.
[3]Sullivan SM,Holyoak T.Enzymeswith lid-gated activesitesmust operate by an induced fit mechanism instead of conformational se1ection[J].Proc Natl Acad Sci USA,2008,105(37):13829-13834.
[4]Ivetac A,Mcammon JA.Elucidating the inhibition mechanism of HIV-1 non-nucleoside reverse transcriptase inhibitors through muhicopymoleculardynamicssimulations[J].Mol Biol,2009,388(3):644-658.
[5]Corsino PE,Davis BJ,Norgaard PH,et al.Mammary tumors initiated by constitutive CDK2 activation contain an invasive basal-like component[J].Neoplasia,2008,10(11):1240-1252.
[6]胡逸林,張端蓮.CDK2蛋白在膽管細胞癌中的表達及臨床意義[J].華南國防醫學雜志,2010,24(1):3-5.
[7]Sui L,Dong Y,Ohno M,et al.Implication of malignancy andprognosis of p27(kip1),cyclin E,and cdk2 expression in epithelial ovarian tumors[J].Gynecol Oncol,2001,83(1):56-63.
[8]鄭安錫,霍鋼,黃曉明,等.細胞周期相關蛋白cyclin E、CDK2和P27 在垂體腺瘤中的表達[J].Modern Med J,2009,37(3):179-183.
[9]Sugatani J,Osabe M,Kurosawa M,et al.Induction of UGT1A1 and CYP2B6 by an antimitogenic factor in HepG2 cells is mediated through suppression of cyclin-dependent kinase 2 activity:cell cycledependentexpression[J].Drug Metab Dispos,2010,38(1):177-186.
[10]Lee CT,Lee YJ,Kwon SY,et al.In vivo imaging of adenovirus lransduction and enhanced therapeutic effieacy of combination therapy with conditionally replicating adenovirus and adenovimsp27[J].Cancer Res,2006,66(1):372-377.
[11]孫劍,陶立堅,寧旺斌,等.P27和TGF-β在大鼠腎間質纖維化中的表達及關系[J].細胞與分子免疫學雜志,2008,24(8):808-813.
[12]Shimizu-Hirota R,Sasamura H,Kuroda M,et al.Extracellular matrix glycoprotein biglycan enhances vascular smooth muscle cell proliferation and migration[J].Circ Res,2004,94(8):1067-1074.
[13]Schuliga MJ,See I,Ong SC,et al.Fibrillar collagen clamps lung mesenchymal cells in a nonproliferative and noncontractile phenotype[J].JRespir Cell Mol Biol,2009,41(6):731-741.
[14]Wu SH,Wu XH,Lu C,et al.Lipoxin A4 inhibitsproliferation of human lung fibroblastsinduced by connective tissuegrowth factor[J].JRespir Cell Mol Biol,2006,34(1):65-72.
[15]Moodley YP,Scaffidi AK,Misso NL,et al.Fibroblasts isolated from normal lungs and those with idiopathic pulmonary fibrosis differ in interleukin-6/gp130-mediated cell signaling and proliferation[J].J Pathol,2003,163(1):345-354.

