腦外傷后小鼠海馬區notch信號的表達變化
潘長福 ,阮瓊芳 ,沈曉黎 ,涂 偉 ,婁遠蕾 ,匡助才 ,賴賢良 ,汪 泱 ,鄧志鋒*
(1、南昌大學第二附屬醫院神經外科;2、南昌大學泌尿外科研究所;3、南昌大學研究生院醫學部,江西 南昌 30006)
腦外傷是一種常見的致死、致殘性疾病,隨著現代交通工具的發展,其發病率呈現逐年上升的趨勢。人類海馬區神經元與學習記憶緊密相關,但該區神經元對腦外傷極為敏感,傷后神經元大量變性壞死,導致患者學習記憶功能障礙[1]。近年來研究發現,成年哺乳動物海馬齒狀回亞顆粒區(subgranular zone,SGZ)存在神經干細胞(neural stem cells,NSCs),這些細胞在腦外傷后被激活,增殖分化成功能上成熟的神經元,整合到神經網絡中,一定程度上能促進患者神經功能的恢復[1]。但是腦外傷后NSCs增殖分化能力十分有限,遠不能達到臨床恢復的要求。因此,如何最大程度地提高神經干細胞增殖分化能力是治療腦外傷的關鍵。近年來研究證實,notch信號表達在成體海馬區神經干細胞中,在其增殖分化調控機制中起著極其重要的作用[2]。然而notch信號是否也調控腦外傷后神經干細胞增殖、分化過程,目前并不清楚。本研究擬通過自由落體法復制閉合性腦外傷小鼠模型,從基因水平上觀察腦外傷后海馬區notch信號的表達變化,初步探討該信號與內源性神經干細胞增殖、分化的關系,為以后進一步深入研究notch信號調控成體神經再生機制提供理論基礎。
材料與方法
1 實驗動物分組及模型制備 Balb/c系雄性小鼠,體重23g左右,購自南昌大學醫學院動物實驗中心。隨機分為假手術(sham)組、腦外傷4h、1d、3d模型組,每組分別3只動物。參考文獻,采用改良的自由落體法復制閉合性腦外傷小鼠模型[3]。打擊裝置由腦立體定向儀、垂直導管、下落砝碼、頂端涂有聚乙烯的撞針組成,撞針底端直徑3mm(安徽淮北正華生物儀器設備有限公司提供)。異氟烷吸入麻醉小鼠后,將頭部固定于腦立體定向儀上,消毒,沿中線切開頭皮,暴露頭蓋骨,分離骨膜,將撞針置于前、后囟門中點偏左1mm。以40g砝碼從25cm高處沿垂直導管自由下落,撞擊撞針造成腦損傷,縫合頭皮,給以充足水和食物喂養。假手術對照組僅切開頭皮,暴露顱骨,不實施打擊。傷后1h根據NSS評分系統(表1)評分[4],篩選7~8分重度腦外傷小鼠納入實驗研究對象。
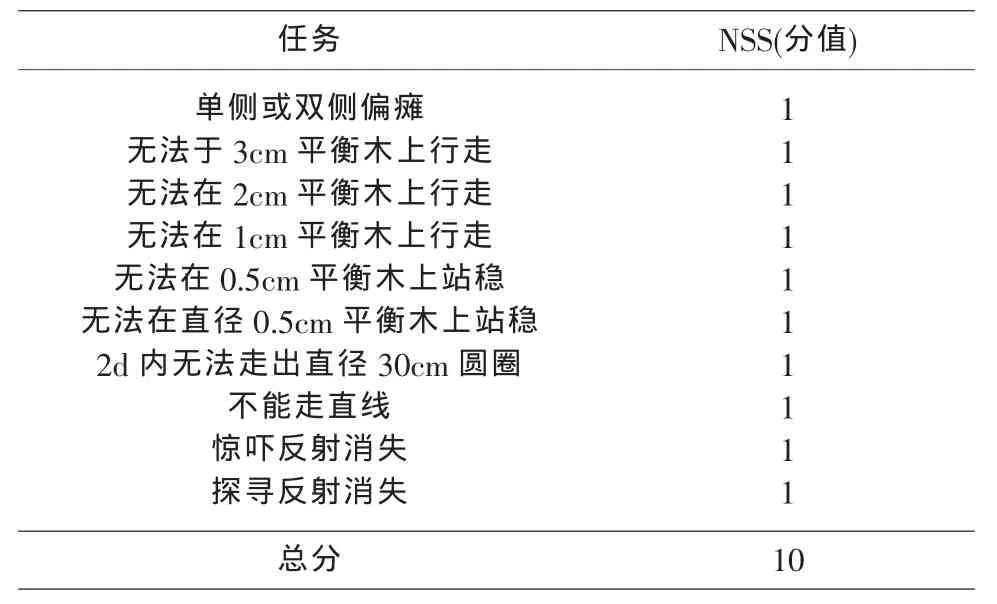
表1 小鼠腦損傷NSS評分系統
2 組織標本制備 腦外傷組分別在傷后4h、1d、3d處死動物,顯微鏡下迅速分離傷側海馬組織,-80℃保存,以備提取總RNA。
3總RNA抽提 收集組織標本,按Trizol試劑說明書提取總RNA。所提總RNA行紫外分光光度計檢測A260/A280在1.8~2.0之間,并計算濃度,-80℃保存備用。
4實時定量RT-PCR (real-time PCR)檢測notch1、hes1mRNA 表達 取 1μg總 RNA,使用 Fermentas逆轉錄試劑盒,隨機引物逆轉錄合成cDNA。按以下體系進行Real-time PCR反應:cDNA模板1μl,2×PCR mix 10μl,2μmol/L 上下游引物各 1μl,0.5μL 10×SYBR GreenI,加無菌水至 20μl,不加模板為陰性對照。將反應管置于ABI 7500 real-time PCR system中進行擴增反應。反應條件如下:95℃,10min;95℃ ,15sec,60℃ 30sec 72℃ 30s for 40cycles;72℃10min。以GAPDH為內參,假手術組海馬組織為對照組,用2-ΔΔCt值表示基因的相對表達量。Notch1 上 游 引 物 :5'-CCTTGGGTTCATGGATTAGTTTTG-3', 下 游 引 物 :5'-CTCAGTTGGATTTGGATGATGCT-3'。 Hes1 上 游 引 物 :5'-TACCCCAGCCAGTGTCAACAC-3', 下游引物:5'-TTTCCAGAATGTCTGCCTTCTCTA-3'。
5統計學處理 應用SPSS 17.0統計軟件進行統計學分析。所得數據均以±s表示,進行單因素方差分析。P<0.05為有統計學意義。
結 果
腦外傷后傷側海馬notch1和hes1 mRNA的表達變化
Real-time PCR結果顯示,腦外傷后notch1基因在傷后4h即開始升高,1d時達到高峰,較對照組升高約6倍,3d時有所回落,但仍維持在高水平,較對照組升高2倍;而hes1基因在傷后4h表達無明顯變化,1d時明顯升高,較對照組升高3倍,3d時則回落到正常水平,如圖1所示。

圖1 腦外傷后motch1、hes1 mRNA的表達
討 論
人類海馬區神經元與學習記憶緊密相關,但該區神經元對腦外傷極為敏感,傷后大量神經元變性壞死,導致患者學習記憶功能障礙,可作為評價腦損傷嚴重程度的重要指標之一[1]。目前研究證實,成體哺乳動物海馬齒狀回亞顆粒區存在內源性神經干細胞,后者是一類能自我更新,具有分化成神經元、神經膠質細胞和少突膠質細胞能力的細胞群。這些細胞在腦外傷后被激活,增殖分化成功能上成熟的神經元,并整合到海馬回路中,促進患者學習記憶功能改善[1]。
Notch信號通路為調控細胞命運的基本通路[5]。在腦的發育過程中,notch信號在神經干細胞增殖、分化過程中起著極為關鍵的作用[6,7]。激活notch信號,可維持神經干細胞的未分化狀態[7,8],促進其自我增殖[9]。最近研究表明,notch信號也在成年哺乳動物海馬區和室下區表達,在成體神經再生過程中發揮著類似的調控作用[2]。Notch1為一種跨膜受體,當其與鄰近細胞上的配體結合時,notch信號被激活,在γ-分泌酶的作用下,notch1釋放出notch胞內區域段(Notch intracellular domain,NICD),后者轉移至胞核內,與DNA結合蛋白RBP-J/CSL結合,激活下游轉錄抑制因子hes1,從而發揮notch1介導的調控作用[10]。
本研究結果發現,腦外傷后海馬區notch1 mRNA在傷后早期即開始升高,3d時仍維持在較高水平,hes1mRNA也在傷后早期升高1d,提示腦外傷可激活notch信號。而Sun、Urrea等[11-12]研究表明,腦外傷后海馬齒狀回內神經干細胞增殖在傷后早期即開始增殖,于2~3d時達到高峰,與傷后notch信號表達呈現時間上相一致的表達趨勢。由此可以推測,腦外傷后notch信號表達水平的升高可能與神經干細胞增殖分化相關。因此進一步全面深入研究notch信號調控腦外傷后成體神經干細胞增殖、分化機制,可為將來臨床治療提供新的可能靶點,具有十分重要的意義。
[1]Sun D,McGinn MJ,Zhou Z,et,al.Anatomical integration of newly generated dentate granule neurons following traumatic brain injury in adult rats and its association to cognitive recovery[J].Exp Neurol,2007,204(1):264-272.
[2]Oya S,Yoshikawa G,Takai K,et,al.Attenuation of Notch signaling promotes the differentiation of neural progenitors into neurons in the hippocampal CA1 region after ischemic injury[J]. Neuroscience,2009,158(2):683-692.
[3]Chen Y,Constantini S,Trembovler V,et,al.An experimentalmodel of closed head injury in mice:pathophysiology,histopathology,and cognitive deficits[J].JNeurotrauma,1996,13(10):557-568.
[4]Beni-Adani L,Gozes I,Cohen Y,et,al.A peptide derived from activity-dependent neuroprotective protein(ADNP)ameliorates injury response in closed head injury in mice[J].JPharmacol Exp Ther.2001,296(1):57-63.
[5]Artavanis-Tsakonas S,Rand MD,Lake RJ.Notch signaling:cell fate control and signal integration in development[J].Science,1999,284(5415):770-776.
[6]de la Pompa JL,Wakeham A,Correia KM,et,al.Conservation of the Notch signaling pathway in mammalian neurogenesis[J].Development,1997,124(6):1139-1148.
[7]Hitoshi S,Alexson T,Tropepe V,et,al.Notch pathway molecules are essential for themaintenance,but not the generation,ofmammalian neural stem cells[J].Genes Dev,2002,16(7):846-858.
[8]Nyfeler Y,Kirch RD,Mantei N,et,al.Jagged1 signals in the postnatal subventricular zone are required for neural stem cell self-renewal[J].EMBO J,2005,24(19):3504-3515.
[9]Yoon K,Nery S,Rutlin ML,et,al.Fibroblast growth factor receptor signaling promotes radial glial identity and interacts with Notch1 signaling in telencephalic progenitors[J].J Neurosci,2004,24(43):9497-9506.
[10]Ohtsuka T,Ishibashi M,Gradwohl G,et,al.Hes1 and Hes5 as notch effectors in mammalian neuronal differentiation[J].EMBO J,1999,18(8):2196-2207.
[11]Sun D,Colello RJ,Daugherty WP,et,al.Cell proliferation and neuronal differentiation in the dentate gyrus in juvenile and adult rats following traumatic brain injury[J].JNeurotrauma,2005,22(1):95-105.
[12]Urrea C,Castellanos DA,Sagen J,et,al.Widespread cellular proliferation and focal neurogenesis after traumatic brain injury in the rat[J].Restor Neurol Neurosci,2007,25(1):65-76.

