離子液體催化合成食用香料乳酸乙酯的研究
張小曼
(昆明學院 化學科學與技術系,云南 昆明 650031)
乳酸乙酯為無色透明液體,具有特殊的水果、奶油和郎姆酒香味,是我國GB2760-86規定允許使用的食用香料,廣泛用作食品、飲料、牛奶、奶油和酒類的調香劑,也可做涂料、油漆、樹脂和硝化纖維的溶劑[1]。乳酸乙酯在工業上常用硫酸催化法生產,該方法存在設備腐蝕嚴重,后處理工藝復雜,廢液排放量大,原料利用率低等缺點。因此,開發低成本,無污染、環境友好的催化劑已成為合成香料研究的熱點問題。離子液體是由有機陽離子和無機或有機陰離子構成的在室溫下呈液態的鹽。離子液體中陰、陽離子的修飾和嫁接不同官能團,可賦予離子液體特殊的功能。酸性功能化離子液體應用于酯化反應有較好的催化活性[2-4]。本實驗制備了1-磺酸丙基-3-甲基咪唑硫酸氫鹽([HSO3-pmim]HSO4)酸性離子液體,應用于催化合成乳酸乙酯的反應中,考察了離子液體的催化活性及乳酸乙酯的最佳合成條件,為食用香料乳酸乙酯的化工生產提供可借鑒的實踐經驗。
1 實驗部分
1.1 主要儀器與試劑
508-B型紅外光譜儀(PE);INOVA-300H型核磁共振儀(Varian);WAY-1S阿貝折射儀(上海光學儀器廠);SP-501N氣相色譜儀(山東魯南化工儀器廠)。
N-甲基咪唑(純度≥98%,浙江寧海市凱樂化工廠);1,3-丙烷磺酸內酯、1-氯正丁烷、四氟硼酸鈉、乳酸、乙醇、甲苯、乙醚、H2SO4均為化學純,北京化學試劑廠生產。
離子液體[bmim]BF4、[bmim]HSO4參考文獻[5]方法制備。
1.2 [HSO3-pmim]HSO4離子液體的制備
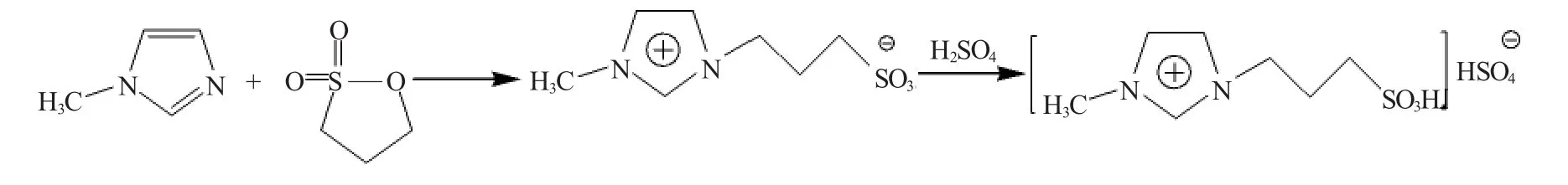
將1,3-丙烷磺酸內酯溶于甲苯中,磁力攪拌下滴加等物質的量的N-甲基咪唑,滴完后緩慢升溫至80℃,繼續反應2h,析出白色沉淀,過濾,用乙醚洗滌3次,100℃真空干燥,得到[MIM-PS](1-磺酸丙基-3-甲基咪唑鹽)。
將[MIM-PS]溶于水中,磁力攪拌下滴加等物質的量的硫酸,滴完后緩慢升溫至80℃,繼續反應2h,用乙醚洗3次,真空除水3h,得到[HSO3-pmim]HSO4(1-磺酸丙基-3-甲基咪唑硫酸氫鹽)。總反應式:
1.3 乳酸乙酯的合成
在裝有分水器、溫度計和回流冷凝器的三口燒瓶中加入一定量的[HSO3-pmim]HSO4、乳酸、乙醇,磁力攪拌加熱回流分水,反應結束后靜置冷卻,離子液體與乳酸乙酯分層,傾出酯層,取樣測定其酸值。采用國家標準提供方法測定反應前后酸值的變化[6],計算酯化率:
所得粗酯用10%Na2CO3溶液洗,再分別用飽和NaCl溶液、蒸餾水洗至中性,分出水層后,經無水MgSO4干燥后,轉入蒸餾燒瓶中,常壓下蒸餾出未反應的乙醇后減壓蒸餾收集61~63℃(2.5kPa)的餾分為產品。

2 結果與討論
2.1 [HSO3-pmim]HSO4的結構表征
[MIM-PS]的結構表征:1H NMR(300MHz,D2O),δ2.26(m,2H),2.86(t,2H),3.83(s,3H),4.30(t,2H),7.38(s,1H),7.46(s,1H),8.70(s,1H)。IR(KBr),ν/cm-1:3450,3154,3110,2962,1640,1575,1195,1043,746,622,532。
[HSO3-pmim]HSO4的結構表征:1HNMR(300MHz,D2O),δ2.11(m,2H),2.71(t,2H),3.71(s,3H),4.16(t,2H),7.25(s,1H),7.32(s,1H),8.53(s,1H)。IR(KBr),ν/cm-1:3437,3154,2970,1722,1653,1574,1230,11 72,1029,835,582。
以上數據表明與目標離子液體結構相符[7]。
2.2 不同催化劑催化活性的對比
考察不同離子液體對乳酸乙酯合成的催化性能,實驗條件為:0.2mol乳酸、0.3mol乙醇、反應時間2.0h,分別加入不同離子液體進行實驗,結果見表1。
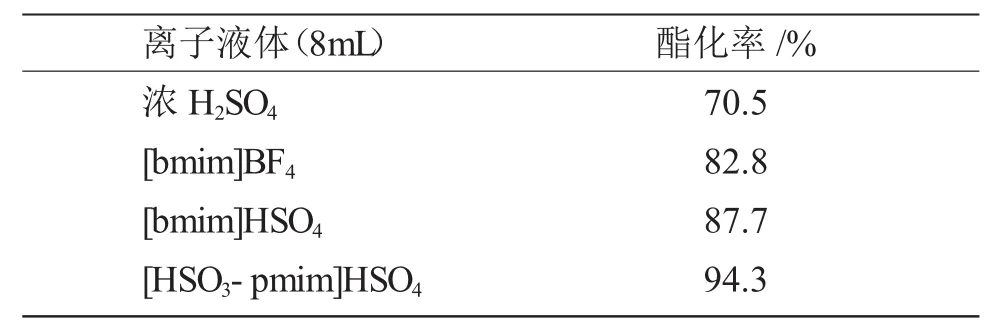
表1 不同離子液體對酯化率的影響Tab.1 Effect of different ionic liquid on the esteriffication rate
由表1可知,3種離子液體對酯化反應均有良好的催化活性。其中以[HSO3-pmim]HSO4催化活性最好,[bmim]HSO4次之。酯化反應屬于酸催化機理的反應,離子液體中陽離子相同時,陰離子的酸性:催化活性:[bmim]HSO4>[bmim]BF4;陰離子相同時,陽離子中咪唑烷基磺酸基化后,對催化活性有增強作用。因此,[HSO3-pmim]HSO4是催化合成乳酸乙酯的優良催化劑。
2.3 乳酸乙酯合成條件的優化
為獲得最佳合成條件,以酯化率為考察目標,固定乳酸用量0.2mol,選擇酸醇摩爾比、離子液體([HSO3-pmim]HSO4)用量、反應時間和反應溫度為考察因素,采用四因素三水平進行L9(34)正交實驗,因素與水平的選擇見表2,正交實驗結果見表3。

表2 因素水平表Tab.2 Factors and levels of test
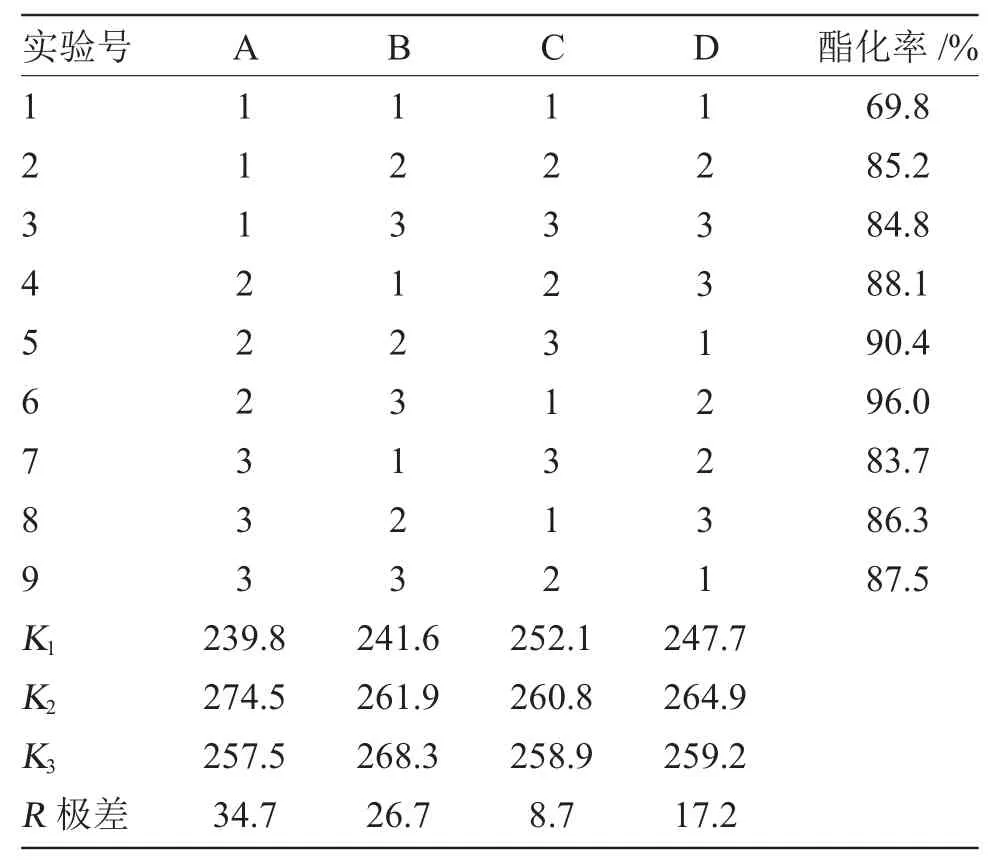
表3 L9(34)正交實驗方案和結果Tab.3L9(34)orthogonal design experiment and results
由表3可知,各種因素對酯化率的影響程度為:酸醇摩爾比(A)>離子液體用量(B)>反應溫度(D)>反應時間(C),即酸醇摩爾比對酯化率的影響最大,離子液體用量、反應溫度影響次之,反應時間影響最小。其最佳合成條件為:A2B3C2D2,即乳酸 0.2mol、乙醇 0.3mol、離子液體 10mL、反應時間2.0h,反應溫度110℃,酯化率較高。
2.4 最優合成條件的驗證
在正交實驗結果得出的A2B3C2D2最優合成條件下進行平行實驗5次,結果見表4。

表4 最佳反應條件的重復實驗Tab.4 The confirmation of the optimum reaction conditions
由表4可見,在此合成條件下,不僅酯化率高,而且重現性好,平均酯化率達96.6%,該合成條件可行。
2.5 離子液體[HSO3-pmim]HSO4重復使用性能的考察
酯化反應結束后,將分離出的離子液體蒸餾除水后,用于下次反應中,按上述最優合成條件對催化劑重復使用性能進行實驗,結果見表5。

表5 [HSO3-pmim]HSO4重復使用對酯化率的影響Tab.5 Effect of repeated use of[HSO3-pmim]HSO4on the esteriffication rate
由表5可見,離子液體重復使用6次,平均酯化率為96.3%,仍保持良好的催化活性,可以重復使用。
2.6 產品分析
上述方法所得產品為無色透明液體,有特殊的奶油、酒的香味,沸點 154.0℃(101.3kPa),相對密度1.042(20℃),其折光率與乳酸乙酯的文獻值相符[1]。在產品紅外光譜圖中有:C-H鍵2960cm-1,2876cm-1,C=O鍵 1735cm-1,C-O 鍵 1132cm-1的特征吸收峰,與乳酸乙酯標準譜圖相符,所得產品為乳酸乙酯,其含量>99%(氣相色譜儀分析)。
3 結論
酸性離子液體[HSO3-pmim]HSO4是合成乳酸乙酯反應的良好催化劑,其具有不揮發無污染、催化活性好的特點。離子液體與產物乳酸乙酯不溶,易分離,經簡單處理后可重復使用,經濟成本較低。實驗表明:0.2mol乳酸、0.3mol乙醇、10mL[HSO3-pmim]HSO4,反應時間2.0h,酯化率達96.7%。
酸性離子液體作為一種新型的催化劑,在合成香精、香料的酯化反應中應有很好的應用前景。
[1]凌關庭,唐述潮.食品添加劑手冊(第二版)[M].北京:化學工業出版社,1997.372-373.
[2]鄧友全.離子液體-性質、制備與應用[M].北京:中國石化出版社,2006.3-8.
[3]岳彩波,魏運祥,呂敏杰.新型酸性離子液體[Hmim]HSO4中合成乙酸酯[J].應用化學,2006,23(11):1282-1285.
[4]劉明燈,趙文軍,楊丹紅,等.高活性Bronsted離子液體催化酯化反應[J].化學試劑,2007,29(10):587-589.
[5]盧澤湘,袁霞,吳劍,等.咪唑類離子液體的合成和光譜表征[J].化學世界,2005,(3):148-150.
[6]中國標準出版社.化學工業標準匯編-化學助劑[M].北京:中國標準出版社,1996.
[7]叢曉輝,桂建舟,陳曉梅,等.SO3H-離子液體催化苯酚和叔丁醇選擇性烷基化反應[J].石油化工高等學校學報,2005,18(2):1-4.

