慢性阻塞性肺疾病患者血氣分析與D-二聚體、纖維蛋白原的相關性研究
李燕舞
(成都市第三人民醫院呼吸內科,四川成都 610031)
慢性阻塞性肺疾病患者血氣分析與D-二聚體、纖維蛋白原的相關性研究
李燕舞
(成都市第三人民醫院呼吸內科,四川成都 610031)
目的探討慢性阻塞性肺疾病(COPD)患者D-二聚體(D-D)、纖維蛋白原(Fbg)與血氣分析的變化及其相關性。方法對180例COPD急性加重期患者、166例COPD穩定期患者和40例健康體檢者檢測凝血酶原時間(PT)、活化部分凝血酶時間(APTT)、凝血酶時間(TT)、纖維蛋白原(Fbg)等4項凝血標本和D-D、血氣分析。結果急性加重期患者 Fbg和 D-D含量顯著高于穩定期患者和正常對照組,穩定期含量也明顯高于正常對照組,差異均有統計學意義(P<0.05),COPD急性加重期動脈血氧分壓與血漿D-D、Fbg水平間呈顯著負相關(r=-0.71,P<0.01),動脈血二氧化碳分壓與血漿D-D、Fbg水平間呈顯著正相關(r=0.55,P<0.05)。結論對COPD患者進行監測Fbg和D-D水平,有助于采取有效的防治措施,可控制病情的發展,改善疾病的預后。
慢性阻塞性肺疾病;D-二聚體;纖維蛋白原;血氣分析
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一種嚴重危害群眾健康的慢性呼吸系統疾病。中國近期的流行病學調查顯示,COPD發病率在40歲以上人群為8.2%[1]。COPD急性加重(AECOPD)是指患者出現超越日常狀況的持續惡化,并需要改變基礎COPD的常規用藥者,通常在疾病過程中,患者短期內咳嗽、咳痰、氣短和(或)喘息加重,痰量增多,呈膿性或黏膿性,可伴發熱等炎癥明顯加重的表現[1]。AECOPD嚴重影響患者的生活質量和預后,對患者及醫療體系均造成巨大的經濟負擔。預防、早期發現和及時治療AECOPD可以改善生活質量和減少住院時間、次數,從而延緩疾病進展。
凝血酶原時間(PT)、活化部分凝血酶時間(APTT)、凝血酶時間(T T)、纖維蛋白原(Fbg)等4項凝血標本是反映人體凝血功能的重要指標。Fbg是由肝臟合成的存在于血漿中的一種急性時相反應蛋白。近年來人們發現血漿Fbg升高是血栓性疾病的危險因素,可作為判斷血栓前狀態、肺組織損傷的指標。人體凝血系統激活的同時,纖溶系統也被激活。D-二聚體(D-D)是交聯纖維蛋白在纖溶系統作用下的可溶性降解產物,為一個特異性的纖溶過程標記物,在血栓栓塞時因血栓纖維蛋白溶解使其在血中濃度升高。本研究旨在檢測COPD患者血氣分析、凝血功能的變化及其相關性,以探討其臨床應用價值。
1 資料與方法
1.1 一般資料 收集本院2008年1月至2009年6月期間收治AECOPD和COPD穩定期的住院患者資料,診斷標準按中華醫學會呼吸病學分會制定《慢性阻塞性肺疾病診治指南》[1],病例排除:測試前2周服用過阿司匹林、華法林等抗凝藥物,合并心腦血管疾病,肝、腎等功能障礙性疾病及血液病的病例。其中AECOPD患者 180例,年齡(62±14)歲,男98例,女 82例;COPD穩定期患者166例,年齡(60±15)歲,男92例,女74例;正常對照組 40例,均為健康體檢者,年齡(57±12)歲,男21例,女 19例。
1.2 標本采集 (1)取血時間:COPD組患者入院次日清晨空腹及治療緩解后清晨抽血,正常對照組為清晨空腹抽血,血氣分析為住院當時及緩解期抽血。(2)檢測方法:①取靜脈血3 mL置于1/10體積抗凝液(0.109 mL枸櫞酸鈉)的試管中,充分混勻,血標本無凝固、溶血、脂濁,3 000 r/min離心10 min,收集上清液(血漿)置于-20℃冰箱保存。②血氣分析抽動脈血1 mL(肝素抗凝),由血氣分析儀測定。±s)
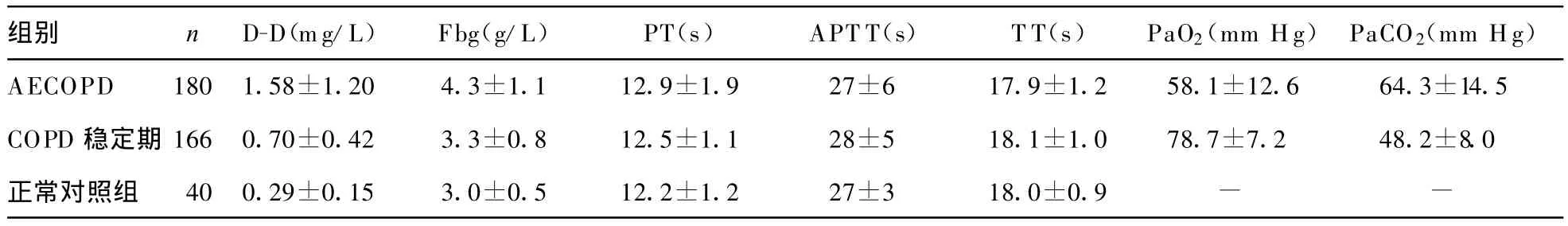
表1 AECOPD、COPD穩定期和正常對照組凝血4項、D-D水平、血氣分析值比較(x
1.3 檢測項目、儀器及試劑 日本Sysmex公司CA-1500自動血凝分析儀上測定PT、APTT、TT、Fbg、D-D;D-D采用發色底物法測定,試劑為德國Dade behning marburg公司產品。
1.4 統計學方法 采用SPSS14.0統計軟件進行統計分析,數據用±s表示,組間比較采用單因素方差分析。血氣分析與D-D、Fbg的相關性用相關系數分析方法,以P<0.05為差異有統計學意義。
2 結 果
急性加重期Fbg和D-D含量顯著高于穩定期和正常對照組,差異有統計學意義(P<0.05)。穩定期Fbg和D-D含量也明顯高于正常對照組,差異有統計學意義(P<0.05)。PT、APT T、T T含量在3組間差異均無統計學意義(P>0.05)。COPD急性加重期動脈血氧分壓(PaO2)與血漿D-D、Fbg水平間呈顯著負相關(r=-0.71,P<0.01),COPD急性加重期動脈血二氧化碳分壓(PaCO2)與血漿D-D、Fbg水平間呈顯著正相關(r=0.55,P<0.05),結果見表1。
3 討 論
COPD患者肺部基本病理表現是肺氣腫與小氣道炎癥,不僅肺泡受到破壞,而肺泡間隔組織中微血管、毛細血管前微動脈也受到損害。由于肺血管存在大量受體和血管活性物質,當肺血管內皮細胞等受到激活、損傷后,可發生功能紊亂,大量釋放炎癥介質,激活凝血系統;低氧血癥導致繼發性紅細胞增多,增加了血液的黏度;此外,氧化應激、高碳酸血癥均可損傷內皮細胞功能,而損傷的內皮細胞促進血液凝固[2],COPD患者出現高凝狀態。Ogawa等[3]報道缺氧狀態下改變內皮細胞功能,抑制凝血酶調節蛋白表達,從而促進凝血系統激活,是COPD患者肺血管易發生微血栓栓塞的重要原因。
目前認為,某些與血栓形成有關的疾病,在血栓形成之前,其體內已存在一種被稱為血栓前狀態(prethrombotic state)的病理過程,亦有稱為血栓前期(prethrombotic phase),系指其血液有形成分或無形成分的生物化學及流變學的病理性改變。可表現為:(1)血管內皮細胞受損或被刺激;(2)血小板與白細胞被激活或功能亢進;(3)凝血蛋白(凝血因子)含量增加或被活化;(4)抗凝蛋白(抗凝因子)含量降低或結構異常;(5)纖溶因子含量減少或功能減弱;(6)血液黏度增加或血流減慢等。在此類病理狀態下,循環血液可能發生但又并不必然發生血栓形成,若能根據某些分子標志物的改變,及早診斷血栓前狀態的存在,采取適當措施,可望改善疾病的預后[4]。目前學者把COPD出現靜脈血栓塞癥(venous throm boebolism,VTE)的機制主要歸結為COPD的血栓前狀態,并從相應的指標加以論證[5-7]。
但常規試驗,如PT、APTT等常難以及早發現COPD患者的血栓前狀態。近年來人們發現血漿Fbg升高是血栓性疾病的危險因素,可作為判斷血栓前狀態、肺組織損傷的指標。Gan等[8]報道Fbg是氣道炎癥的系統性標記物之一。本研究結果顯示,PT、APTT、TT水平在3組間差異無統計學意義(P>0.05),而Fbg水平在3組間差異有統計學意義(P<0.05),COPD組均顯著高于正常對照組,提示可能存在血栓前狀態,AECOPD組水平高于COPD穩定組,表明COPD進展為AECOPD時,Fbg含量也明顯升高,AECOPD時可能導致血栓發生率進一步增高。
人體凝血系統激活的同時,纖溶系統也被激活。血漿D-D是交聯纖維蛋白的特異降解產物,其水平的增高表明體內有血栓形成及繼發性纖溶的發生,對體內高凝狀態和血栓性疾病的診斷、療效觀察、預后判斷具有廣泛的應用價值。本研究表明,D-D水平在3組間差異有統計學意義(P<0.05),AECOPD期D-D含量明顯高于穩定期和正常對照組,穩定期含量也明顯高于正常對照組(P<0.05),說明COPD患者體內存在血栓形成,伴有繼發性纖溶的發生,并隨COPD病情發展,含量進一步增加,與相關文獻報道一致[9-12]。本文顯示,AECOPD期PaO2與D-D水平呈顯著負相關,動脈血PaCO2與D-D水平呈顯著正相關,表明低氧血癥、高碳酸血癥與患者血漿D-D水平的增高有著密切關系。有研究證實:COPD患者應用肝素治療后,患者D-D、Fgb等凝血指標均明顯下降,同時伴有動脈血PaCO2降低及PaO2增高,這表明凝血系統變化與血氣改變密切相關[12-15]。
COPD患者的高凝狀態和肺動脈高壓時發生微血栓栓塞情況與血漿中Fbg和D-D含量高低一致,因此,對COPD患者進行監測Fbg和D-D水平,臨床治療中改善缺氧、通氣功能及適當的抗凝治療對控制病情的發展,改善疾病的預后有重要的價值。
[1]中華醫學會呼吸病學分會慢性阻塞性肺疾病學組.慢性阻塞性肺疾病診治指南(2007年修訂版)[J].中華結核和呼吸雜志,2007,30(4):8.
[2]李立宇,王辰,龐寶森.慢性阻塞性肺疾病與凝血-纖溶功能異常[J].國際呼吸雜志,2007,27(14):1081.
[3]Ogawa S,Sheenwas R,Brett T,et al.The effect of hypoxia on capillary endothelial cell function:modulation of barrier and coagulant function[J].Br T Haemotol,1990,75(4):517.
[4]謝敏,王曾禮.肺癌患者的血栓前狀態及其臨床意義[J].中華內科雜志,1997,36(2):36.
[5]Dahl M,Tybjaerg-Hansen A,Vestbo J,et al.Elevated plasma fibrinogen associated with reduced pulmonary function and increased risk of chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2001,164:1008.
[6]Ashitani J,M ukae H,Arimura Y,et al.Elevated plasma procoagulant and fibrinolytic markers in patients with chronic obstructive pulmonary disease[J].Intern Med,2002,41:181.
[7]Kwaan HC,Wang J.Hyperviscosity in polycythemia vera and other red cell abnormalities[J].Semin Thromb Hemost,2002,29:451.
[8]Gan WQ,Senthilselav A.Aesociation between chronic obstructive pulmonary disease and a meta-analysis[J].Thorax,2004,59(7):574.
[9]程莉,劉茜.老年AECOPD患者血漿 D-二聚體分析[J].重慶醫學,2009,38(7):847.
[10]Mispelaere D,Glerant JC,Audebert M,et al.Pulmonary embolism and sibilant types of chronic obstructive pulmonary disease decompensations[J].Rev Mal Respir,2002,19(4):415.
[11]Hartmann IJ,Hagen PJ,Melissant CF,et al.Effect of chronic obstructive pulmonary disease on the performance of D-dimer testing,ventilation/perfusion scintigraphy,spiral computed tomographic angiography,and conventional angiography[J].Am J Respir Crit Care Med,2000,162(6):2232.
[12]趙建華,馮孟森,王倩,等.抗凝治療肺心病血栓前狀態的臨床研究[J].中國醫師雜志,2004,6(12):1622.
[13]梁銘海,劉勇,蘇偉強.低分子肝素聯合前列腺素E1對肺心病急性加重期的療效觀察[J].中國全科醫學,2003,6(10):861.
[14]馬五林.抗凝療法在慢性阻塞性肺疾病中的應用觀察[J].醫藥論壇雜志,2009,30(18):32.
[15]Cordova C,Violi F,Alessandri C,et al.Improvement of blood gas levels after calcium heparin treatment in patients with chronic obstructive pulmonary disease[J].Thromb Res,1992,68:435.
R563;R446.112
B
1671-8348(2010)12-1592-03
2009-09-08
2009-11-17)
·經驗交流·

