分光光度法測定破壁靈芝孢子粉中總三萜含量研究
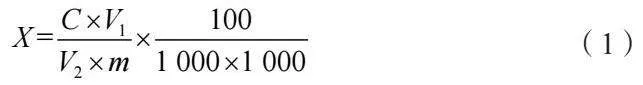



摘 要:目的:優化分光光度法測定破壁靈芝孢子粉中總三萜含量的分析方法。方法:分別針對方法中提取液除雜方式、揮干方式及水浴反應條件等進行優化,并對優化后的方法線性、檢出限、定量限、準確性、專屬性及重復性等進行驗證。結果:測試方法中揮干方式為沸水浴揮干、除雜方式為4 000 r·min-1離心10 min、水浴條件為60 ℃反應15 min;熊果酸標準溶液在20~160 μg范圍內線性良好,相關系數R2為0.999 2,加標回收率在93.12%~97.73%,相對標準偏差低于0.64%,方法檢出限為0.120 3 μg·mL-1,定量限為0.361 0 μg·mL-1。結論:該方法操作簡便,條件明確,具有良好的準確度和精密度,適用于破壁靈芝孢子粉中總三萜含量測定。
關鍵詞:分光光度法;破壁靈芝孢子粉;總三萜
Abstract: Objective: To optimize the spectrophotometric analysis method for the determination of total triterpenoids in Ganoderma lucidum spore powder. Method: The extraction method of impurity removal, evaporation method and water bath reaction conditions were optimized, and the linearity, detection limit, quantification limit, accuracy, specificity and repeatability of the optimized method were verified. Result: The evaporation method was boiling water bath evaporation, impurity removal method was 4 000 r·min-1 centrifugation for 10 min, and water bath condition was 60 ℃ reaction for 15 min. The standard solution of ursolic acid had good linearity in the mass concentration range of 20 μg to 160 μg, the correlation coefficient R2 was 0.999 2, the recovery rate was between 93.12% and 97.73%, the relative standard deviation was lower than 0.64%, the method detection limit was 0.120 3 μg·mL-1, and the quantification limit was 0.361 0 μg·mL-1. Conclusion: This method is simple to operate, the conditions are clear, and the test results are highly accurate, which is suitable for the determination of total triterpenoid content in Ganoderma lucidum spore powder.
Keywords: spectrophotometry; Ganoderma lucidum spore powder; triterpenes
靈芝(Ganoderma lucidum)又稱為菌靈芝,是靈芝科靈芝屬真菌的總稱[1-2]。靈芝最早記錄于西漢時期《淮南子·修務訓》[3-4],《神農本草經》[5-8]將“青芝、赤芝、黃芝、紫芝、黑芝、白芝”六芝列為草部上品之首[9],其中赤芝和紫芝為《中華人民共和國藥典》(2000版)首次收載[10]。靈芝具有抗腫瘤、抗衰老、降低血糖血脂及免疫調節等作用[11]。目前市面上的靈芝制品有破壁靈芝孢子粉、靈芝孢子油、靈芝孢子油軟膠囊等,以破壁靈芝孢子粉居多。破壁靈芝孢子粉是一種重要的保健食品原料,三萜類化合物是破壁靈芝孢子粉中最主要的活性成分[12],具有多種生理活性,如保肝護肝[13]、抗炎[14]、降血糖[15]、抗腫瘤[16]、抗氧化[17]、神經保護[18]等,應用前景廣泛。因此,三萜類化合物含量可作為評價破壁靈芝孢子粉質量高低的一項重要指標。
三萜類化合物是一類基本母核由30個碳原子所組成的萜類化合物,含有-(C5H8)n-通式及含氧衍生物,由6個異戊二烯單位聚合而成。近年來,靈芝三萜逐漸受到研究者的重視,相關報道日漸增多,測定靈芝三萜含量的方法主要分為分光光度法和液相色譜法:液相色譜法準確度高,但需要大量的高純度三萜類化合物作為標準品,要分離獲得高純度具有代表性的三萜化合物對照品技術難度很大;分光光度法準確度雖不如液相色譜法,但能以目前自然界廣泛存在的三萜化合物熊果酸、齊墩果酸作為對照品。目前破壁靈芝孢子粉中總三萜含量測定基本采用分光光度法。
現有的破壁靈芝孢子粉中總三萜含量的分光光度方法諸多條件存在不明確的問題:《保健食品理化及衛生指標檢驗與評價技術指導原則》(2020年版)中使用了離心,但是并未明確離心的條件;《保健食品功效成分檢測方法》一書中針對總三萜含量測試方法的描述有,樣品提取后溶液渾濁可過濾等[12],但并未定義如何判斷渾濁。因破壁靈芝孢子粉極易產生懸浮,相關測試條件不明確將導致測試結果不準確、重現性差等問題。破壁靈芝孢子粉中總三萜的準確測定現為業內公認的技術難點,因此急需對測試方法進行優化,明確測試條件并驗證方法的可靠性。
本研究使用分光光度法測定破壁靈芝孢子粉中總三萜含量,通過對方法中揮干方式、除雜方式、水浴條件等進行優化,對所確立的方法線性范圍、檢出限與定量限、專屬性、重復性、準確性、耐用性等進行評價,驗證本方法的適用性、可靠性及優越性,為食品分析、檢測以及質量控制提供技術支持。
1 材料與方法
1.1 材料與試劑
熊果酸標準品(純度94.7%,CAS號77-52-1),BePure;乙酸乙酯、冰乙酸(分析純),天津大茂試劑廠;三氯甲烷(分析純),廣州試劑廠;高氯酸(優級純),成都市科隆公司;香草醛(分析純),天津科密歐公司。
1.2 儀器與設備
UV-1800光度計(SHIMADZU);ME204E、ME155DU分析天平(瑞士Mettler Toledo公司);恒溫水浴鍋(常州普天公司);XWDS-1018ST超聲波清洗器(東莞市萬德盛自動化設備公司);L-530離心機(湖南湘儀)。
1.3 試驗方法
1.3.1 溶液配制
熊果酸標準品溶液(100 μg·mL-1):準確稱取熊果酸標準樣品10 mg至100 mL容量瓶中,加乙酸乙酯超聲溶解,定容,搖勻。
香草醛-冰乙酸溶液(50 mg·mL-1):準確稱取香草醛5.0 g,加冰乙酸使溶解并定容至100 mL,即得。臨用前配制。
1.3.2 試樣制備
準確稱定試樣0.1 g(相當于總三萜質量為0.5~5.0 mg),置于50 mL容量瓶,加三氯甲烷約30 mL,50 kHz超聲處理30 min,0 ℃水浴冷卻,加三氯甲烷定容,混勻,轉移靜置30 min,4 000 r·min-1離心10 min,移取上清液測用。
1.3.3 標準曲線的制作
準確移取熊果酸標準使用溶液0 mL、0.10 mL、0.20 mL、0.40 mL、0.80 mL和1.00 mL于比色管中,沸水浴揮干,冷卻后精密加入0.40 mL香草醛-冰乙酸溶液,轉動比色管使殘渣溶解,再準確加入1.0 mL高氯酸,混勻后放置60 ℃水浴中反應15 min,取出,0 ℃冰浴冷卻,精密加入冰乙酸5.0 mL搖勻,15 min后轉移至比色皿中,在548 nm波長測定吸光度。以吸光度為縱坐標,標準品質量為橫坐標繪制標準曲線。
1.3.4 試樣溶液的測定
精密量取試樣上清液1.0 mL置10 mL比色管中,沸水浴揮干,冷卻后精密加入0.4 mL香草醛-冰乙酸溶液,轉動比色管使殘渣溶解,再準確加入1.0 mL高氯酸,混勻后放置60 ℃水浴中反應15 min,取出,0 ℃冰浴冷卻,精密加入冰乙酸5.0 mL搖勻,15 min后轉移至比色皿中,在548 nm波長測定吸光度,根據標準曲線計算樣品溶液中總三萜的含量。
1.3.5 數據處理
試樣中總三萜(以熊果酸計)含量按公式(1)計算。
式中:X為試樣中總三萜(以熊果酸計)含量,g/100 g;C為標準曲線查得待測樣液中熊果酸質量,μg;m為試樣質量,g;V1為試樣三氯甲烷定容總體積,mL;V2為移取試樣上清液體積,mL。
2 結果與分析
2.1 測定波長的選擇
取熊果酸標準溶液和破壁靈芝孢子粉三萜提取溶液,經香草醛-冰乙酸和高氯酸顯色后,在450~700 nm掃描,獲得吸光度曲線見圖1。由圖1可知,在548 nm波長處熊果酸有最大吸收,在550 nm處破壁靈芝孢子粉三萜有最大吸收,兩者最大吸收波長基本一致,符合《中華人民共和國藥典》(2020版)最大波長允許誤差范圍要求,故確定548 nm為測定波長。
2.2 靈芝制品的選擇
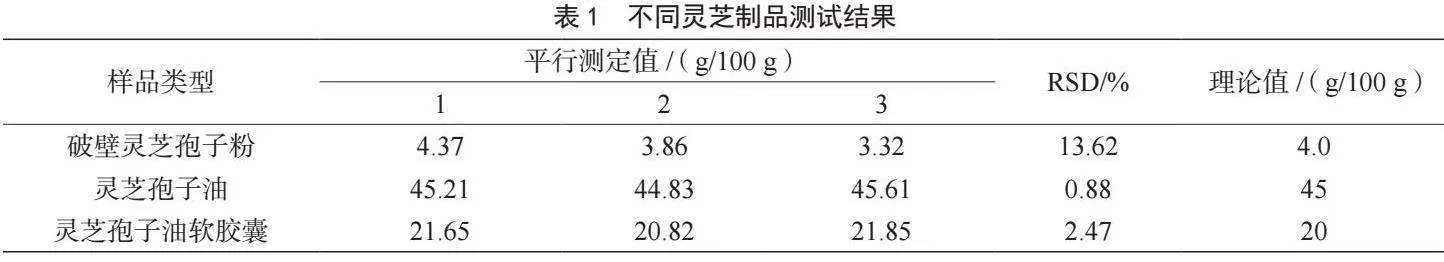
選擇不同類型的靈芝制品(破壁靈芝孢子粉、靈芝孢子油、靈芝孢子油軟膠囊),按照《保健食品理化及衛生指標檢驗與評價技術指導原則》(2020年版)中規定的方法進行測定,結果如表1所示。通過測試結果可以看出,破壁靈芝孢子粉的相對標準偏差(Relative Standard Deviation,RSD)較大,且與理論值偏差較大,故選擇破壁靈芝孢子粉作為進一步優化研究基質。
2.3 條件優化
2.3.1 除雜方式的考察
在樣品制備階段,除雜方式可分為濾紙過濾、0.45 μm有機相濾膜過濾、4 000 r·min-1離心(分別設置離心時間5 min、10 min、20 min)3種。表2結果表明,3種方式的結果都比較穩定,濾紙過濾和0.45 μm有機濾膜過濾的測試結果與理論結果有一定的偏差,離心方式的測試結果更接近理論值。在離心時間的選擇方面,不同離心時間狀態如圖2所示,離心10 min后上清液澄清無肉眼可見懸浮顆粒。因此,選擇4 000 r·min-1離心10 min作為除雜方式進行試驗。
2.3.2 揮干方式的考察
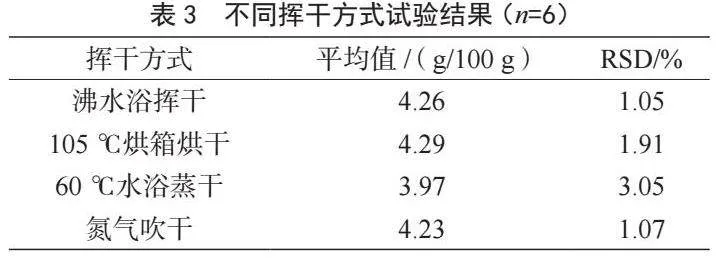
在樣品測定階段,揮干方式可分為沸水浴揮干、105 ℃烘箱烘干、60 ℃水浴蒸干、氮氣吹干4種方式,表3結果表明:沸水浴揮干方式RSD為1.05%,結果穩定,重現性比其他方式更好。后續選擇沸水浴揮干進行試驗。
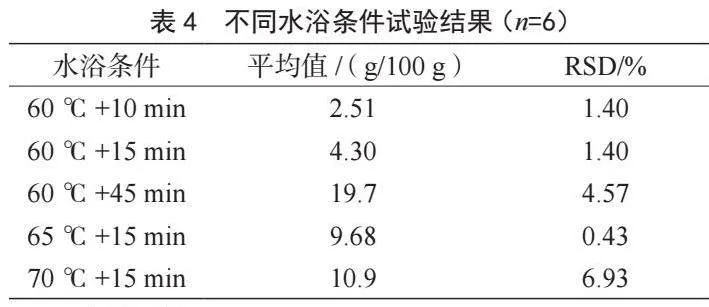
2.3.3 水浴條件的考察
樣品測定階段,分別在60 ℃+10 min、60 ℃+15 min、60 ℃+45 min、65 ℃+15 min和70 ℃+15 min 5種條件組合下,考察反應溫度和時間對測試結果的影響(表4)。可以發現,測定值與水浴溫度和水浴時間呈正相關:溫度控制在60 ℃不變時,隨水浴時間增長測試結果變大;當水浴時間均控制在15 min時,隨著水浴溫度升高測試結果變大。結果表明,60 ℃+15 min條件下測試結果與理論值更接近,偏差最小,因此選擇此水浴條件。
2.4 方法驗證
2.4.1 線性范圍驗證
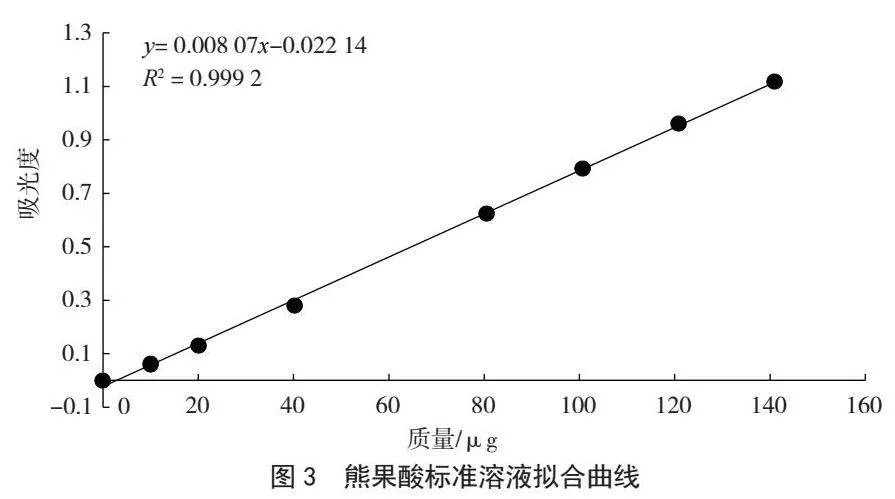
分別精密吸取熊果酸標準品溶液按1.3.3操作測定吸光值,如圖3所示,以熊果酸的質量為橫坐標,以吸光值縱坐標,進行線性回歸,得到回歸方程為Y=0.008 07X-0.022 14,相關系數R2=0.999 2,結果表明熊果酸標準品在20~160 μg范圍內與吸光值線性關系良好。
2.4.2 檢出限和定量限考察
通過分析20個獨立試劑空白來計算方法檢測限,通過計算得,標準偏差Sd=0.002 104 μg,檢出限L’=3×Sd/b=0.782 2 μg(b為標準曲線斜率,0.008 07),此時檢出限L對應試樣濃度為0.120 3 μg·mL-1,因此定量限=3×L=0.361 0 μg·mL-1。
2.4.3 專屬性實驗
按照樣品的組分特點,采用羥丙基纖維素和葡萄糖混合(8∶2,m/m)配制陰性樣品,同時做試劑空白,比較兩組數據可知,空白溶液與陰性樣品均無吸收,專屬性良好。
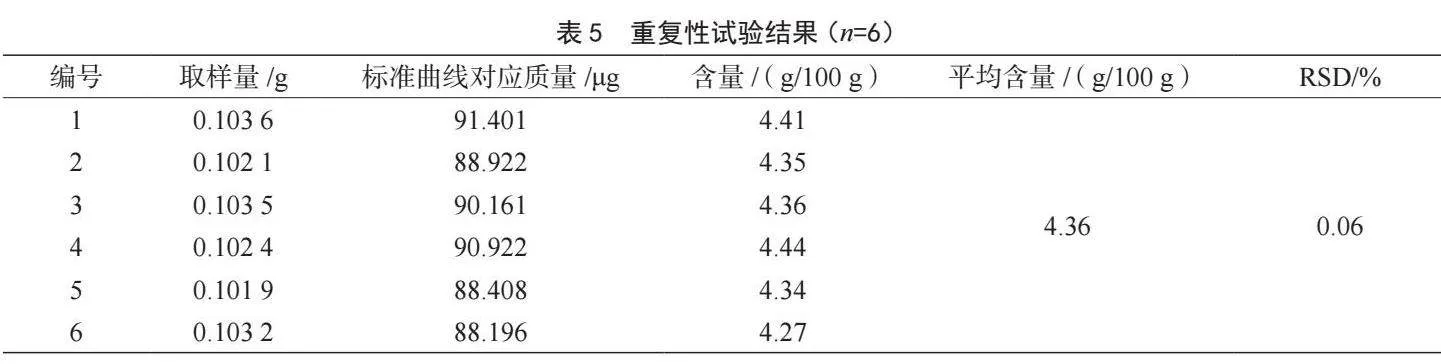
2.4.4 重復性試驗
選取一款靈芝孢子粉精密稱取0.1 g,平行稱取6份按1.3.2方法進行樣品處理,按2.3方法優化的條件進行重復性測試。測試結果如表5所示,樣品中總三萜平均含量為4.36 g/100 g,RSD為0.06%,方法重復性良好。
2.4.5 準確度試驗
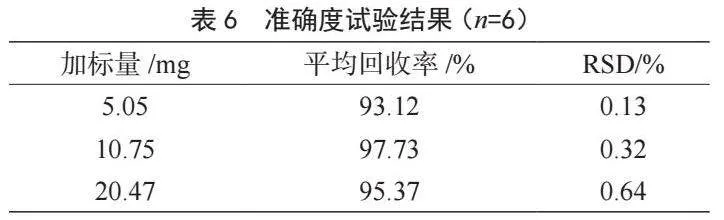
精密稱取重復性試驗環節靈芝孢子粉樣品0.1 g,加入低、中、高3個濃度水平的熊果酸標準品,考察方法的準確度。結果如表6所示,回收率在93.12%~97.73%,RSD在0.13%~0.64%,精密度和準確性良好。
3 結論
由于現有方法中測試條件不明確,導致破壁靈芝孢子粉中總三萜含量測試結果準確度低、穩定性差。本研究通過對方法中揮干方式、提取液除雜方式及水浴反應條件等進行優化,確立破壁靈芝孢子粉總三萜測試的最佳條件中揮干方式為沸水浴揮干、除雜方式為4 000 r·min-1離心10 min、水浴條件為60 ℃反應15 min。進一步對方法線性、檢出限、定量限、準確性、專屬性及重復性等進行驗證,結果表明該方法測試結果準確可靠。
綜合來看,該方法操作簡便,設備易得,耗時少,檢測效率高,適用于破壁靈芝孢子粉中總三萜含量測定,能夠為靈芝制品中功效成分含量準確測定提供有力技術手段,為保健食品企業檢測技術提升和產品質量控制提供技術支持。
參考文獻
[1]楊祝良.基因組學時代的真菌分類學:機遇與挑戰[J].菌物學報,2013,32(6):931-946.
[2]張彬彬.南召縣野生靈芝菌株的分離鑒定及其活性成分分析[D].邯鄲:河北工程大學,2021.
[3]林志彬.靈芝研究與開發的歷史、現狀和未來[C]//2004靈芝專題研討會論文摘要集.北京:中國藥理學會,2004:6-7.
[4]華敏.中國靈芝飲食的歷史變遷與發展展望[J].南寧職業技術學院學報,2009,14(6):6-9.
[5]賀新生.《菌物字典》第10版菌物分類新系統簡介[J].中國食用菌,2009,28(6):59-61.
[6]周選圍,林娟.中國野生靈芝資源的開發利用[J].食用菌學報,1999(1):58-64.
[7]張宏.真菌分類學中的分子生物學技術點評[J].國外醫學(皮膚性病學分冊),1997(4):215-219.
[8]趙繼鼎.我國古籍中記載六芝的初步考證[J].微生物學通報,1989(3):180-181.
[9]李明焱.《神農本草經》中靈芝的品屬及功效:靈芝研究溯源及其評價[C]//中醫經典理論內涵與臨床應用學術研討會暨醫史文獻分會、中醫經典與傳承研究分會(籌)學術年會文集.杭州:浙江省中醫藥學會,2012:26-31.
[10]鐘顯,程敏,林微微.靈芝食用歷史及安全性材料追溯[J].現代農業科技,2020(1):80-83.
[11]FATMAWATI S,SHIMIZU K,KONDO R.Ganoderol B: a potent ɑ-glucosidase inhibitor isolated from the fruiting body of Ganoderma lucidum[J]."Phytomedicine,2011,18(12):1053-1055.
[12]白鴻.保健食品功效成分檢測方法[M].北京:中國中醫藥出版社,2011.
[13]李鵬,魏曉霞,南婷婷,等.靈芝三萜酸對小鼠急性肝損傷的保護作用[J].中國醫院藥學雜志,2013,33(23):1914-1918.
[14]SMINA T P,JOSEPH J,JANARDHANAN K K.Ganoderma lucidum total triterpenes prevent γ -radiation induced oxidative stress in Swiss albino mice in vivo[J].Redox Report,2016,21(6):254-261.
[15]CHEN S D,LI X M,YONG T Q,et al.Cytotoxic lanostane -type triterpenoids from the fruiting bodies of Ganoderma lucidum and their strucure-activity relationships[J].Oncotarget,2017,8(6):10071-10084.
[16]SMINA T P,NITHA B,DEVASAGAYAM T P A,et al.Ganoderma lucidum total triterpenes induce apoptosis in MCF-7 cells and attenuate DMBA induced mammary and skin carcinomas in experimental animals[J].Mutation Rsearch Genetic Toxicology and Environmental Mutagenesis,2017,813:45-51.
[17]TENG X Q,ZHANG W Q,SONG Y Y,et al.Protective effects of Ganoderma lucidum triterpenoids on oxidative stress and apoptosis in the spleen of chickens induced by cadmium[J].Environmental Science and Pollution Research,2019,26(23):23967-23980.
[18]QIU J M,WANG X,SONG C G.Neuroprotective and antioxidant lanostanoid triterpenes from the fruiting bodies of Ganoderma atrum [J].Fitoterapia,2016,109:75-79.
作者簡介:謝林云(1983—),男,湖南永州人,碩士,工程師。研究方向:保健食品、營養成分檢測技術。

