苯甲酸衍生物與烯烴反應的研究進展
摘 要:導向基團協助的C—H鍵活化反應克服了傳統交叉偶聯反應中起始原料需要預先官能團化的缺點。在眾多導向基團中,由于羧基容易轉化,也容易除去,被認為是無痕導向基。羧酸與烯烴反應所得茚酮、苯酞等是生物活性分子、藥物分子的基本結構單元,因此這類反應具有重大的合成意義。對近30年不同過渡金屬催化苯甲酸衍生物與烯烴之間的反應進行闡述。
關 鍵 詞:羧酸;烯烴;C—H活化;苯酞;茚酮
中圖分類號:TQ245.1文獻標志碼: A 文章編號: 1004-0935(2024)08-1240-05
羧酸在自然界中儲量豐富,綠色環保,由于羧基的多功能性和良好的轉化能力使其成為有機合成中應用廣泛的起始原料。過去就有許多親電或親核取代反應用于羧酸的轉化[1-2],但是這些反應受限于親電試劑/親核試劑本身的反應性。如今羧酸在過渡金屬催化的C—H鍵活化反應領域中也被廣泛應用。與傳統C—H鍵活化反應方法相比,羧酸無需亞砜[3-8]、腙[9-11]、酰基[12-15]、硫氧葉立德[16-19]和N-取代的酰胺基[20-22]等導向基的協助,這為有機合成提供了一種更直接和原子經濟性更高的合成方法。在科學家的不斷探索下已經實現了一系列芳基羧酸的C—H鍵官能團化反應。在眾多芳基羧酸的C—H鍵官能團化反應中,芳香羧酸與烯烴之間的反應在有機合成中占據重要地位,二者能得到多種結構的產物。這些產物是生物有機分子、藥物分子或天然有機大分子中的基礎結構單元。
1 過渡金屬催化苯甲酸衍生物與烯烴的C—H烷基化反應研究進展
1.1 Re催化苯甲酸衍生物與烯烴的C—H烷基化反應
2011年,TAKAI課題組首次實現苯甲酸的鄰位烯丙基化[23],該方法通過使用預先合成的苯甲酸烯丙酯或苯甲酸與乙酸烯丙酯反應,以中等至良好的產率得到鄰烯丙基苯甲酸。然而,支鏈乙酸烯丙酯的產率較低,表明反應對空間位阻的敏感性較高。
1.2 Ru催化苯甲酸衍生物與烯烴的C—H烷基化反應
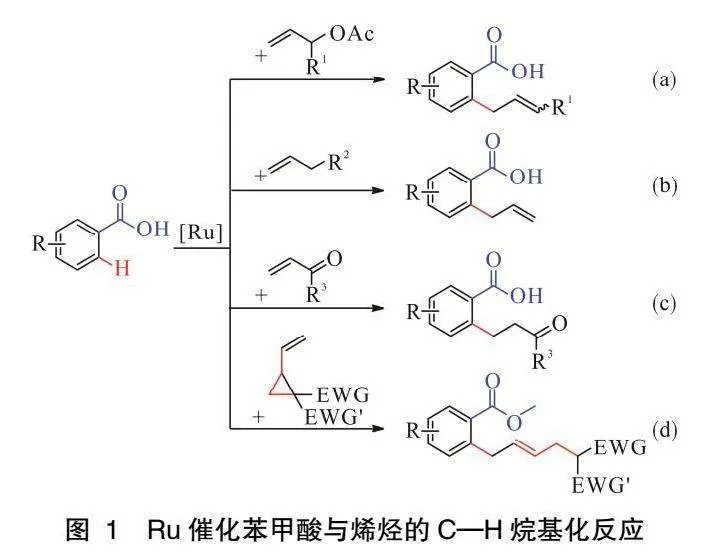
2017年,GOO?EN課題組[24]報道了Ru催化苯甲酸鄰位C—H官能團化反應(圖1a)。該反應以苯甲酸與乙酸烯丙酯為原料,選擇性活化苯甲酸鄰位C—H鍵生成相應的鄰烯丙基苯甲酸。該方法底物范圍廣,同時適用于直鏈和支鏈的乙酸烯丙酯。2018年,GOO?EN課題組[25]報道了Ru催化苯甲酸與未活化烯丙醇或烯丙醚發生C(sp2)—H活化/烯丙基化反應(圖1b)。同年,該課題組[26]發現在催化劑[RuCl2(p-cym)]2和堿Li3PO4的存在下,苯甲酸與α,β-不飽和酮在水中反應生成相應的鄰位烷基化苯甲酸(圖1c),產率中等至良好。這種C—H烷基化反應不僅適用于各種富電子和缺電子基團取代的苯甲酸,還兼容未保護的丙烯酸。與之前的工作相比,反應中所需的烯烴底物無需酯基的修飾。2019年,GOO?EN課題組[27]發現了使用Ru催化劑催化的苯甲酸衍生物與乙烯基環丙烷的鄰位C—H烯丙基化反應(圖1d)。該反應符合原子經濟性原則,官能團耐受性好,產率高,而且還具有較好的立體選擇性。反應使用乙烯基環丙烷作烷基化試劑成為羧基導向C—H鍵活化反應領域的一個重大進展。
2 過渡金屬催化苯甲酸衍生物與烯烴的C—H鍵活化/環化反應研究進展
2.1 Rh催化苯甲酸衍生物與烯烴C—H鍵活化/環化反應
2015年,SU課題組[28]首次通過Rh(Ⅲ)催化苯甲酸與烯烴的C—H烯基化/環化反應合成苯酞。該方法以氧氣作為唯一的氧化劑,為酞類骨架的合成提供了一種有用的方法。同年,CHENG課題組[29]報道了銠(Ⅲ)催化芳基羧酸或乙烯基羧酸與丙二烯類化合物的[4+1]環化反應,能以較高收率獲得目標產物。該反應具有較高的區域選擇性和立體選擇性,官能團耐受性好,為合成3-甲基-3-苯乙烯基苯酞提供了一條簡單直接的途徑。此外,該反應還可用于α,β不飽和羧酸和丙二烯合成具有生物活性的5-乙烯基取代2-呋喃酮。2020年,ZHANG課題組報道了一種新的反應體系[30],以苯甲酸、甲醛和丙二酸酯為原料,在不使用路易斯酸的情況下制備茚酮。在該反應條件下未檢測到之前報道的苯甲酸與丙烯酸酯在[Rh]或[Ru]催化下反應生成的苯酞衍生物。溶劑對該反應具有顯著影響,使用二氯乙烷作為溶劑時可以得到2-取代茚酮,當六氟異丙醇為溶劑時則得到非取代茚酮。該催化體系大大簡化了合成路線,為合成茚酮提供了實際的應用價值。
2.2 Ru催化苯甲酸衍生物與烯烴C—H鍵活化/環化反應
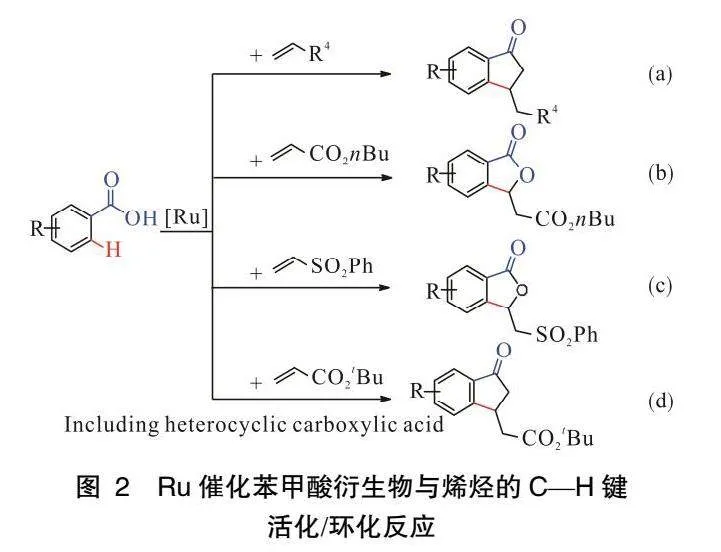
2011年,ACKERMANN課題組[31]發現了首例以Ru為催化劑催化苯甲酸衍生物鄰位C—H鍵活化/環化反應(圖 2a)。該反應以環境友好、無毒的水作為溶劑,因此成為一種綠色可持續的合成茚酮的方法。2015年該課題組[32]報道了Ru催化苯甲酸衍生物與丙烯酸酯偶聯生成苯酞的反應(圖 2b)。該反應以O2作為唯一的氧化劑,使用KOAc或CsOAc添加劑,能夠實現有氧環境下或室溫條件下的C—H鍵活化反應。
2018年,BAIDYA課題組[33]報道了Ru(II)催化苯甲酸鄰位C—H環化反應(圖2c)。使用催化劑[RuCl2(p-cym)]2實現了苯甲酸與乙烯基砜的偶聯。該反應操作簡單,條件溫和,官能團耐受性好,能以較高的收率(高達92%)獲得取代苯酞。2019年,該課題組將羧基導向C—H鍵活化/環化反應延伸到雜環芳烴[34],如圖2(d)所示,該方法進一步擴大了Ru催化羧酸環化的應用范圍。
2.3Ir催化苯甲酸衍生物與烯烴C—H鍵活化/環化反應
2019年,GOO?EN課題組[35]報道了關于Ir催化苯甲酸與α,β-不飽和酮環化得到取代茚酮的反應。該反應由雙金屬Ir/In體系催化,經過苯甲酸鄰位烷基化后發生克萊森縮合和可控的逆克萊森脫酰基化得到相應的茚酮產物。該環化反應可由醛、丙酮和苯甲酸實現三組分一鍋法。
3 過渡金屬催化苯甲酸衍生物與烯烴的C—H鍵烯基化反應研究進展
鄰烯基苯甲酸常用的合成方法包括與Wittig烯基化反應、Mizoroki-Heck反應、交叉偶聯反應和Sonogashira氫化反應。1984年,LAROCK首次報道了苯甲酸烯基化的反應[36]。該反應兼容簡單烯烴如乙烯、苯乙烯、環己烯、醋酸乙烯、鹵化烯丙酯等。但是這項工作的主要缺點在于反應過程中使用了化學計量的有毒金屬鉈。
3.1 Pd催化苯甲酸衍生物與烯烴的C—H鍵烯基化反應
1998年,MIURA課題組[37]報道了Pd/Cu協同催化取代苯甲酸與丙烯酸丁酯或苯乙烯偶聯形成異香豆素或苯酞的反應。從機理上看,反應依靠烯烴取代基的空間位阻作用調控內酯化的位點選擇從而形成五元環或六元環產物。2008年,MIURA課題組報道了鈀催化的3-羧基吲哚與烯烴的氧化偶聯反應[38]。該反應利用羧基作為無痕導向基,既實現了C2-烯基化又能輕松除去導向基。2010年,YU課題組[39]報道了Pd催化苯乙酸與丙烯酸乙酯的二次烯基化反應。該反應實現了羧基導向遠端C—H鍵活化,為苯甲酸衍生物的C—H官能團化反應提供了新的思路。同年,該課題組[40]還報道了Pd催化劑在手性配體單保護氨基酸存在的情況下實現2,2-二苯基丙酸Csp2—H鍵對映選擇性烯基化反應。該反應適用范圍廣,對映選擇性高。2013年,LEE課題組[41]報道了芳香羧酸和芳基乙烯制備異香豆素和3-芐基苯酞的氧化偶聯反應。該方法原料易得且步驟簡單。天然產物Thunberginol F通常由N,N-二乙基-2-甲氧基-苯甲酰胺經三步獲得,但總收率僅僅為9%[42]。使用LEE課題組開發的方法只需兩步即可制備,且產率較高。
3.2 Rh催化苯甲酸衍生物與烯烴的C—H鍵烯基化反應
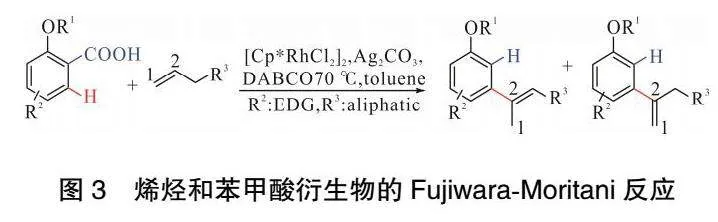
2011年,MIURA課題組[43]發現通過銠催化苯甲酸(或雜環芳基羧酸)與苯乙烯的氧化偶聯反應,可以有效地實現苯甲酸的鄰位單/二烯基化或脫羧烯基化反應。萘酸、α,β-不飽和酸和雜環芳烴羧酸均適用。在此基礎上,SU課題組[44]報道了Rh(Ⅲ)催化羧酸與噻吩直接脫羧的C—H/C—H交叉偶聯反應。為了實現這樣的脫羧鄰芳基化,反應條件必須確保羧酸選擇性C—H鍵活化/烯基化先于Ag催化的脫羧。2014年,WEN等[45]實現了Rh(Ⅲ)催化的苯甲酸與富電子雙取代醋酸乙烯酯的烯基化/環化反應。利用該反應選擇性地制備了一系列3-芳基、3-烷基取代異香豆素。2023年,SCHNüRCH課題組[46]報道了銠催化未活化末端烯烴和富電子基團取代苯甲酸衍生物的Fujiwara-Moritani反應,如圖 3所示。與之前的報道不同,該反應中實現了由末端烯烴C2與芳基形成新的C—C鍵。
4 結束語
由于羧酸廉價易得且結構穩定,并且羧基容易在后續的處理中消除,其廣泛應用于過渡金屬催化的C—H鍵官能團化反應。苯酞、茚酮、異香豆素以及香豆素是眾多生物活性分子和藥物分子的基本結構單元,因此在有機合成中占據著重要地位。通過羧酸與烯烴發生的各種類型的偶聯反應能夠高效合成這類分子結構。盡管如此,現存的使用羧酸和烯烴偶聯合成苯酞、茚酮、異香豆素等的反應仍然存在一定的進步空間:此前大部分羧酸C—H活化主要集中在芳香族羧酸中,即發生于Sp2雜化C的官能團化,實現Sp3雜化C—H與烯烴偶聯反應值得進一步的探索;烯烴底物主要是吸電子基取代的烯烴,未活化烯烴作為偶聯試劑實現苯酞等的合成也需進一步的開發。由此可見,該領域的開發仍是充滿挑戰的,這些問題也有待突破。
參考文獻:
[1] ROUSSEAU G, BREIT B. Removable directing groups in organic synthesis and catalysis[J].Angew Chem Int Ed, 2011, 50(11): 2450-2494.
[2]KUHL N, HOPKINSON M N, WENCEL-DELORD J, et al. Beyond directing groups: transition-metal-catalyzed C—H activation of simple arenes[J].Angew Chem Int Ed, 2012, 51(41): 10236-10254.
[3] ZHU Y C, LI Y, ZHANG B C, et al. Palladium-catalyzed enantioselective C—H olefination of diaryl sulfoxides through parallel kinetic resolution and desymmetrization[J].Angew Chem Int Ed, 2018, 57(18): 5129-5133.
[4] SHI H Y, DIXON D J. Dithiane-directed Rh(Ⅲ)-catalyzed amidation of unactivated C(sp3)—H bonds[J].Chemical Science, 2019, 10(13): 3733-3737.
[5] YANG W, LI Y, ZHU J, et al. Lewis acid-assisted Ir(Ⅲ) reductive elimination enables construction of seven-membered-ring sulfoxides[J].Chem Sci, 2020, 11(37): 10149-10158.
[6] TODOROVI? U, KLOSE I, MAULIDE N. Straightforward access to thiocyanatesviadealkylative cyanation of sulfoxides[J].Org Lett, 2021, 23(7): 2510-2513.
[7] KOU M, WEI Z, LI Z, et al. Copper-catalyzed sulfinyl cross-coupling reaction of sulfinamides[J].Org Lett, 2022, 24(46): 8514-8519.
[8] ZHANG F Y, FANG W W, YAN F Y, et al. CoCe/N—C hybrids constructed via Ce—O—Co solid solution for the deoxygenation of sulfoxide[J].New Journal of Chemistry, 2022, 46(17): 8138-8143.
[9] DEY A, VOLLA C M R. Traceless bidentate directing group assisted cobalt-catalyzedsp2-C—H activation and[4+2]-annulation reaction with 1, 3-diynes[J].Organic Letters, 2020, 22(19): 7480-7485.
[10] NIE B, WU W Q, REN Q Y, et al. Access to cycloalkeno[c]-fused pyridines via Pd-catalyzed C(sp2)—H activation and cyclization of N-acetyl hydrazones of acylcycloalkenes with vinyl azides[J].Org. Lett.,2020, 22:7786-7790.
[11] DEY A, SINGH A, VOLLA C M R. Cobalt-catalyzed highly diastereoselective[3+2]carboannulation reactions: Facile access to substituted indane derivatives[J].Chemical Communications, 2022, 58(9): 1386-1389.
[12] TIAN M M, LIU B X, SUN J Q, et al. Rh(Ⅲ)-catalyzed C—C coupling of diverse arenes and 4-acyl-1-sulfonyltriazoles via C—H activation[J].Organic Letters, 2018, 20(16): 4946-4949.
[13] SUZUKI I, KONDO H, KOCHI T, et al. Selective monoarylation of aromatic ketones viaC—H bond cleavage by trialkEgYrKPfSBPOKiwlytDocTw==ylphosphine ruthenium catalysts[J].J Org Chem, 2019, 84(20): 12975-12982.
[14] YUAN Y C, BRUNEAU C, ROISNEL T, et al. Site-selective ruthenium-catalyzed C—H bond arylations with boronic acids: Exploiting isoindolinones as a weak directing group[J].J Org Chem, 2019, 84(20): 12893-12903.
[15] QIU J, XIE J C, SU S M, et al. Selective functionalization of hindered meta-C—H bond of o-alkylaryl ketones promoted by automation and deep learning[J].Chem, 2022, 8(12): 3275-3287.
[16] ZHOU T, QIAN P F, LI J Y, et al. Efficient synthesis of sulfur-stereogenic sulfoximines via Ru(II)-catalyzed enantioselective C—H functionalization enabled by chiral carboxylic acid[J].Journal of the American Chemical Society, 2021, 143(18): 6810-6816.
[17] KUMAR S, NUNEWAR S, SABBI T K, et al. Synthesis of indenone derivatives by Rh(Ⅲ)-catalyzed C—H functionalization of sulfoxonium ylides with 1, 3-diynes[J].Organic Letters, 2022, 24(18): 3395-3400.
[18] WANG P Y, HUANG Y L, JING J R, et al. Rhodium(Ⅲ)-catalyzed atroposelective synthesis of C—N axially chiral naphthylamines and variants via C—H activation[J].Organic Letters, 2022, 24(13): 2531-2535.
[19] SINGH A, KUMAR S, VOLLA C M R. Α-Carbonyl sulfoxonium ylides in transition metal-catalyzed C—H activation: a safe carbene precursor and a weak directing group[J].Organic & Biomolecular Chemistry, 2023, 21(5): 879-909.
[20] XIONG F, ZUO Y Y, SONG Y N, et al. Synthesis of ortho-phenolic sulfilimines via an intermolecular sulfur atom transfer cascade reaction[J].Organic Letters, 2020, 22(10): 3799-3803.
[21] MI R, CHEN H, ZHOU X, et al. Rhodium-catalyzed atroposelective access to axially chiral olefins via C—H bond activation and directing group migration[J].Angew Chem Int Ed, 2022, 61(1): e202111860.
[22] WU M, ZHANG H M, WANG T, et al. Rh(Ⅲ)-Catalyzed chemo-, regio- and stereoselective carboamination of sulfonyl allenes with N-phenoxy amides or N-enoxy imides[J].Chem. Commun.,2022, 58: 9286-9289.
[23] KUNINOBU Y, OHTA K, TAKAI K. Rhenium-catalyzed allylation of C—H bonds of benzoic and acrylic acids[J].Chemical Communi-cations, 2011, 47(38): 10791-10793.
[24] TRITA A S, BIAFORA A, PICHETTE DRAPEAU 204b0a37a1511a9b993f768feca30016d559b7c790251ffab1969e2cc7c571d7M, et al. Regiospecific ortho-C—H allylation of benzoic acids[J].Angew Chem Int Ed, 2018, 57(44): 14580-14584.
[25] HU X Q, HU Z, TRITA A S, et al. Carboxylate-directed C—H allylation with allyl alcohols or ethers[J].Chem Sci, 2018, 9(23): 5289-5294.
[26] ZHANG G, JIA F, GOO?EN L J. Regioselective C—H alkylationviacarboxylate-directed hydroarylation in water[J].Chemistry, 2018, 24(18): 4537-4541.
[27] HU Z, HU X Q, ZHANG G, et al. Ring-opening Ortho-C—H allylation of benzoic acids with vinylcyclopropanes: merging catalytic C—H and C—C activation concepts[J].Org Lett, 2019, 21(17): 6770-6773.
[28] JIANG Q D, ZHU C L, ZHAO H Q, et al. RhⅢ-catalyzed C—H olefination of benzoic acids under mild conditions using oxygen as the sole oxidant[J].Chemistry – An Asian Journal, 2016, 11(3): 356-359.
[29] GANDEEPAN P, RAJAMALLI P, CHENG C H. Rhodium(Ⅲ)-catalyzed[4+1]annulation of aromatic and vinylic carboxylic acids with allenes: An efficient method towards vinyl-substituted phthalides and 2-furanones[J].Chemistry – A European Journal, 2015, 21(25): 9198-9203.
[30] YU S, LV N, HONG C, et al. Rh-catalyzed annulation of benzoic acids, formaldehyde, and malonates via ortho-hydroarylation to indanones[J].Org Lett, 2020, 22(21): 8354-8358.
[31] ACKERMANN L, POSPECH J. Ruthenium-catalyzed oxidative C—H bond alkenylations in water: Expedient synthesis of annulated lactones[J].Org Lett, 2011, 13(16): 4153-4155.
[32] BECHTOLDT A, TIRLER C, RAGHUVANSHI K, et al. Ruthenium oxidase catalysis for site-selective C—H alkenylations with ambient O2as the sole oxidant[J].Angew Chem Int Ed, 2016, 55(1): 264-267.
[33] MANDAL A, DANA S M, CHOWDHURY D, et al. RuII-catalyzed annulative coupling of benzoic acids with vinyl sulfone viaweak carboxylate-assisted C—H bond activation[J].Asian Journal of Organic Chemistry, 2018, 7(7): 1302-1306.
[34] MANDAL A, MEHTA G, DANA S M, et al. Streamlined ruthenium(II) catalysis for one-pot 2-fold unsymmetrical C—H olefination of (hetero)arenes[J].Organic Letters, 2019, 21(15): 5879-5883.
[35] ZHANG G D, HU Z Y, BERTOLI G, et al. Iridium-catalyzed synthesis of substituted indanones from aromatic carboxylates and unsaturated ketones[J].ACS Catalysis, 2019, 9(9): 8153-8158.
[36] LAROCK R C, VARAPRATH S, LAU H H, et al. Synthesis of isocoumarins via thallation-olefination of benzoic acids[J].Journal of the American Chemical Society, 1984, 106(18): 5274-5284.
[37] MIURA M, TSUDA T, SATOH T, et al. Oxidative cross-coupling ofN-(2‘-phenylphenyl)benzene- sulfonamides or benzoic and naphthoic acids with alkenes using a palladium-copper catalyst system under air[J].The Journal of Organic Chemistry, 1998, 63(15): 5211-5215.
[38] MAEHARA A, TSURUGI H, SATOH T, et al. Regioselective C—H functionalization directed by a removable carboxyl group: Palladium-catalyzed vinylation at the unusual position of indole and related heteroaromatic rings[J].Organic Letters, 2008, 10(6): 1159-1162.
[39] ENGLE K, WANG D H, YU J Q. Constructing multiply substituted arenes using sequential palladium(II)-catalyzed C—H olefination[J].Angewandte Chemie International Edition, 2010, 49(35): 6169-6173.
[40] SHI B F, ZHANG Y H, LAM J K, et al. Pd(II)-catalyzed enantioselective C—H olefination of diphenylacetic acids[J].J. Am. Chem. Soc.,2010, 132, 460-461.
[41] NANDI D, GHOSH D, CHEN S J, et al. One-step synthesis of isocoumarins and 3-benzylidenephthalides via ligandless Pd-catalyzed oxidative coupling of benzoic acids and vinylarenes[J].J Org Chem, 2013, 78(7): 3445-3451.
[42] KURUME A, KAMATA Y, YAMASHITA M, et al. Synthesis of 3-substituted isocoumarins and their inhibitory effects on degranulation of RBL-2H3 cells induced by antigen[J].Chem Pharm Bull(Tokyo), 2008, 56(9): 1264-1269.
[43] PHANI KUMAR N Y, BECHTOLDT A, RAGHUVANSHI K, et al. Ruthenium(II)-catalyzed decarboxylative C—H activation: versatile routes tometa-alkenylated arenes[J].Angewandte Chemie International Edition, 2016, 55(24): 6929-6932.
[44] ZHANG Y F, ZHAO H Q, ZHANG M, et al. Carboxylic acids as traceless directing groups for the rhodium(Ⅲ)-catalyzed decarboxylative C—H arylation of thiophenes[J].Angewandte Chemie International Edition, 2015, 54(12): 3817-3821.
[45] ZHANG M L, ZHANG H J, HAN T T, et al. Rh(Ⅲ)-catalyzed oxidative coupling of benzoic acids with geminal-substituted vinyl acetates: Synthesis of 3-substituted isocoumarins[J].The Journal of Organic Chemistry, 2015, 80(1): 620-627.
[46] POURKAVEH R, PODEWITZ M, SCHNüRCH M. A fujiwara-moritani-type alkenylation using a traceless directing group strategy: Arare example of C—C bond formation towards the C2-carbon of terminal alkenes[J].European J Org Chem, 2023, 26(8): e202201179.

