慕于超高效液相色譜-四極桿飛行時間質譜和靶向網絡藥理學技術結合分子對接研究薤白治療高血脂癥的藥效成分
關鍵詞 超高效液相色譜-四極桿飛行時間質譜;靶向網絡藥理學;分子對接;薤白;藥效成分
薤白(Allii Macrostemonis Bulbus)為百合科植物小根蒜(Allium macrostemon Bge.)或薤(Allium chinenseG. Don)的干燥鱗莖,近球狀,記載于《神農本草經》[1]。薤白的化學成分主要包括甾體皂苷[2-4]和揮發油[5]等。現代藥理學研究表明,薤白具有降低血脂、抗動脈粥樣硬化、抑制腫瘤以及抗菌等多種藥理作用[6-7]。本研究組前期對薤白主要皂苷類成分進行了化學分析,共鑒定出33 種成分[8]。口服給藥和胃腸吸收入血是中藥發揮藥效的主要途徑,因此,應用現代技術系統分析中藥的入血成分對闡明其藥效成分和作用機制至關重要。超高效液相色譜-四極桿飛行時間質譜(UPLC-Q-TOF-MS)技術具有高通量、高靈敏度、高精確性和高分辨率等特點,是快速、準確鑒定中藥復雜成分的一種重要手段,在中藥成分檢測領域具有獨特的優勢。
中藥具有多靶點協同作用的特點,因此,尋找多靶點協同增效的藥物是目前研究中藥藥效成分及作用機理的主要思路[9]。Hopkin 等[10]于2007 年首次被提出“網絡藥理學”概念,打破了以往的“一個藥物、一個基因、一種疾病”的模式,從整體觀和系統觀解析藥物及治療對象之間的分子關聯規律,進而預測中藥復方或單體主要活性成分的生物學功能,探究其多靶點共同治療疾病的作用機制。研究表明,網絡藥理學在預測中藥潛在作用靶點方面具有顯著成效[11-14]。分子對接技術作為一種以計算機技術為基礎的高通量篩選技術,近年來在研究中藥材的關鍵問題方面展現出巨大優勢[15]。該技術主要從已知結構的受體和配體出發,對相互作用的分子進行識別,并預測分子間的結合模式和親合力,達到節省大量的時間和成本、提高藥物研發成功率的目的,近年來已成為計算機輔助藥物研究領域的重要技術。
本研究采用UPLC-Q-TOF-MS 技術對薤白化學成分及入血成分進行系統分析和鑒定,并基于薤白入血成分與數據庫篩選降血脂活性成分的交集成分,利用靶向網絡藥理學及分子對接技術了構建了“藥物-成分-靶點-通路”網絡,用于薤白治療高血脂癥的藥效成分及關鍵作用靶點分析,進而闡明薤白治療高血脂癥的分子作用機制,為薤白藥材的質量標準提升提供了依據。
1 實驗部分
1.1 儀器與試劑
Waters Q-TOF SYNAPT G2-Si 超高效液相色譜-高分辨質譜聯用儀(美國Waters 公司);XS-204 分析天平(梅特勒-托利多儀器有限公司);Hyper Sonic DT-A 超聲波清洗器(昆山美美超聲儀器有限公司);FC5515R 高速微量離心機(德國OHAUS 公司);EYELA 氮吹儀(上海愛朗儀器有限公司)。薤白藥材浸膏(批號:20230605,吉林省東方制藥有限公司);甲醇和乙腈(色譜純,美國Tedia 公司);甲酸(色譜純,上海阿拉丁生化科技股份有限公司);甲醇和正丁醇(分析純,天津新通精細化工有限公司)。實驗用水為超純水(18.2 MΩ·cm,德國Milli-Q 超純水系統制備)。
1.2 動物實驗
SD 大鼠18 只(雄性,體重200~230 g)購自遼寧長生生物技術有限公司。實驗前于可控環境(12 h 光照/黑暗周期;溫度:(24±1)℃;相對濕度:51%±5%)中適應性喂養,自由獲取飼料和飲用水。7 d后,將大鼠隨機分為6 組,每組3 只。其中,對照組給予生理鹽水,其余5 組為給藥組,均灌胃給予薤白浸膏(0.392 g/(kg·d)),連續給藥7 d。末次給藥前12 h 禁食。5 組給藥組分別于末次給藥后0.5、1、2、4和8 h 采集腹部主動脈血樣。血樣靜置1 h 后,于4 ℃、3500 r/min 條件下離心10 min,取上層血清,分裝后于–80 ℃凍存,待測。
1.3 樣品的制備
1.3.1 供試品溶液的制備
準確稱取薤白浸膏5 g,加入到20 mL 70%甲醇中,超聲提取2 次,每次60 min, 合并提取液,過濾,濃縮至10 mL,即得供試品溶液。
1.3.2 大鼠血清樣品的制備
取大鼠血清樣本900 μL,加入3 倍樣本體積的甲醇,渦旋混合3 min 后,于4 ℃以13000 r/min 離心10 min,取上清液,氮氣吹干。用100 μL 15%乙腈-水溶液復溶,于4 ℃以13000 r/min 離心10 min,取上清液進行UPLC-Q-TOF-MS 檢測。
1.4 UPLC-Q-TOF-MS的分析條件
1.4.1 液相色譜條件
ACQUITY BEH C18 色譜柱(50 mm×2.1 mm, 1.7 μm);流動相A 為0.1%甲酸,流動相B 為乙腈。梯度洗脫:0~8 min, 15%~19% B;8~10 min, 19% B;10~15 min, 19%~28% B;15~18 min, 28% B;18~22 min, 28%~30% B;22~25 min, 30%~35% B;25~30 min, 35%~40% B;30~35 min, 40%~60%B;35~38 min, 60%~80% B;38~40 min, 80%~100% B;40~45 min, 100% B。流速:0.3 mL/min;柱溫:30 ℃;進樣量:5 μL。
1.4.2 質譜條件
ESI 離子源,正、負離子模式,全信息串聯質譜(MSE)模式掃描;掃描范圍為50~2000 Da;離子源溫度為120 ℃(正離子模式)/110 ℃(負離子模式);脫溶劑氣溫度為400 ℃;錐孔氣流速為50 L/h;脫溶劑氣流速為800 L/h;毛細管電壓為3.0 kV(正離子模式)/2.5 kV(負離子模式);MSE 碰撞能量的低碰撞能量為6 eV, 高碰撞能量為20~30 eV/30~45 eV。
1.5 靶向網絡藥理學分析
1.5.1 數據庫與軟件
TCMSP 分析平臺(http://ibts.hkbu.eduhk/LSP/tcmsp.php);Uniprot 數據庫(http://www.Uniprot.org/);OMIM 數據庫(http://www.omim.org/);Drugbank 數據庫(https://www.drugbank.com/), GeneCards(http://www.genecards.org/);Venny 2.1.0 軟件(https://bioinfogp.cnb.csic.es/tools/venny/index.html);STRING 網絡平臺(https//stringdb.org/);KEGG 數據庫(https://www.kegg.jp/);Metascape 數據庫(https://metascape.org/gp/index.htm);Cytoscape 3.7.2軟件;AutoDock Tools 1.5.7 軟件;Pymol 2.4.1 軟件;Discovery Studio 4.5軟件。
1.5.2 薤白活性成分和靶點蛋白的篩選
通過TCMSP 分析平臺數據庫查詢檢索薤白成分,根據口服生物利用度(Oral bioavailability, OB≥30%)和類藥性(Drug-likeness, DL≥0.18),并結合文獻資料報道,篩選出符合條件的化合物,作為薤白中主要活性成分。根據MOL ID 獲取主要活性成分對應的靶點蛋白。利用UniProt 數據庫將靶點蛋白的protein ID 轉換為基因的Gene ID。
1.5.3 高血脂癥相關靶點庫的構建
以“Hyperlipidemia”為關鍵詞在OMIM、Drugbank 和GeneCards 疾病靶點數據庫中檢索,獲取高血脂癥相關靶點基因,將基因整合并去重,構建高血脂癥相關靶點庫。
1.5.4 薤白降血脂潛在靶點預測
將薤白活性成分對應靶點與高血脂癥相關靶點整合,導入Venny 2.1.0 在線工具,互相映射薤白的作用靶點基因與高血脂癥相關靶點基因,得到二者的交集靶點即為薤白降血脂作用的潛在靶點。
1.5.5 蛋白相互作用(PPI)網絡的構建
將薤白降血脂的潛在靶點導入STRING 在線數據庫中進行PPI 網絡構建。將蛋白物種設置為“Home sapiens”,相互作用的最低閾值設置為“Highest confidence gt; 0.7”,其余參數均為默認值。將游離的蛋白隱藏,最終得到靶點蛋白間的PPI 網絡圖,應用Cytoscape 3.7.2 軟件中“Network Analyzer”插件進行拓撲參數分析。
1.5.6 “藥物-成分-靶點”網絡構鍵
將薤白的主要活性成分與對應的潛在靶點導入Cytoscape 3.7.2 軟件中構建“薤白-有效成分-靶點”網絡,并進行可視化分析。
1.5.7 關鍵靶蛋白的GO及KEGG富集通路分析
利用Metascape 數據庫對潛在靶點進行基因本體論(Gene ontology, GO)及京都基因與基因組百科全書(Bubble diagram of Kyoto encyclopedia of genes and gnomes, KEGG)富集分析,設置檢索物種為人類(Home sapiens),得到薤白發揮降血脂作用的GO 及KEGG 信號通路,應用微生信(https://www.bioinformatics.com.cn/)進行可視化處理。
1.5.8 分子對接驗證
依據Degree 值選取“藥物-成分-靶點”網絡中的活性成分及作用靶點作為受體和配體進行分子對接驗證。在TCMSP 數據庫中下載活性成分的.mol2 格式文件,在PDB 數據庫中下載作用靶點蛋白的三維結構.pdb 格式文件。應用AutoDockTools 1.5.7 Vina 軟件進行分子對接,采用Pymol 和Discovery Studio 4.5軟件將分子對接結果可視化。
2 結果與討論
2.1 薤白成分分析
2.1.1 薤白化學成分的鑒定
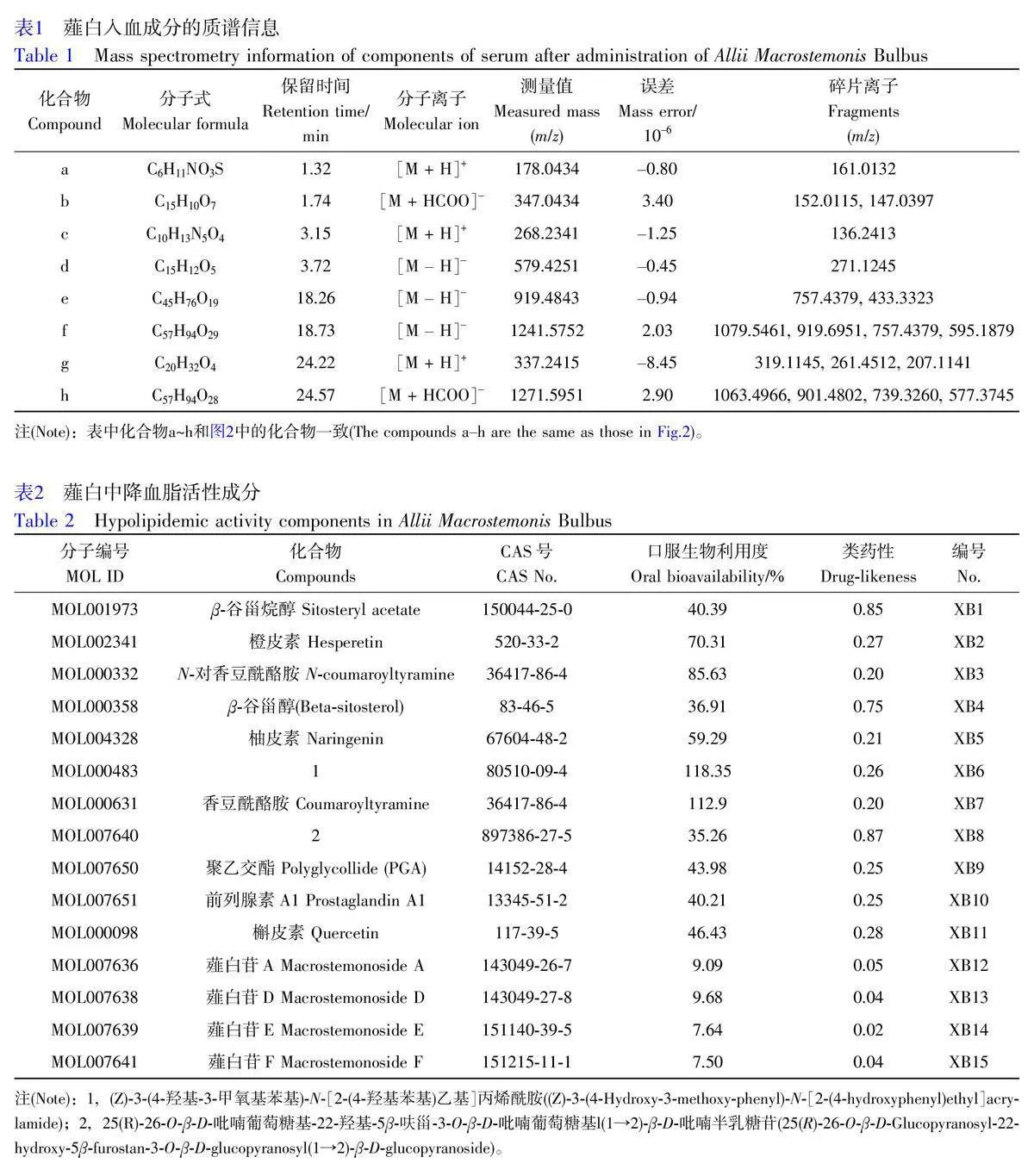
應用UPLC-Q-TOF-MS 技術對薤白化學成分進行分析,在正、負離子模式下的總離子流圖如圖1 所示。在本研究組前期研究結果[8]基礎上,從薤白藥材中共鑒定出36 種化學成分,包括28 種皂苷類化合物、3種氨基酸類化合物、2種黃酮類化合物、1 種有機硫化合物、1 種核苷類化合物和1 種類激素脂質化合物,詳見電子版文后支持信息表S1。
2.1.2 薤白入血成分的鑒定
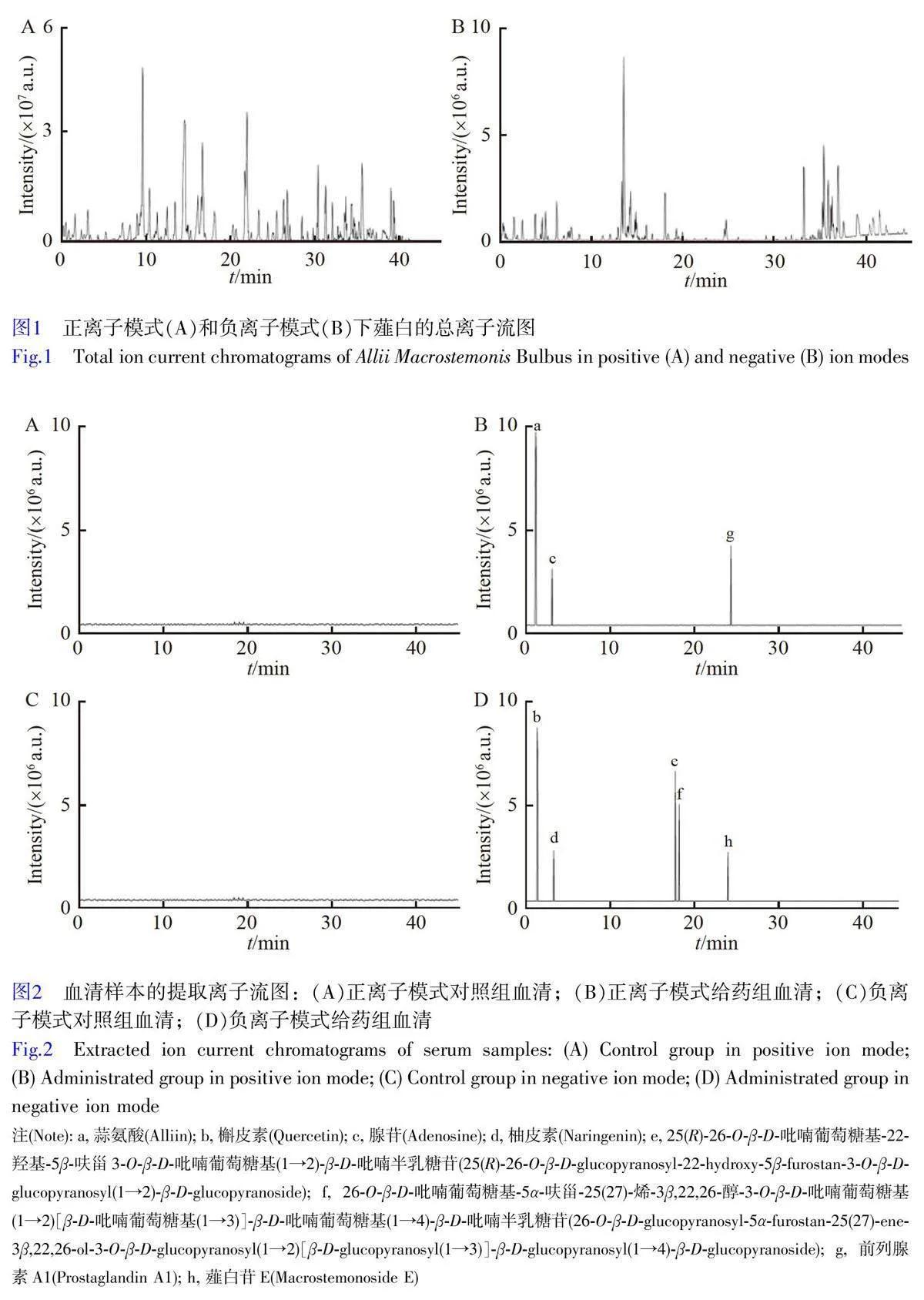
采用UPLC-Q-TOF-MS 技術分析給藥薤白前后血清樣本成分以確定薤白的入血成分,其提取離子流圖如圖2 所示,與數據庫比對共鑒定出8 種入血成分(表1)。
2.2 基于薤白入血成分的靶向網絡藥理學分析
2.2.1 薤白活性成分篩選及靶點蛋白篩選
在TCMSP 分析平臺數據庫中,以“薤白”為關鍵詞,設置篩選參數OB≥30%, DL≥0.18,共檢索到87 種活性成分及其相關信息。同時,結合文獻報道中已驗證具有降血脂活性的薤白成分[15-16],綜合篩選出15 種有效活性成分(表2)。基于2.1.2 節中鑒定的8 種原型入血成分與TCMSP 平臺數據庫篩選的15 種活性成分的交集成分,獲取對應靶點蛋白,去重后,共得到188 個相關靶點。
2.2.2 高血脂癥相關靶點庫的構建
在OMIM、Drugbank 和GeneCards 疾病靶點數據庫中,以“Hyperlipidemia”為關鍵詞,對高血脂癥相關靶點進行檢索,將得到的靶標結果進行去重,得到1049 個高血脂癥疾病相關靶點。
2.2.3 薤白降血脂潛在靶點的預測及靶點間相互作用網絡的構建
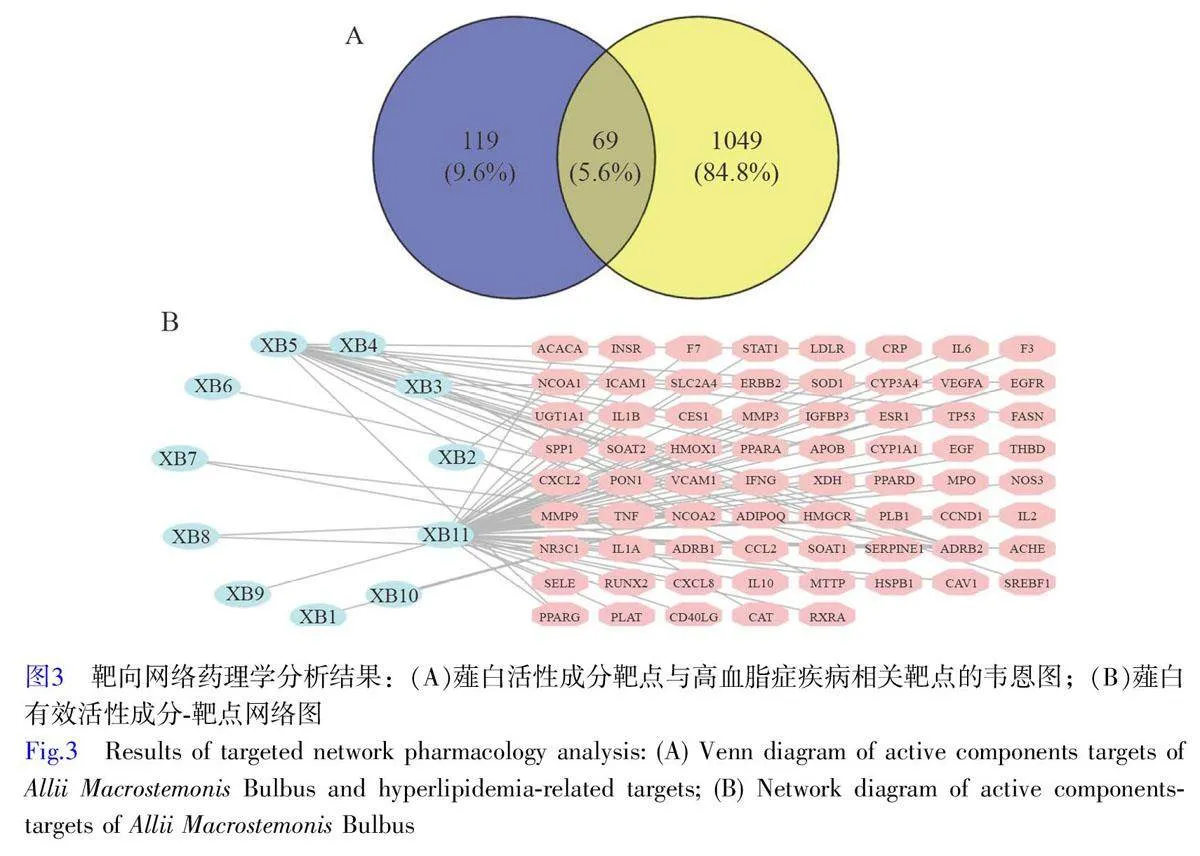
將188 個入血成分相關靶點與1049 個疾病相關靶點導入Venny 2.1 軟件,所得韋恩圖如圖3A 所示,共映射出薤白治療高血脂癥靶基因69 個。
在STRING 數據庫中獲得69 個交集靶點之間共151 條連線的網絡圖。將靶點蛋白相互作用信息導入Cytoscape 3.7.2 中,構建可視化PPI 網絡(電子版文后支持信息圖S1)。在網絡中節點越多,其degree值越大,與靶蛋白的相互作用越密切。選擇Degree 值大于2 倍平均值,篩選出AMP 活化蛋白激酶(AMPK)、腫瘤壞死因子(TNF)、血管內皮生長因子A(VEGFA)和基質金屬蛋白酶9(MMP9)4 個靶點蛋白。這些靶點處于蛋白相互作用的核心位置,推測其可能是薤白治療高血脂癥的關鍵靶點。
2.2.4 “薤白-有效成分-靶點”網絡的構建
應用Cytoscape 3.7.2 軟件對交集靶點進行拓撲學分析,構建“薤白-有效成分-靶點”關聯網,如圖3B 所示。對該網絡圖的80 個節點(69個核心靶點與11個核心活性成分)進行分析,選擇Degree 值大于該節點中位數2 倍的節點為網絡中關鍵節點,篩選出活性成分為槲皮素、柚皮素、薤白苷E 和25(R)-26-O-β-D-吡喃葡萄糖基-22-羥基-5β-呋甾3-O-β-D-吡喃葡萄糖基(1→2)-β-D-吡喃半乳糖苷,初步推測其為薤白治療高血脂癥的關鍵藥效成分。
2.2.5 GO生物富集分析結果
應用Metascape 數據庫對69個交集靶點基因進行GO富集分析,主要包括生物過程、細胞成分和分子功能3 個方面。Min Overlap參數設置為3, P Value Cutoff參數設置為0.01, Min Enrichment 參數設置為1.5,最終得到3793 個生物過程條目、296 個細胞成分條目和534 個分子功能條目(電子版文后支持信息圖S2A)。
在生物過程條目中,選取排名前20 的條目為主要研究條目(plt;0.01),主要涉及對營養水平的反應(Response to nutrient levels)、對激素的反應(Response to hormone)、對脂多糖的反應(Response tolipopolysaccharide)、小分子代謝過程的調控(Regulation of small molecule metabolic process)以及脂質定位調節(Regulation of lipid localization)等。
在細胞成分條目中,選取排名前14的條目為主要研究條目(plt;0.01),主要涉及內吞囊泡膜(Endocyticvesiclemembrane)、質膜外側(External side of plasma membrane)、膜筏(Membrane raft)和致密顆粒(Dense core granule)等。
在分子功能條目中,選取排名前20 的條目為主要研究條目(plt;0.01),主要涉及細胞因子活性(Cytokineactivity)、核受體活性(Nuclear receptor activity)和類固醇結合(Steroid binding)等。
2.2.6 KEGG信號通路富集分析
69個交集靶點的KEGG通路注釋分析結果氣泡圖如電子版文后支持信息圖S2B 所示。交集靶點主要參與調控AGE-RAGE 信號通路(AGE-RAGE signaling pathway)、AMPK 信號通路(AMPK signaling"pathway)、膽固醇代謝途徑(Cholesterol metabolism)和脂肪細胞的脂解調控(Regulation of lipolysis inadipocytes)等。在AMPK 信號通路中[17-19],薤白藥材中的活性成分通過參與調控PPARK1、ACACA/ACACB、PPARGCA1、HMGCR 和SREBF1 等基因靶點調節脂質代謝,從而發揮降血脂的作用,其信號通路如圖S3 所示。其中,紅色表示上調靶點,綠色表示下調靶點。上調靶點中腺苷-磷酸蛋白激酶(PRKAA1)能夠促進糖降解,增加內皮細胞的增值速率,使血管內皮層的通透性減少,防止高血脂形成[20]。下調靶點中的HMG-CoA 還原酶(HMGCR)是膽固醇生物合成途徑中的限速酶, HMGCR 降解可促進脂質合成減少,進而起到治療高血脂癥的作用[17]。
2.3 分子對接驗證
以篩選出的有效成分25(R)-26-O-β-D-吡喃葡萄糖基-22-羥基-5β-呋甾3-O-β-D-吡喃葡萄糖基(1→2)-β-D-吡喃半乳糖苷、薤白苷E、槲皮素和柚皮素為配體, TNF、AMPK、VEGFA 和MMP9 這4 個關鍵靶點為受體進行分子對接結合能力預測。結合能≤–4.25 kJ/mol 表示配體與受體間有一定的結合活性,結合能≤–5 kJ/mol 表示配體與受體間有較好的結合活性,結合能≤–7 kJ/mol 表示配體與受體間有很強的結合活性[21]。選取配體與受體結合能≤–4.25 kJ/mol, 繪制分子對接熱圖,如電子版文后支持信息圖S4 所示。選取預測對接親和力(Predicted binding affinity)絕對值最高的兩組,進行分子對接可視化,結果見電子版文后支持信息圖S5。
柚皮素是一種黃酮類化合物,有研究證實其可通過降低總膽固醇和甘油三酯水平達到降脂的目的[22]。槲皮素對脂代謝及糖代謝均具有明顯的影響[23-26]。薤白苷E 和25(R)-26-O-β-D-吡喃葡萄糖基-22-羥基-5β-呋甾3-O-β-D-吡喃葡萄糖基(1→2)-β-D-吡喃半乳糖苷是薤白中主要甾體皂苷成分,已有文獻報道薤白中甾體皂苷是其發揮“通陽散結、行氣導滯”的主要活性成分[27-28]。TNF 能誘導白細胞介素-6 的產生,而白細胞介素-6 作為生物效應的細胞因子,可抑制脂蛋白脂酶和刺激脂肪水解,導致血清甘油三酯水平升高,從而調節脂質代謝[29]。AMPK 作為參與機體能量代謝的蛋白激酶,主要是通過抑制HMGCR 來抑制膽固醇合成,而HMGCR 作為T-CHO 合成過程中的限速酶,降低其活性可減少膽固醇的合成[30]。分子對接結果表明,基于網絡藥理學篩選出的4 種潛在活性成分與AMPK 的結合能均較高,推測其可能是薤白治療高血脂癥的關鍵藥效成分。
3 結論
薤白具有通陽散結和行氣導滯的功效,用于高血脂癥治療,療效顯著。本研究采用UPLC-Q-TOF-MS技術對薤白藥材的化學成分及體內入血成分進行分析,共鑒定出36 種化學成分,其中8 種成分為入血成分。同時基于多成分、多靶點的研究思路,采用入血成分靶向網絡藥理學分析技術,篩選柚皮素、薤白苷E、槲皮素和25(R)-26-O-β-D-吡喃葡萄糖基-22-羥基-5β-呋甾3-O-β-D-吡喃葡萄糖基(1→2)-β-D-吡喃半乳糖苷可能為薤白治療高血脂癥的關鍵成分。但是,考慮到25(R)-26-O-β-D-吡喃葡萄糖基-22-羥基-5β-呋甾3-O-β-D-吡喃葡萄糖基(1→2)-β-D-吡喃半乳糖苷和薤白苷E 為薤白中特有的活性成分且含量較高,建議后續的臨床研究及質量標準確定選擇甾體皂苷類化合物。通過“藥物-成分-靶點-通路”網絡的構建,篩選出薤白治療高血脂癥的關鍵靶點為AMPK、TNF、VEGFA 和MMP9。研究發現,薤白一方面通過調控膽固醇、甘油三酯、脂質和糖代謝發揮降血脂作用;另一方面通過調節血管細胞通透性,防止高血脂形成。本研究初步確定了薤白治療高血脂癥的可能關鍵成分,但篩選出的化合物活性及作用機制仍需體內活性驗證。本研究結果為深入研究薤白的藥效物質基礎以及治療高血脂癥的作用機制提供了參考,也為提升薤白藥材質量標準和臨床合理用藥提供了依據。

