順鉑誘導腎損傷模型在C57BL/6小鼠J和N亞型中的差異性研究
王 嬋,邱會琴,唐亞婷,朱方媛,范彥英,楊彩紅
(山西醫科大學基礎醫學院藥理學教研室,山西 太原 030001)
急性腎臟損傷(acute kidney injury, AKI)后的纖維化和炎癥反應,導致的慢性結構變化漸進性進展被認為是慢性腎病(chronic kidney disease, CKD)發生的重要病因之一。缺血/再灌注的發生[1]、抗腫瘤藥物的應用[2]、橫紋肌溶解癥[3]、細菌感染甚至服藥不當[4],均會引起AKI的發生,其中藥物引起的AKI在所有AKI病例中的比例持續增加[5]。
藥物性AKI動物模型的構建有利于研究腎損傷的發病機制,其組織形態的變化與生態指標及臨床表現的相互關系的研究,是篩選有效藥物,闡明療效機制的重要媒介。現有技術中,藥物性AKI多使用對腎臟有損傷的藥物構建,如順鉑(cisplatin, CDDP)、脂多糖等。對藥物腎損傷模型的成功構建有助于幫助尋找保護腎功能,促進腎臟AKI恢復,延緩腎臟疾病進展和控制并發癥的機制和藥物。
C57BL/6作為廣泛使用的近交小鼠品系,主要包括C57BL/6J和C57BL/6N兩個核心亞型,在研究藥物引起的AKI模型中發揮了不可替代的作用。兩者由于表型差異的不同出現遺傳變異,但還是經常被用于各種疾病模型及潛在機制的研究[6]。Simon等[7]對C57BL/6J和C57BL/6N進行了全面的基因組序列比較和表型分析,發現了這兩種亞系在基因組序列、視網膜、心血管、新陳代謝、神經、行為和感覺以及免疫功能等方面存在明顯表型差異,可能影響其潛在遺傳機制及表現差異。目前尚未發現有研究比較順鉑誘導腎損傷模型在C57BL/6J和C57BL/6N小鼠亞系之間的差異性。順鉑腎損傷主要表現為腎小管擴張或萎縮,腎間質大量炎癥細胞浸潤,進而發展為腎間質纖維化,最終導致不可逆性腎功能不全[8]。因此,降低炎癥細胞浸潤和減少腎間質纖維化過程對于臨床上尋求促進藥物AKI恢復的治療手段具有重要意義。基于此,本研究將探究順鉑在C57BL/6J和C57BL/6N小鼠亞系腎損傷模型的構建,及其在C57BL/6J和C57BL/6N亞系小鼠腎小管的損傷、間質纖維化和炎癥因子的表達是否存在差異影響。
1 材料與方法
1.1 藥物及試劑CDDP(cisplatin, 批號:153513),上海陶素生化科技有限公司;BCA蛋白濃度測定試劑盒、4%多聚甲醛固定液,武漢博士德生物工程有限公司;肌酐(creatinine, CRE)、尿素氮(blood urea nitrogen, BUN)檢測試劑盒,南京建成科技有限公司;β2微球蛋白(β2-microglobulin, β2-MG)試劑盒,上海酶免生物科技有限公司;白細胞介素1β(interleukin-1β, IL-1β)(GB11113),武漢賽維爾生物科技有限公司;白細胞介素6(interleukin-6,IL-6)(A11115)和白細胞介素18(interleukin-18, IL-18)(A1115),武漢Abcolonal 生物科技有限公司;β肌動蛋白單抗(一抗)(AC038),武漢Abcolonal生物科技有限公司;辣根過氧化物酶標記山羊抗兔IgG抗體(二抗)(BA1054),武漢博士德生物工程有限公司;ECL超敏發光液,上海羿圣生物科技有限公司。
1.2 儀器電子天平(CP124C,中國常州),倒置熒光顯微鏡(德國Leica);多功能酶標儀(美國伯騰);高速冷凍離心機(徳國 Eppendorf);電熱恒溫培養箱(B667902,上海智城);凝膠電泳及成像設備(美國Bio-Rad)。
1.3 實驗動物12周C57BL/6J和N雄性小鼠,SPF級,體質量為(26 ± 2)g,北京維通利華實驗動物科技有限公司,實驗動物生產許可證號:SCXK(京)2021-0006。飼養于山西醫科大學實驗動物中心。飼養環境溫度(25~26) ℃,相對濕度45%~60%,12 h晝夜交替照明,自由攝食飲水,實驗前適應性飼養1周。所有動物均經山西醫科大學動物實驗中心動物福利倫理委員會批準(SYDL2022004),實驗設施許可證編號為SYXK(晉)2019-0007。
1.4 動物分組和給藥J及N亞系C57BL/6小鼠置正常環境飼養適應1周,隨機分為正常對照組、順鉑組,每組8~10只。順鉑組腹腔注射3.33 mg·kg-1,隔天給藥,共6次,連續給藥2周,累積劑量20 mg·kg-1,建立亞急性腎損傷模型。正常對照組腹腔注射等體積生理鹽水。給藥結束后觀察1周,隨后用1%戊巴比妥(0.1 mL/10 g, ip)麻醉小鼠,眼眶采血留取血液標本,留取小鼠雙側腎臟用于后續實驗。
1.5 腎功能測定小鼠眼眶靜脈采血,血樣置非抗凝管中,常溫下靜置2 h后離心(4 ℃, 3 000 r·min-1, 20 min),抽取上清,嚴格按照試劑盒說明書進行血清中血Scr、BUN和β2-MG含量的測定。
1.6 ELISA檢測血清中炎癥因子的含量同上采血,抽取上清,嚴格按照試劑盒說明書進行血清中血IL-1β、IL-6、IL-18炎癥因子的含量測定。
1.7 腎臟組織病理變化腎臟稱重后,取腎臟皮質部分組織置于4%多聚甲醛中浸泡固定至少24 h,剩余腎臟組織置-80 ℃冰箱用于后續實驗。將固定的腎臟組織常規石蠟包埋后切片(厚度4 μm),按試劑盒說明書分別進行HE、Masson和PAS染色。HE染色用于觀察腎臟組織形態變化;Masson染色觀察腎臟纖維化程度,PAS染色觀察腎臟組織糖原沉積情況,腎小管損傷評分基于腎小管受損的百分比,利用光學顯微鏡在高倍視野下,對腎小管上皮細胞丟失、壞死、腎小管內碎片和管型形成程度進行評分:無損傷為0分;<25%為1分;25%~50%為2分;50%~75%為3分;>75%為4分[9]。使用Image-pro plus 8.0軟件測量腎臟藍染膠原纖維相對面積、紫紅色糖原沉積相對面積,計算膠原纖維面積百分比、糖原沉積面積百分比,并取平均值。
1.8 Western blot印跡法檢測腎臟IL-1β、IL-6和IL-18蛋白表達水平取20 mg腎臟皮質組織加入200 μL裂解液,研磨后置于搖床搖晃,冰上裂解30 min, 離心(4 ℃, 13 000×g, 20 min),取上清并進行蛋白質定量。取等量蛋白加入蛋白上樣緩沖液混勻,煮沸15 min,進行SDS-PAGE電泳。隨后轉膜,脫脂牛奶封閉2 h;分別加入IL-1β (1 ∶1 000) 、IL6 (1 ∶1 000)、IL-18 (1 ∶1 000)、β-actin (1 ∶5 000)抗體,4 ℃孵育過夜,二抗室溫孵育1 h,用ECL化學發光劑顯影。用Image Lab軟件對凝膠條帶進行灰度值測定及定量分析,各泳道以β-actin為內參對目的條帶進行標準化處理。
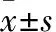
2 結果
2.1 順鉑給藥前后C57BL/6J和N亞系體重變化、生存率的差異如 Fig1所示,C57BL/6J和C57BL/6N亞系小鼠給藥前體質量均一,CDDP給藥后C57BL/6N小鼠體質量比C57BL/6J亞系小鼠體質量下降明顯,且差異有統計學意義(P<0.01)。生存曲線結果顯示,C57BL/6N小鼠存活率較C57BL/6J亞系小鼠高,存活率100%,C57BL/6J亞系小鼠存活率為80%,但差異無統計學意義。

Fig1 Effects of cisplatin on body weight change and survival rate between C57BL6J and 6N
2.2 順鉑在C57BL/6J和N亞系對腎功能指標影響的差異如 Fig2所示,與Control組相比,CDDP給藥后C57BL/6J和C57BL/6N亞系小鼠血清Scr、BUN和β2-MG值均有升高,且差異有統計學意義。C57BL/6N系小鼠與C57BL/6J系小鼠腎功能指標比較,Scr和BUN均值明顯偏高,且差異有統計學意義 (P<0.01)。

Fig2 Effect of renal function in cisplatin-induced renal injury model in C57BL/6J and N substrain
2.3 順鉑腎損傷模型中炎癥因子水平在C57BL/6J和N亞系的差異表現如 Fig3所示,與Control組相比,CDDP給藥后C57BL/6J和C57BL/6N亞系血清中IL-1β、IL-6和IL-18炎癥因子分泌水平均明顯升高(P<0.05)。C57BL/6N小鼠與C57BL/6J系小鼠比較,IL-1β、IL-6和IL-18均值明顯偏高,但無統計學差異。

Fig3 Changes in inflammatory cytokines in cisplatin-induced renal injury model in C57BL/6J and N substrain
2.4 順鉑腎損傷模型中腎臟組織病理變化在C57BL/6J和N亞系的差異表現如Fig4所示,HE染色結果顯示,Control組C57BL/6J和C57BL/6N亞系小鼠腎臟組織無明顯異常,CDDP組C57BL/6J和C57BL/6N亞系小鼠均可見大量的腎小管上皮細胞水樣變性,細胞腫脹,胞質疏松淡染,腎小管管腔內可見脫落的上皮細胞,腎小管形態不規則,病理組織學評分與Control組相比,腎小管損傷差異有統計學意義(P<0.01)。C57BL/6 N亞系小鼠與C57BL/6 J亞系小鼠相比,腎小管損傷嚴重,但差異無統計學意義;Masson染色結果顯示,C57BL/6N亞系小鼠纖維化藍染面積增加,與C57BL/6J系相比差異有統計學意義(P<0.01);PAS染色結果顯示,C57BL/6 N亞系小鼠與C57BL/6 J亞系Control組小鼠相比腎臟組織可見系膜擴張,糖原沉積增加(P<0.05),CDDP組兩亞系組均可見明顯糖原沉積,但差異無統計學意義。

Fig4 Effect of the pathological changes of renal tissue in cisplatin-induced renal injury model in C57BL/6J and N substrain
2.5 順鉑腎損傷模型中炎癥因子IL-6、IL-1β和IL-18蛋白表達水平在C57BL/6J和N亞系的差異表現如Fig5所示,與Control組相比,CDDP組C57BL/6J和C57BL/6N兩亞系小鼠腎皮質組織IL-6、IL-1β和IL-18蛋白表達水平明顯升高(P<0.01或P<0.05)。C57BL/6N小鼠與C57BL/6J系小鼠比較, 其組織中IL-6、IL-1β和IL-18蛋白表達明顯偏高,但差異無統計學意義。

Fig5 Changes in protein expression levels in cisplatin-induced renal injury model in C57BL/6J and N substrain
3 討論
順鉑主要通過腎臟排泄,可通過膜轉運蛋白(轉運蛋白2、銅轉運蛋白1)被近端小管細胞所攝取,其腎毒性主要以腎小管細胞損傷和死亡為常見的組織病理學特征。同時,順鉑在腎小管可引起炎癥、氧化應激、內質網應激、線粒體損傷,進一步導致腎血流減少和腎小球濾過率下降[8,10]。本研究腎功能結果顯示,兩種小鼠CDDP組血清Scr、BUN和β2-MG含量明顯升高,提示腎小球濾過率下降,腎功能受損;病理學檢測結果發現,腎小管上皮細胞變性,壞死脫落,這些結果均提示使用順鉑隔天腹腔注射連續兩周后腎損傷模型構建成功。以往研究發現,在慢性草酸鈣晶體形成出現鈣質沉積相關(calcium oxalate, CaOx)腎病模型中,C57BL/6N小鼠比C57BL/6J小鼠更容易出現CaOx晶體沉積,最后發展為CKD[11]。也有研究報道,在急性CaOx腎病模型中發現C57BL/6J小鼠比C57BL/6N小鼠具有更多的腎臟CaOx晶體沉積,這可能與Nnt蛋白有關[12]。本研究結果顯示,C57BL/6N小鼠的Scr明顯增加,BUN也略高于C57BL/6J小鼠,觀察到的這些表型差異可能與小鼠品系之間的遺傳變異密切相關[11]。
現有證據表明,在AKI反復發作或加重之后,近端小管上皮反復損傷,修復或反應過程中結締組織嚴重積聚,從而持續產生和分泌促纖維化因子,導致腎小管萎縮、腎小管間質纖維化以及長期功能障礙[13-15]。本實驗腎臟組織形態學染色結果顯示,CDDP給藥后腎臟組織可見大量的腎小管上皮細胞水樣變性,壞死脫落,腎小管形態不規則;腎臟組織膠原纖維化嚴重;系膜擴張,糖原過度沉積。在對其進行腎小管損傷評分、纖維化百分比、糖原沉積陽性百分比定量分析后,我們發現順鉑誘導的腎損傷在C57BL/6N小鼠比C57BL6J小鼠病理損傷明顯,C57BL/6N小鼠腎臟纖維化程度尤為嚴重。同時C57BL/6N小鼠注射CDDP后雖然體重較C57BL/6J小鼠下降明顯,但精神狀態、活躍度較C57BL/6J小鼠表現良好,其生存率也較C57BL/6J高,提示C57BL/6N小鼠更適合作為順鉑腎損傷模型的建立動物。糖原沉積多與遺傳、代謝及免疫反應發生有關,我們發現未給藥之前,C57BL/6N小鼠腎臟糖原沉積較C57BL/6J小鼠明顯,且差異有統計學意義,給予順鉑后C57BL/6N小鼠糖原沉積比C57BL/6J小鼠更為嚴重,但差異無統計學意義,這些結果提示我們C57BL/6N小鼠可能作為某些糖原沉積癥的天然模型或者誘發動物更為合適。
IL-1β和IL-6作為促炎核心因子,二者在感染、自身免疫、癌癥和慢性炎癥中發揮著至關重要的作用;IL-18作為獨特的細胞因子,參與癌癥、抑郁癥和認知障礙、腎缺血/再灌注以及各種炎癥性疾病的發生發展。大量研究表明,強烈的炎癥反應與順鉑腎毒性的發病機制息息相關,腎損傷誘導大量促炎細胞因子和趨化因子的合成與釋放[16-17]。促炎細胞因子如IL-1β、IL-6和TNF-α等參與CDDP誘導的AKI,槲皮素可通過降低IL-1β、IL-6和TNF-α參與介導保護順鉑AKI[18]。本研究結果顯示,CDDP可誘導小鼠腎臟組織中IL-6、IL-1β、IL-18等炎癥因子表達水平的升高。其中C57BL/6N系小鼠與C57BL/6J系小鼠比較,均值明顯偏高,但差異無統計學意義,提示C57BL/6N系小鼠較C57BL/6J系小鼠免疫反應強烈,其原因可能與遺傳差異有關。
綜上所述,本研究主要比較了C57BL/6J和C57BL/6N系小鼠在CDDP給藥后腎損傷差異性,結果顯示,C57BL/6J和C57BL/6N小鼠順鉑腎損傷模型均可成功制備,但C57BL/6N系小鼠炎癥損傷反應高于C57BL/6J系小鼠,生存率及生存狀態均優于C57BL/6J系小鼠,腎功能損傷,組織病理損傷、腎臟糖原沉積程度及腎組織纖維化程度均較C57BL/6J系小鼠明顯。C57BL/6N系小鼠在炎癥、糖原沉積方面的特點和纖維化程度及動物存活率的優點有助于腎臟疾病的研究,這為以后選取疾病模型或指導未來相關領域的研究提供了一定的參考依據。
(致謝:特別感謝山西醫科大學藥理教研室各位老師和同學們的幫助。)

