miR-647、miR-122、KMT2D表達與前列腺癌臨床病理特征及預后的相關性分析
胡躍世 李 征 李明林 楊立新 程雙蕾 陶林靜 王 陽
前列腺癌(PCa)好發于老年男性群體,多由前列腺上皮惡性增殖所致,早期可無明顯癥狀,在腫瘤進展過程中可逐漸出現下尿路梗阻、盆腔不適、勃起功能障礙等多種癥狀,一旦腫瘤擴散或轉移至前列腺外,則臨床治療難度更大,會影響患者預后[1-2]。目前,手術為PCa的首選方案,及早切除病灶并于術后開展針對性放化療方案,能夠更好清除殘留的腫瘤細胞,延長患者生存時間[3-4]。但長期隨訪發現,仍有部分患者術后存在較高復發轉移風險,會再次加重患者痛苦,并降低遠期存活率。因此,還需尋找能夠評估腫瘤病情及預后的相關生物學標志物,以便于實現腫瘤的精準治療,改善整體預后。微小RNA-647(miR-647)、微小RNA-122(miR-122)均屬于非編碼小RNA,能參與抑癌基因與癌基因的表達來調控腫瘤的發生及發展[5]。組蛋白賴氨酸甲基轉移酶2D(KMT2D)也可參與腫瘤的發生及發展[6]。但關于上述生物學標志物在PCa中的表達及與臨床病理特征及預后的關系尚不明確。鑒于此,本研究旨在分析PCa組織內miR-647、miR-122、KMT2D與臨床病理特征及預后的相關性。
1 資料與方法
1.1 一般資料
選取100例我院2019年至2021年收治的PCa患者作為研究對象,其中年齡55~86歲,平均年齡(65.89±4.24)歲;體重指數(BMI)18~28 kg/m2,平均BMI(24.25±1.63)kg/m2;腫瘤直徑1.8~5.5 cm,平均腫瘤直徑(3.25±0.34)cm。納入標準:經病理確診為PCa;均行手術為主的綜合治療;心肺功能正常;患者及家屬知情同意。排除標準;肝腎衰竭;存在重癥感染;凝血系統障礙。
1.2 方法
所有患者均開展前列腺根治手術,術中采集腫瘤標本及癌旁正常組織送檢。采用熒光定量PCR技術檢查組織內miR-647、miR-122、KMT2D表達水平,先完成組織RNA提取,之后將RNA反轉錄為cDNA,并稀釋至等量濃度,再配置反應體系,之后應用Primer 5.0軟件設計引物序列,之后繪制擴增曲線,計算miR-647、miR-122、KMT2D的相對含量。
1.3 觀察指標
(1)miR-647、miR-122、KMT2D表達水平:比較腫瘤組織及癌旁正常組織內miR-647、miR-122、KMT2D表達水平差異。(2)miR-647、miR-122、KMT2D表達與臨床病理特征的關系:分析miR-647、miR-122、KMT2D表達與腫瘤分期、腫瘤直徑、淋巴結轉移、微血管侵犯等多方面關系。(3)miR-647、miR-122、KMT2D表達水平與預后關系:所有患者均隨訪2年,統計患者復發轉移情況,比較復發轉移與未復發轉移患者miR-647、miR-122、KMT2D表達間差異。
1.4 統計學方法
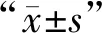
2 結果
2.1 miR-647、miR-122、KMT2D表達水平
腫瘤組織內miR-647表達水平較癌旁正常組織低,miR-122、KMT2D表達水平較對照組低(P<0.05),見表1。
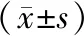
表1 兩組miR-647、miR-122、KMT2D表達水平對比
2.2 miR-647、miR-122、KMT2D表達與臨床病理特征的關系
腫瘤分期Ⅲ期、腫瘤直徑≥3 cm、有淋巴結轉移及有微血管侵犯患者miR-647表達水平低于腫瘤分期Ⅰ~Ⅱ期、腫瘤直徑<3 cm、無淋巴結轉移及無微血管侵犯患者,miR-122、KMT2D表達水平高于腫瘤分期Ⅰ~Ⅱ期、腫瘤直徑<3 cm、無淋巴結轉移及無微血管侵犯患者(P<0.05),見表2。
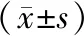
表2 miR-647、miR-122、KMT2D表達與其臨床病理特征的關系
2.3 miR-647、miR-122、KMT2D表達水平與患者預后的關系
100例患者術后隨訪2年,共出現24例復發轉移,復發轉移率為24.00%(24/100);復發轉移患者miR-647表達水平低于未復發轉移患者,miR-122、KMT2D表達水平較未復發轉移患者高(P<0.05)。見表3。
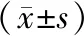
表3 兩組miR-647、miR-122、KMT2D表達水平對比
3 討論
PCa病因復雜,臨床認為在年齡、遺傳、基因改變等多種因素的影響下,可造成前列腺上皮細胞周期紊亂,并出現不可控增殖現象,最終形成腫瘤組織[7-8]。而PCa早期無明顯癥狀,進展過程中出現尿頻、尿急等癥狀也易與其他良性前列腺疾病相混淆,不易被患者重視。但PCa侵襲性及轉移性強,腫瘤生長過程中可向前列腺外擴散,一旦未能得到及時診治,則可增加死亡風險。手術為當前首選治療方案,術后再輔以放化療等治療,可更好抑制殘留腫瘤細胞增殖,提高患者遠期生存率。但惡性腫瘤的較為復雜,是一種由多基因、多因素相互作用介導的過程,即使經過規范化治療后,仍有部分患者的預后偏差,易再次復發轉移,降低生存質量[9-10]。因此,還需尋找能夠更為精準評估患者病情及預后的標志物,為臨床治療提供新的方向,實現腫瘤的穩定控制。
miRNA是一類非編碼單鏈小分子RNA,可結合靶基因mRNA的3'-非翻譯區,實現靶基因表達的負反饋調節,并能夠參與基因調控。miR-647則是miRNA家族重要成員,其腫瘤的調控中能夠起到抑癌作用,其處于高表達狀態時嫩能夠靶向調控下游基因表達抑制腫瘤的生長、分化等多個過程,從而阻止腫瘤增殖、擴散或轉移,阻斷腫瘤進展[11]。反之,其處于低表達狀態時,則腫瘤細胞增殖及分化活性明顯增強。miR-122也是miRNA家族成員,在PCa中存在癌基因作用,其處于高表達狀態時,則有助于腫瘤的生長、分化及擴散,能夠促進腫瘤進展。KMT2D在調控胚胎發育、組織分化及代謝等方面具有重要作用,臨床認為其處于沉默狀態是,會影響體內多種基因增強子活性,使得基因表達受到抑制,從而干擾PI3K/AKT通路,降低腫瘤細胞增殖、侵襲及遷移活性,最終抑制腫瘤的進展[12]。而其處于高表達狀態時,則可起到反向作用,利于腫瘤的擴散、轉移及侵襲。本研究結果顯示,腫瘤組織內miR-647表達水平低于癌旁正常組織,miR-122、KMT2D表達水平低于對照組;腫瘤分期Ⅲ期、腫瘤直徑≥3 cm、有淋巴結轉移及有微血管侵犯患者miR-647表達水平低于腫瘤分期Ⅰ~Ⅱ期、腫瘤直徑<3 cm、無淋巴結轉移及無微血管侵犯患者,miR-122、KMT2D表達水平高于腫瘤分期Ⅰ~Ⅱ期、腫瘤直徑<3 cm、無淋巴結轉移及無微血管侵犯患者;100例患者術后隨訪2年,共出現24例復發轉移,復發轉移率為24.00%(24/100);復發轉移患者miR-647表達水平低于未復發轉移患者,miR-122、KMT2D表達水平高于未復發轉移患者;提示miR-647在PCa中表達水平低,miR-122、KMT2D表達水平高,均與臨床病理特征及預后關系密切,或可作為臨床治療新靶點。分析原因為,當miR-647處于低表達,miR-122、KMT2D處于高表達狀態時,則能夠提高腫瘤的分化及侵襲能力,使得腫瘤迅速進展,故患者腫瘤分期偏高,易伴有淋巴結轉移等現象,從而增加臨床治療難度,導致預后偏差,遠期易出現復發轉移現象,降低整體生存率。
綜上所述,miR-647、miR-122、KMT2D在PCa中存在不同表達,但均與臨床病理特征關系密切,且會影響患者預后,需加以重視。

