表柔比星、紫杉醇化療輔助胃癌根治術患者血清HSP90α、CYFR211水平變化及預后影響因素分析
劉要先 王海增 劉 剛 鄧 飛
胃癌是臨床上常見的一種疾病,與幽門螺桿菌的感染、遺傳等因素相關,發病早期多無明顯癥狀,進展期常表現為體重減輕、上腹疼痛,到了晚期更有消瘦、厭食、貧血等癥狀,對患者的生命健康產生了極為不利的影響[1]。手術切除是治療胃癌的常用方法,研究表明[2],切除胃癌的患者5年內生存率20%~30%,預后相對較差。術前對患者使用動脈介入化療能夠縮小病灶,降低胃癌惡性程度,有利于提高手術切除率[3]。表柔比星為蒽醌類抗腫瘤類藥物,為阿霉素的同分異構體,可干擾DNA、RNA的形成,抑制腫瘤細胞增殖[4],是一種有效的治療癌癥的藥物。紫杉醇最早是在紅豆杉的樹葉、樹皮等部位中提取的天然物質,是一種植物類的抗腫瘤藥物。它能夠抑制胃癌細胞的分裂,使其無法復制,起到殺死癌細胞的作用。血清HSP90α即熱休克蛋白90α,廣泛存在于真核生物細胞中,與腫瘤細胞的增殖、分化、形成有著密切關系[5]。血清CYFR211即細胞角質蛋白,是一種可溶性細胞蛋白片段,當細胞發生癌變時,其水平升高,屬于非器官特異性腫瘤標志物[6]。因此,本研究將探討表柔比星聯合紫杉醇經動脈介入化療對胃癌根治術患者預后及血清HSP90α、CYFR211的影響。現報告如下。
1 資料與方法
1.1 一般資料
2018年1月至2020年3月,選擇到本院就診并進行胃癌根治術的患者96例,其中,男性60例,女性36例;年齡52~75歲,平均(60.42±6.87)歲;胃癌發生部位:賁門38例,胃體18例,胃竇40例;腫瘤分化程度:中高度分化43例,低分化53例;TNM分期:Ⅰ期34例,Ⅱ期18例,Ⅲ期35例,Ⅳ期9例;腫瘤直徑:≥5 cm 40例,<5 cm 56例;體質指數≥25 kg/m2的37例,<25 kg/m2的59例。本研究經醫院倫理委員會批準。
1.2 診斷標準、納入標準、排除標準
診斷標準:《中華醫學會胃癌臨床診療指南》[3]。
納入標準:①接受胃癌根治術治療,并在術后接受輔助化療治療;②確診為胃癌;③臨床病歷資料完整;④患者對本研究知情同意。
排除標準:①胃癌出現腹膜轉移或者遠端轉移者;②重要器官功能衰竭者;③未能順利實施手術者;④存在凝血功能障礙者。
1.3 方法
在胃癌根治術之前給予患者經動脈介入化療。采用Seldinger法建立右側股動脈通道,穿刺置管,將管道置于腹主動脈起始段,采用造影劑顯示腫瘤位置、主要供血動脈,為進一步插管做準備。給予60 mg/m2表柔比星+75 mg/m2紫杉醇+0.9%Nacl注射液40 ml混合一次性微泵注入。化療前常規靜脈推注地塞米松10 mg,以減輕不良反應。術后常規檢查肝功能、血常規等,7~10天后進行胃癌根治術治療。
1.4 觀察指標
(1)血清HSP90α、CYFR211水平比較。患者均于治療前、治療6周后、治療12周后清晨取空腹靜脈血,離心分離血清,冷凍保存備用,采用酶聯免疫吸附法(ELISA)檢測血清HSP90α,采用磁微粒法檢測CYFR211水平。
(2)對患者隨訪2年,統計無進展生存時間(PFS)和總生存時間(OS),PFS是指從腫瘤開始治療到腫瘤發生繼發性生長之間的時間跨度。OS是指從治療開始到因該疾病引起死亡的時間。
(3)胃癌根治術預后相關的影響因素。根據實體腫瘤WHO客觀評價標準對患者預后進行評估,分為預后良好組和預后不良組,其中病情完全緩解、部分緩解歸為預后良好組,病情穩定與進展歸為預后不良組。收集患者年齡、性別、體質指數、腫瘤直徑、手術時間、手術出血量、手術方式、胃癌切除范圍、TNM分期、嚴重不良反應等臨床病理資料,單因素分析影響胃癌根治術患者預后的因素后進行多因素logistic回歸分析,確定影響胃癌根治術患者預后不良的獨立危險因素。
1.5 統計學處理
數據使用SPSS25.0開展計算。計量資料符合正態分布,均用均數±標準差表示,行t檢驗;計數資料用n(%)表示,行卡方檢驗。采用logistic回歸分析影響胃癌患者預后不良的危險因素,P<0.05表示差異有統計學意義。
2 結果
2.1 血清HSP90α、CYFR211水平比較
治療6周后,2組患者血清HSP90α、CYFR211水平較治療前低(P<0.05);治療12周后,2組患者血清HSP90α、CYFR211水平較治療前及治療6周后低(P<0.05)。見表1。
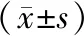
表1 血清HSP90α、CYFR211水平比較
2.2 PFS和OS
隨訪2年,中位隨訪時間9個月。6個月、1年、2年無進展生存率分別為58.3%、30.2%、20.2%。6個月、1年、2年總生存率分別為81.2%、63.5%、32.6%。中位PFS和OS分別為10個月、16個月。
2.3 影響胃癌根治術預后的單因素分析
治療結束后,根據實體腫瘤WTO客觀評價標準評估,預后良好63例,預后不良33例。
單因素分析表明,胃癌根治術患者的預后與性別、體質指數、手術出血量、手術方式、術后是否出現嚴重不良反應、胃癌發生部位無關(P>0.05);而與年齡、腫瘤直徑、手術時間、胃切除范圍、TNM分期、腫瘤分化程度有關(P<0.05)。見表2。

表2 影響胃癌根治術預后的單因素分析/例
2.4 影響胃癌根治術預后的多因素分析
Logistic回歸分析表明,年齡、腫瘤直徑、胃切除范圍、手術時間、TNM分期、腫瘤分化程度是胃癌根治術患者預后不良的獨立危險因素(P<0.05)。見表3。

表3 影響胃癌根治術預后的多因素logistic分析
3 討論
胃癌主要起源于胃黏膜上皮細胞,與患者的暴飲暴食、飲食不規律、遺傳因素、幽門螺桿菌感染、慢性萎縮性胃炎、出現癌前變化(異型增生、腸上皮化生)等相關。50歲~70歲的中老年群體是胃癌的高發階段,且有家族遺傳史的胃癌患者,發病率是普通人群的2~3倍。近年來隨著人口老齡化的增長,胃癌的發病率不斷增高,盡管醫學技術不斷發展,對于胃癌的治療也越來越規范,但全球各國胃癌死亡率仍是居高不下,在我國更是位居惡性腫瘤死亡率的首位[7]。胃癌早期無明顯癥狀,發現時通常已到了中晚期階段,首推手術治療,傳統的開腹手術由于操作復雜、患者術后并發癥多等原因,已經逐漸被腹腔鏡下胃癌根治術所替代。腹腔鏡下胃癌根治術具有切口小、術后胃腸道功能恢復快、術中出血量少、術后疼痛少等優點,但由于中老年人體質、免疫力較弱,容易出現腹腔感染、肺部感染、術后阻塞等多種術后并發癥,且疾病容易復發,因此進行經動脈介入化療對其疾病治愈具有重要作用。由于胃癌晚期容易出現肝轉移、手術出血量較大等因素,動脈介入化療已成為胃癌術前、術后的重要輔助治療手段。此種化療通過縮小惡性腫瘤體積,改善腫瘤浸潤程度,減少手術風險,增加手術切除率,進而提高患者的生存率。動脈介入化療是一種新型動脈局部化療方法,可以使藥物直達腫物,針對性強,定位準確,藥物在腫瘤區域滯留時間長,濃度高,使手術更加順利的進行,延長患者生存期[8-10]。動脈局部介入治療可使藥物直達腫瘤區域,對癌癥所在器官損傷較小。
表柔比星是一種有效的抗癌藥物,可作用于細胞核,在DNA堿基中直接嵌入,同DNA結合后抑制DNA的轉錄、mRNA的形成,從而抑制核酸的合成及有絲分裂,使得腫瘤細胞不能過度繁殖[11]。其次表柔比星治療腫瘤安全性高、毒性小,由于其半衰期短,體內蓄積少,清除更快,對心臟的副作用小,不良反應輕[12]。紫杉醇是從紅豆杉中提取出來的一種生物堿,多為注射劑,藥物進入血管后,可調節微管蛋白的聚合形成,抑制微管蛋白的解聚,使細胞周期停滯,干擾細胞分裂、分化,具有良好的抗腫瘤作用,常被用于治療乳腺癌、卵巢癌等婦科性疾病[13]。但紫杉醇具有較高的神經毒性,患者過敏反應較大,這些限制了其臨床應用。近年來,隨著醫學技術的發展,紫杉醇的新劑型陸續被開發應用。注射用紫杉醇(白蛋白結合型)、脂質體紫杉醇均被證明可以提高患者的耐受力,更好地發揮抗腫瘤活性,使得紫杉醇的不良反應降低、毒性降低[14-15]。
本研究結果中,患者治療前、治療6周后、治療12周后,血清HSP90α、CYFR211水平逐漸降低,提示表柔比星聯合紫杉醇經動脈介入化療治療后患者抗腫瘤標志物-血清HSP90α、CYFR211水平均得以降低,說明患者病情有所好轉。血清HSP90α是人體重要的生物活性物質,研究證實,癌細胞的血清HSP90α表達活性較高,其通過與病變蛋白的特異性結合阻止細胞凋亡,加速細胞增殖,誘發癌細胞形成[16]。血清HSP90α特異性與靈敏度較高,表達水平與腫瘤細胞的分化程度呈現正相關,可以利用它來預測患者的預后。在發生癌變時,大量的蛋白酶被激活,血清CYFR211由于是細胞角蛋白,因此被快速降解進入血液中,水平升高。由于CYFR211屬于非器官特異性標志物,其與血清HSP90α聯合檢測時,可以提高診斷的準確性[17-18]。
本研究中進一步對影響患者預后的因素進行分析,結果顯示,患者的預后與性別、體質指數、手術出血量、手術方式、術后是否出現嚴重不良反應、胃癌發生部位無關,而與年齡、腫瘤直徑、手術時間、胃切除范圍、TNM分期、腫瘤分化程度有關。多因素Logistic回歸分析表明,年齡、腫瘤直徑、胃切除范圍、手術時間、TNM分期、腫瘤分化程度是影響胃癌根治術患者預后的獨立因素。分析原因,年齡越大,患者體質越差,術后越難恢復,同時高齡患者也容易出現各種慢性器質性疾病,容易給疾病預后產生不利影響;腫瘤越大,胃切除范圍就越大,全胃切除不僅會損傷周圍機體組織,而且容易造成肺部感染的出現,對機體造成較大損傷使得康復艱難,影響預后;手術時間越長患者腹腔暴露時間越久,越容易發生感染,影響預后;TNM分期表示的是腫瘤分化程度、轉移程度,腫瘤轉移范圍越大,惡性程度越高,越難治療,從而影響疾病預后;腫瘤分化程度越低說明腫瘤細胞與正常細胞的差異越高,患者病情較重,惡性程度較高,影響預后。
綜上所述,表柔比星聯合紫杉醇經動脈介入化療有效性較高,可顯著降低患者體內血清標志物水平。影響疾病預后的因素較多,在掌握這些因素的前提下開展圍術期管理,可有效改善預后。

