復發性腦膠質瘤患者再手術治療的預后因素分析
田月玲 張 輝 張文進 魏旭洋
腦膠質瘤作為顱內最致命的一種原發性腦腫瘤,近年來因顯微神經外科技術、放化療等綜合水平提升,患者平均生存期有所延長,但術后復發依然是預后不良的主要原因[1]。目前,手術仍為腦膠質瘤的主要療法,其原則是最大程度保護腦功能的前提下最大范圍切除腫瘤[2]。然而,因腦膠質瘤廣泛浸潤性生長、侵犯周圍腦組織等生物學特性,導致手術無法徹底清除全部腫瘤細胞,加上部分患者腦膠質瘤侵犯功能區時,為維護正常神經功能,須保留性切除腫瘤,使患者術后殘留腫瘤病灶,復發風險極高[3]。關于復發性腦膠質瘤的治療策略,迄今尚無標準化治療方案,臨床主要根據腫瘤情況、患者機能狀態等決定,旨在延長生存時間,改善生活質量。再手術為復發性腦膠質瘤患者的治療選擇之一,但其指征、預后尚無定論,多數研究源自國外,且研究結果不一。鑒于上,我們對一組接受再手術治療的復發性腦膠質瘤患者臨床資料進行回顧性分析,探究影響其預后的相關因素,為復發性腦膠質瘤的合理治療方案制定提供借鑒。
1 資料與方法
1.1 研究對象
查閱2019年1月至2022年1月期間,在我院接受再手術治療的復發性腦膠質瘤患者臨床資料。納入標準:①首次手術后病理檢查確診為腦膠質瘤,且再次復發;②需進行再手術治療;③再手術后病檢報告為腦膠質瘤;④兩次手術時間間隔在1個月以上;⑤臨床資料及隨訪資料完整。排除標準:①合并其他重要臟器嚴重疾病;②因首次術后并發癥等非復發因素進行再次手術治療;③隨訪期間死亡病例確認死于腦膠質瘤相關因素,非自殺或他殺等無關因素。復發標準[4]:原發腫瘤處或其周圍2 cm內出現腫瘤,復發時間為首次切除到定期復查發現腫瘤病灶復發的間隔時間。
1.2 方法
1.2.1 資料收集 檢索本組患者的資料信息,包括性別、復發腫瘤體積、兩次手術間隔時間、再手術年齡、腫瘤位置、再手術前卡氏功能狀態評分標準(Karnofsky,KPS)評分[5]、病理分級、再手術切除范圍、再次術后有無放化療。其中,KPS評分范圍是0~100分,評分越高表示身體機能狀態越好,其中KPS<70分表示生活需要幫助,KPS≥70分表示生活基本能夠自理;病理分級參考《中國中樞神經系統惡性膠質瘤診斷和治療共識》[6]中膠質瘤分類標準分為Ⅰ~Ⅱ級(低級別膠質瘤)和Ⅲ~Ⅳ級(高級別膠質瘤);根據有利/不利手術區域的概念分類[7],術前影像學檢查提示腫瘤位置表淺、不在重要功能區以及累及單一腦葉者為有利手術部位,位置較深或處于重要功能區或累及多個腦葉為不利手術部位。
1.2.2 研究方法 對本組患者進行1年左右的隨訪,以2022年1月1日為起始時間,以患者死亡為終止時間,統計本組患者再手術后1年存活率,對比不同預后患者的臨床資料差異,經Cox回歸分析其影響因素。
1.3 統計學方法
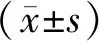
2 結果
2.1 腦膠質瘤患者再手術治療后1年生存率
80例腦膠質瘤患者再手術后平均隨訪時間為(12.75±0.50)個月,其術后1年生存率為71.25%(57/80),平均生存時間是14.84個月,中位生存時間為15個月。見圖1。
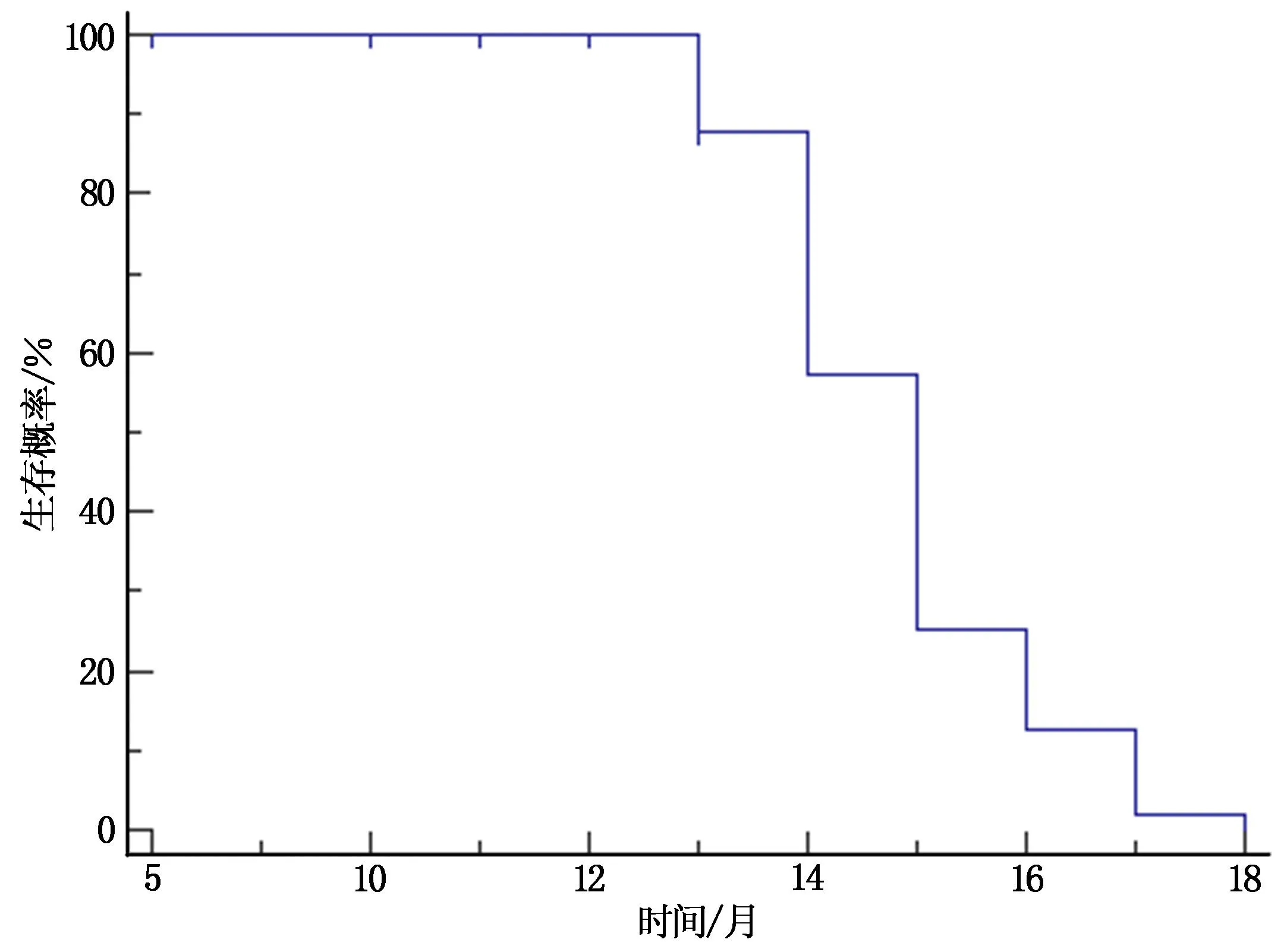
圖1 80例腦膠質瘤患者再手術后生存曲線
2.2 存活組和死亡組的臨床資料比較
與死亡組比較,存活組再手術前KPS評分、病理Ⅰ~Ⅱ級和全切手術者占比均較高(P<0.05),其余資料比較差異無統計學意義(P>0.05),見表1。
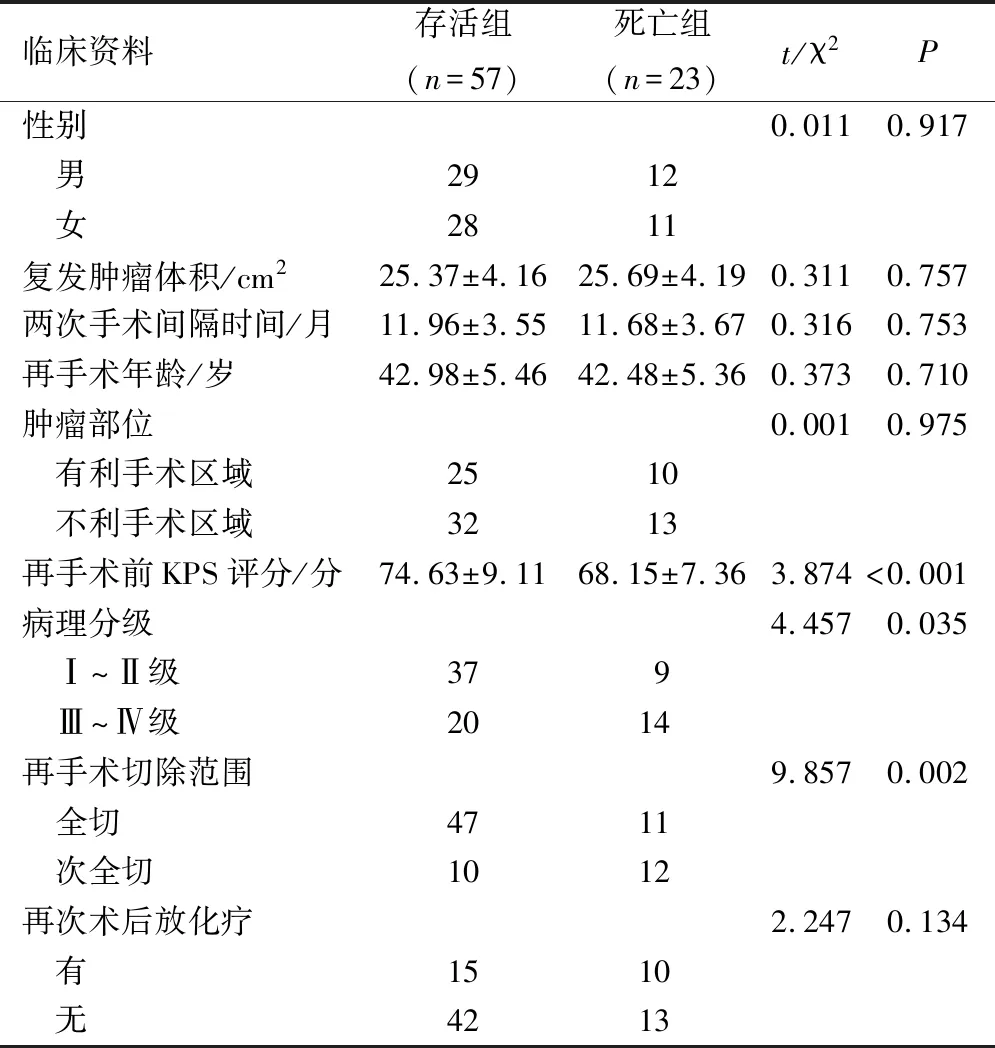
表1 存活組和死亡組的臨床資料
2.3 再手術預后影響因素的多因素Cox回歸分析
經Cox回歸分析發現:再手術前KPS評分、病理分級和手術切除范圍與復發性腦膠質瘤患者再手術后預后有關,再手術前KPS評分低、病理分級高、次全切手術是其再手術后1年死亡的獨立危險因素(P<0.05),見表2。

表2 Cox回歸分析再手術預后影響因素
2.4 再手術切除范圍、術前KPS評分和病理分級對再手術預后的預測價值
由ROC曲線發現,再手術前KPS評分、病理分級和手術切除范圍對預測患者再手術后1年預后均具有一定價值,3項聯合效能最高,見表3與圖2。
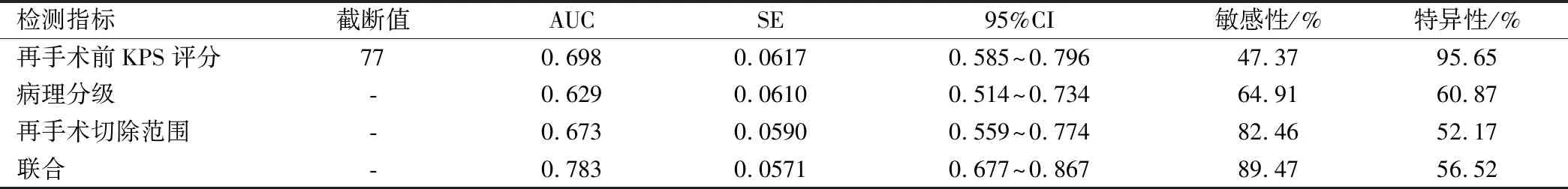
表3 再手術前KPS評分、病理分級和手術切除范圍預測再手術后預后的效能分析
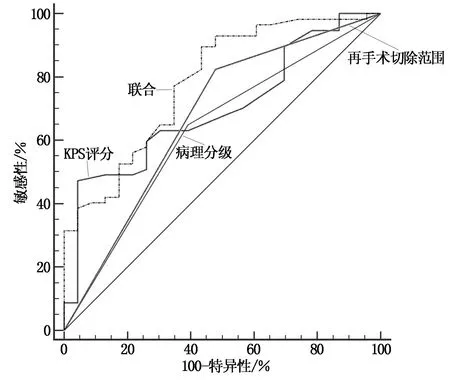
圖2 ROC曲線
3 討論
腦膠質瘤作為發生在神經外胚層的的惡性顱內腫瘤,因其多樣性、強侵襲性和異質性而致命,但發病機制尚未完全闡明。腦膠質瘤組織呈浸潤性生長,即使顯微手術也難以達到組織學全切除的目標,術后輔助放化療可以減少殘留的癌細胞增殖,但最終不可避免臨床復發,須予以再手術治療[8]。邢東風等[9]證明再手術可延長復發性腦膠質瘤患者生存期限。本研究即對80例復發性腦膠質瘤患者進行再手術治療,由圖1可知其術后1年生存率為71.25%,中位生存時間為15個月。張繼東等[10]表明復發性腦膠質瘤經手術聯合化療后1年生存率53.3%,與本研究相比稍低,可能與其樣本量過小有關。
近期國外研究[11]表明,腦膠質瘤總會復發,故其復發后再手術操作日益常見,但再手術在適應癥上尚無明確共識。因此,筆者認為探索復發腦膠質瘤再手術后預后的影響因素十分必要,可供醫師進一步完善再手術前準備工作,加深再手術適應癥的研究,從而保障復發患者從再手術中能夠獲益。根據表1可知,存活組再手術前KPS評分、病理Ⅰ~Ⅱ級和全切手術者占比高于死亡組,進一步行Cox回歸分析發現其可能是影響患者再手術后預后的相關因素。分析是因為,KPS評分是評估患者身體機能狀態的國際通用工具,也是腫瘤學中廣泛使用的功能性能量表,再手術前KPS評分高表示該患者身體機能狀態良好,對手術耐受性更強,更容易從再手術治療中獲益[12]。Quick等[13]經多變量分析發現,膠質母細胞瘤患者術前KPS評分與其預后存在相關性趨勢,且其復發腫瘤病灶徹底清除程度也與預后有明確相關性,故認為復發性膠質母細胞瘤患者若具備良好的身體條件,選擇再手術清除復發病灶是值得推薦的。本研究中,再手術前KPS評分不僅是復發性腦膠質瘤患者再手術后預后的影響因素,結合表3可知其可作為預后預測因子,KPS評分<77分可能是預后不良的危險因素。Wu等[14]報道高級組織學分級、KPS評分<80分被認為是影響膠質瘤術后預后的危險因素,本研究結果與之類似。腦膠質瘤的病理分級為Ⅲ~Ⅳ級者屬于高級別膠質瘤,主要包括膠質母細胞瘤、間變性星形細胞瘤等,其預后較差,患者再手術后生存期在1年左右。事實上,國外也常以病理分級作為癌癥術前治療方案制定的重要標準[15]。由此可見,病理分級較高也是腦膠質瘤患者再手術后預后不良的危險因素,且病理分級亦可作為預測因子。本研究中,再手術切除范圍也是Cox多因素分析中表現出有統計學意義的指標,即復發性腦膠質瘤患者再手術切除范圍與其術后生存率顯著相關,手術切除越完全,術后生存率越高。Verburg等[16]經研究證明,彌漫性膠質瘤的切除程度與生存率正相關,本研究結果與之一致,推測是因為腫瘤切除范圍越大,復發、轉移的幾率越低,故建議在可行條件下進行最大限度地安全切除。然而,再手術治療目的不僅是延長生存期限,還兼減輕腫瘤占位效應造成的神經功能障礙。臨床醫師多選擇保留性切除復發性腦膠質瘤,以最大限度地保留神經功能,從而提高其術后生活質量。腫瘤切除范圍與腫瘤部位也有關,非功能區、淺表部位腫瘤再次手術容易被徹底清除,患者雖遺留神經障礙,但整體預后優于深部腫瘤病例;功能區、深部腫瘤和神經血管關系密切,難以最大程度切除。本研究中,腫瘤部位非患者預后的影響因素,可能與樣本量小、非前瞻性多中心研究有關。
筆者通過繪制ROC曲線分析腦膠質瘤再手術后預后影響因素的預測價值,結果顯示:病理分級、KPS評分和手術切除范圍均可作為再手術后生存率的預測因子,但敏感度、特異度不高,尤其是KPS評分,敏感度僅47.37%,但三項指標聯合預測AUC為0.783,高于單一預測方法,可見聯合預測效能更高,建議臨床醫師參考應用,盡可能改善患者再手術前身體條件,嚴格篩查腫瘤病理分級,盡可能為低級別膠質瘤患者安排再手術,結合腫瘤條件以及儀器最大限度地安全切除腫瘤,從而改善預后。
綜上,病理分級、KPS評分和手術切除范圍是復發性腦膠質瘤患者再手術治療后的1年生存率的影響因素,聯合預測患者再手術后預后的價值顯著。但本研究也存在一些不足,如樣本量尚不夠大、非盲法研究等,可能為研究帶來偏倚,這些有待將來完善。

