大體積腦轉移瘤大分割后程縮野放療的劑量學及臨床療效分析
張凱燕 謝 琛 張懷文 李俊玉
腦轉移瘤(brain metastases,BM)是顱內最常見的惡性腫瘤,20%~30%的實體瘤患者會發生腦轉移[1]。大體積的腦轉移瘤預后明顯劣于小體積腦轉移瘤,放射治療是其主要治療手段,但目前針對大體積腦轉移瘤處方劑量尚無統一標準。大分割放射治療局部控制優于常規分割,但其放射性損傷可能加重。國內外有許多探索大體積腦轉移瘤最有效的分割方式和劑量學研究,旨在提高腫瘤局部控制同時將放射性壞死率降至最低。目前國外多采用3~5次分割的立體定向放射治療,多適用于直徑小于3 cm的腦轉移瘤,對于大于3 cm的轉移癌由于存在瘤內出血、靠近功能區不適合立體定向外科治療。大分割放射治療可以提高照射的耐受性,Megumi等[2]回顧性分析了27個腦轉移病灶13次立體定向放射外科治療(SRT)治療期間靶區的變化,對于腫瘤組織,放療劑量疊加使腫瘤體積向心性退縮,做分段計劃可使劑量曲線向腫瘤方向內收,從而有效減少靶區漏照及正常腦組織受量。
本研究旨在探討大分割后程縮野放療對大體積腦轉移瘤患者的劑量學影響及臨床分析,并對影響近期療效的相關因素進行分析,為大體積腦轉移瘤臨床治療方案提供參考。
1 資料與方法
1.1 一般資料
回顧性納入自2020年10月至2022年12月我院收治的行大分割后程縮野放療的腦轉移瘤患者。納入標準:①已明確原發病灶病理診斷為非小細胞肺癌及乳腺癌的患者,經增強MRI診斷為腦轉移瘤;②治療方式為大分割后程縮野放療;③病灶體積為6~20 cm3且個數1~4個。排除標準:①未配合完成治療者;②沒有經過評估復查或隨訪信息不完整者;③合并腦膜轉移者;④后續放療計劃加入全腦放療者。本研究共20例腦轉移瘤患者符合標準。男性8例,女性12例,中位年齡為57.5歲(27~83歲),非小細胞肺癌和乳腺癌分別占55%和45%,中位KPS評分80分,中位GPA評分1.5分,中位RPA分級Ⅱ級。所有治療病灶數共37個,其中大病灶21個,大病灶中位GTV體積為15.37(6.78~19.54)cm3。中位病灶數為2(1~3)個,病灶總體積中位值為17.1(6.83~23.49)cm3。僅1例NSCLC患者接受了EGFR-TKI靶向治療,該患者基因檢測結果顯示21外顯子突變。
1.2 研究方法
所有患者均經瓦里安加速器完成放療,取仰臥位,采用頭頸肩熱塑膜進行體位固定。定位CT及定位MRI掃描層厚為均為2 mm。之后于Pinnacle系統進行圖像融合及勾畫靶區。大體腫瘤體積(GTV)為磁共振強化的腦轉移瘤區域,不包括水腫帶;計劃靶區體積(PTV)為GTV三維外擴2 mm,同時內收2 mm形成Boost區。大體積病灶處方劑量為52.5 Gy/3.5 Gy/15 f,Boost區推量至60 Gy/4 Gy/15 f。部分腦干區域病灶采用50 Gy/2.5 Gy/20 f,內收Boost推量至60 Gy/3 Gy/20 f,所有患者在治療10次后復查頭部增強MRI評估療效,如GTV明顯縮小則重新勾畫靶區,完成剩余劑量照射。
為每位患者制作兩組計劃:①全程不縮野照射時放療計劃Plan1;②腫瘤靶區縮野后重新制作放療計劃,同時將Plan1的前10次計劃和腫瘤靶區縮野后的5次計劃融合形成總Plan2。評估靶區縮野后總Plan2對比不縮野Plan1的放療計劃相關劑量學參數變化。所有的患者放療技術采用的是VMAT技術,根據各自腫瘤靶區的實際位置設置具體角度。為了保持治療設計的一致性,減少人為誤差,所有治療計劃及操作均有同一個專業資深放射物理師完成。利用劑量體積直方圖(dose volume histograms,DVHs)來評價兩種放療計劃。
危及器官限量包括:晶體最大劑量<8 Gy,視神經、視交叉最大劑量<54 Gy,腦干最大劑量<54 Gy。部分患者(病灶位于腦干者)對腦干進行了嚴格限量:腦干平均劑量<35 Gy。
1.3 觀察指標
(1)劑量學參數評估:評估Plan1和Plan2計劃靶區均勻性指數(HI)及適形度指數(CI),Dmax(靶區內最大劑量)、Dmin(靶區內最小劑量)、Dmean(靶區內平均劑量)。根據RTOG 98-03號報告定義HI=D5/D95,根據ICRU 83號報告定義CI=(Vtref/Vt)×(Vtref/Vref)。比較兩組計劃中正常腦組織及其他危及器官受照劑量的變化。其他危及器官評價指標:腦干、視神經、視交叉、晶體的Dmean和Dmax。(2)療效評價:評價縮瘤率及近期療效,縮瘤率=(第一段GTV體積-后程GTV體積)/第一段GTV體積。近期療效:于放療結束后2~3個月評估。選擇RECIST標準:完全緩解(CR):增強MRI檢查示目標病灶完全消失;部分緩解(PR):目標病灶直徑之和減少>30%;穩定(SD):目標病灶減小的程度介于PR和PD之間;進展(PD):目標病灶直徑總和增加>20%。客觀緩解率(ORR)=(CR+PR)例數/總例數×100%。局部控制率(LCR)=(CR+PR+SD)例數/總例數×100%。(3)不良反應:記錄放療不良事件的發生,例如頭暈、惡心嘔吐、影像學復查放射性腦損傷的發生。
1.4 統計學方法
應用SPSS 24.0軟件進行統計分析,計量資料采用均數±標準差進行描述分析。對腦組織及其他危及器官劑量參數進行兩配對樣本t檢驗。對影響腫瘤縮瘤體積差的相關因素采用Kruskal-Wallis H檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 計劃靶區劑量學參數分析
本研究中兩個計劃PTV均達到了處方劑量要求,劑量學參數數值具體見表1。兩個計劃靶區劑量參數差異無統計學意義。
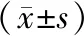
表1 后程計劃PTV劑量學參數比較
2.2 正常腦組織劑量學參數分析
Plan2相比于Plan1,V29降低了11.69 cm3;V30降低了16.99 cm3; V36降低了7.83 cm3;V37降低了10.47 cm3; V43降低了5.26 cm3; V45降低了6.24 cm3,差異均具有統計學意義(P<0.05)。Plan2 Dmean降低了132.17 cGy,差異無統計學意義。腦組織的平均劑量、V29、V30、V36、V37、V43、V45、具體見表2。
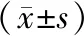
表2 后程計劃腦組織劑量學參數比較
2.3 其他危及器官劑量學參數分析
兩個計劃危及器官限量均符合標準。Plan2與Plan1比較,Plan2危及器官相關劑量學參數均有不同程度的減少。其中,視交叉Dmean降低了2.43 cGy(P=0.01),Dmax降低了4.1 cGy(P=0.039),見表3。
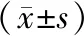
表3 后程計劃危及器官劑量學參數比較
2.4 治療完成情況及近期臨床療效
共21個大病灶納入分析。其中17個大病灶予以處方劑量52.5 Gy/3.5 Gy/15 f治療,等效生物劑量BED為70.87 Gy;4個大病灶因位于腦干,采用50 Gy/2.5 Gy/20 f,等效生物劑量BED為62.5 Gy。所有患者治療10次后,再次行定位頭顱MRI,并根據當前腫瘤大小重新勾畫靶區,完成剩余劑量照射。后程縮野時中位縮瘤率為39.5%(30%~64%),縮野推量前后中位體積差為5.78(2.58~10.0)cm3。大病灶2~3個月及6個月LCR均達100%。具體見表4。

表4 21個大病灶近期療效
2.5 后程縮野放療后腫瘤體積差影響因素分析
腫瘤縮野體積差影響因素分析結果顯示,影響縮野體積差的因素包括原病灶體積(P<0.001),原發病理類型、有無使用EGFR-TKI藥物、BED是否>70 Gy等因素對縮野體積差無明顯影響,見表5。

表5 腫瘤縮野體積差影響因素分析(Kruskal-Wallis H檢驗)
3 討論
本研究回顧分析了20例大分割后程縮野放療應用于大體積腦轉移瘤患者,分析劑量學參數變化及臨床療效,結果表明大分割后程縮野放療縮瘤率高,可有效降低腦組織受量,提高局部控制率、水腫消退率,且全組無≥3級不良事件的發生。研究提示大體積腦轉移瘤患者應用大分割放療時應行后程縮野計劃,以減輕正常器官受量,該治療模式下患者近期療效可。
對于病灶個數局限的腦轉移患者,手術及放療為主要局部治療手段。Churilla等發現,當病灶個數局限且直徑<4 cm時,放療與手術療效相當[3]。但隨著腫瘤體積增大,其放射治療敏感性下降、Anita等人[4]研究得出≤2.5 cm的BM患者SRS治療后1年LCR達91%,>2.5 cm患者LCR僅為40%~46%。Minniti等[5]研究得出同樣的結論,>3 cm病灶單次SRS對比分次SRT局部控制率為54%和73%(P=0.02)。Chon等[6]指出隨著病灶體積增大,腫瘤LCR下降的同時正常腦組織放療后壞死率更高。同時由于大體積腫瘤其占位效應、瘤內出血及功能區壓迫較小體積腫瘤更加明顯,患者對于SRS耐受性降低。故而理論上來說對于大體積腦轉移瘤,大分割放射治療比SRS在耐受性更有優勢,療效不劣于SRS。但是對于大分割的分割方式、單次劑量及腫瘤退縮情況尚無統計共識。
在國內,肖建平等[7]納入84例BM體積>6 cm3患者,分FSRT組和FSRT聯合化療組,處方劑量予以52.5 Gy/3.5 Gy/15 f,結果顯示單純放療組及聯合組1年LCR分別為98%、100%,放射性腦壞死發生率為5.6%。本研究中20例患者3個月及6個月LCR,均為100%。但由于隨訪時間短,未能觀察到1年的局部控制率。至隨訪終點,僅1例患者在放療11.5個月后出現放射性腦損傷。值得注意的是本研究首次觀察大體積腦轉移瘤在放射治療過程中的退縮情況。研究發現后程縮野縮瘤率達42%,所有患者均內收Boost區推至高量,從劑量學角度提高了靶區覆蓋率、降低危及器官的受量。從等效生物劑量角度看52.5 Gy/15 f的生物劑量接根治性放射治療劑量。同時由于單次劑量下降,其對周邊腦組織損傷減小。因此52.5 Gy/15 f的分割方式更適用于大體積腫瘤,但也需要隨機對照研究加以證實。
既往研究發現,當采用3分次立體定向放射治療(Stereotactic Radiotherapy,SRT)時,正常腦組織V18<30 cm3和V23<7 cm3放射性壞死發生風險<10%[8]。正常組織一定劑量受照體積越小,損傷發生的可能越小。Andruska等[9]得出正常腦組織V25和V30是RN發生的顯著劑量學預測因子,建議正常腦組織V25 Gy<16 cm3、V30 Gy<10 cm3使RN風險最小化。馬玉超等[10]研究中同樣指出正常腦組織的Dmean(平均照射劑量)、V30和放療后損傷的發生相關。采用LQ模型進行等效生物劑量轉換,得出15分次下V29、V30、V36、V37、V43、V45(Vx:接受≥xGy的體積)可能和RN的發生最相關。本研究中,正常腦組織劑量學參數在后程縮野時均有顯著差異。這可能是因為本研究處方劑量下腫瘤向心性退縮程度明顯,后程放療計劃中劑量曲線的內收使正常腦組織受照劑量下降,從而可能減少放射性腦損傷事件發生的概率。
綜上所述,由于大分割后程縮野放療縮瘤率高,能有效減少正常腦組織劑量學參數值,對大體積病灶局部控制率好,近期療效佳。本研究樣本量較少,為單中心回顧性研究,且隨訪時間較短,無法觀測到放療遠期不良反應放射性腦損傷發生且未進行生存分析,無法得知該治療模式下患者的遠期生存獲益情況。未來需要進行更大樣本的研究并獲得長期隨訪,以驗證該治療模式的臨床獲益與安全性。

