基于NF-κB/HIF-1α/VEGF信號通路探討貝伐珠單抗聯合化療對上皮性卵巢癌的療效及調控機制
郝玉娟 周 輝 曹 蒙
卵巢癌是女性生殖道惡性腫瘤中發病率第三,病死率第一的婦科惡性腫瘤,其中上皮性卵巢癌居多,5年生存率低于45%。卵巢癌大多發生在50歲以上的人群中,患者常出現非特異性盆腔或腹部癥狀[1-2]。初步診斷檢查包括經陰道超聲檢查和血清腫瘤抗原125測定。然而,這些檢測并不針對卵巢癌。常規治療包括手術減積,然后化療[3-4]。預后通常由癌癥的分期和分級決定,盡管未來的治療可能取決于腫瘤的基因組成。然而在上皮性卵巢癌發生后,由于70%的病例在Ⅲ期或Ⅳ期被診斷,因此預后較差[5-6]。卵巢癌多發生在圍絕經期并且進展速度較快,該過程與激素引起免疫紊亂和血管豐富程度密切相關[7]。據報道,卵巢癌組織中血管生成與血管內皮生長因子(vascular endothelial growthfactor,VEGF)高表達存在緊密聯系,VEGF結合受體后能夠促進卵巢癌新生血管生成并加快腫瘤發展[8]。據報道,抗腫瘤藥物貝伐珠單抗能夠抑制血管內皮生長因子的活性,進而抑制血管形成和腫瘤發展。研究表明,貝伐珠單抗聯合化療方案有利于提高貝伐珠單抗在卵巢癌等癌癥方面的治療效果[9]。目前,相關研究發現NF-κB/HIF-1α/VEGF通路在腫瘤發展中發揮促進作用,例如調控該信號通路能夠干擾食管癌、乳腺癌和皮膚鱗狀細胞癌的發展[10-12]。然而,關于貝伐珠單抗聯合化療治療方案與NF-κB/HIF-1α/VEGF通路在卵巢癌中的關系以及該通路對卵巢癌的發展尚未有過系統性報道。因此,本研究旨在探討貝伐珠單抗在其聯合化療藥物后對卵巢癌的抑癌效果及其相關機制,以期發現新的抗卵巢癌方法。
1 材料與方法
1.1 主要材料
人卵巢癌SKOV3細胞(廣州博輝生物科技);紫杉醇(美國sigma公司);貝伐珠單抗(美國sigma公司);青霉素/鏈霉素(美國Invitrogen公司);RPMI 1640(安諾倫生物科技有限公司);VEFG抗體(英國abcam公司,ab32152);NF-κB p65抗體(美國CST公司,8242S);HIF-1α抗體(美國CST公司,36169S);GAPDH抗體(英國abcam公司,ab8245);Ki-67抗體(美國Santa Cruz公司,SC-23900);Bax抗體(英國abcam公司,ab32503);Bcl-2抗體(英國abcam公司,ab141523)。
1.2 細胞培養與分組
細胞在RPMI 1640培養基(10%胎牛血清)中培養,培養環境為37 ℃和5%濃度的二氧化碳。將細胞分為三組,分別為:①對照組;②貝伐珠單抗組;③聯合用藥組。其中貝伐珠單抗組的給藥濃度為5 μM,聯合用藥組的給藥濃度為貝伐珠單抗(5 μm)和紫杉醇(1 μm),藥物處理24 h后開展后續實驗。
1.3 MTT實驗檢測細胞增殖能力
將SKOV3細胞接種在96孔板中,按照不同實驗組進行不同處理,各組細胞孵育24 h后按照試劑說明書使用MTT試劑進行染色,反應4 h后洗滌未結合的染料,并將染色的細胞溶解在150 μL DMSO中,在490 nm處檢測吸光度以反映細胞增殖能力。
1.4 流式細胞術分析SKOV3細胞凋亡率
不同實驗組處理24 h后,PBS輕微沖洗2次后,在4 ℃下用70%乙醇固定1 h。細胞與50 μL RNase在室溫下孵育10 min以降解RNA。將細胞在4 ℃下以1 500 g離心5 min,然后加入5 μL Annexin V-FITC和5 μL碘化丙啶在室溫下暗處雙染色30 min。使用流式細胞術分析SKOV3細胞凋亡率。
1.5 細胞集落形成實驗分析細胞生長能力
將各組SKOV3細胞用0.25%胰蛋白酶從培養皿消化后,并以3×105個細胞/孔的數量轉移到6孔板培養皿中,24 h后將50個細胞接種于6孔培養皿中,繼續培養2個星期,將細胞用結晶紫溶液染色20 min并在顯微鏡下計數。
1.6 Western blotting檢測蛋白表達變化
使用RIPA裂解緩沖液從細胞系中提取總蛋白質樣品,并使用考馬斯亮藍測定蛋白質濃度。將變性后蛋白樣品在12% SDS-PAGE膠上開始電泳分離,電泳完成后將DS-PAGE膠轉移到PVDF膜上。用在5%脫脂牛奶室溫封閉膜2 h。然后,將PVDF膜與對應的一級抗體在4 ℃下孵育過夜。用TBST洗滌后,將PVDF膜與二級抗體在室溫下孵育2 h,并通過增強型化學發光檢測系統捕獲印記信號。
1.7 Trans well實驗分析SKOV3細胞遷移能力
在無血清RPMI-1640培養基下,將給藥處理完成后的SKOV3細胞轉移到Transwell小室的上面。將含有15%血清的RPMI-1640培養基加入下室。24 h后,在顯微鏡下觀察到侵入下室的細胞,隨后用結晶紫染色,使用Image J軟件統計SKOV3細胞侵襲情況。
1.8 裸鼠異種移植腫瘤模型建立
30只雌性BALBc-Nude裸鼠購于集萃藥康公司,并將裸鼠置于SPF級動物實驗室的環境中飼養,自由飲食、飲水。將SKOV3細胞(1×106個細胞)懸浮在100 μl無血清培養基中,并皮下注射到4~6周齡的裸鼠腋下,飼養2周;當腫瘤體積達到30 mm3時,將接種腫瘤細胞的裸鼠按隨機分為3組,每組10只。對照組裸鼠腹腔注射PBS,1次/天;貝伐珠單抗組腹腔注射貝伐珠單抗(1.5 mg/kg,溶于PBS),1次/天,聯合用藥組腹腔注射貝伐珠單抗(1.5 mg/kg,溶于PBS)+紫杉醇(0.5 mg/kg,溶于PBS)1次/天。各組每日采用游標卡尺測量腫瘤大小,然后通過統計每組裸鼠腫瘤體積。在干預第5個星期后,安樂死裸鼠,分離出腫瘤,稱重后以10%甲醛溶液固定。
1.9 裸鼠腫瘤組織Ki-67表達檢測
采用免疫組織化學法。各組裸鼠腫瘤組織固定48 h后使用石蠟包埋,將包埋后的組織進行切片,然后脫蠟復水,進過抗原修復、過氧化氫酶處理,封閉等步驟后,將切片與Ki-67抗體一起孵育,在含5%BSA的PBS中4 ℃孵育過夜。次日與辣根過氧化物酶偶聯物孵育切片,DAB顯色。最后使用顯微鏡觀察,使用圖像分析軟件Olympus cell Dimension計算陽性率。
1.10 統計學分析
應用SPSS 24.0軟件進行統計分析。所有數據均以mean SD表示。兩組或多組比較采用t檢驗或單因素方差分析。P<0.05為差異具有顯著性。
2 結果
2.1 貝伐珠單抗聯合化療藥物對SKOV3細胞中NF-κB/HIF-1α/VEGF通路的影響
與對照組相比,貝伐珠單抗組、聯合用藥組SKOV3細胞中VEGF/HIF-1α/NF-κB蛋白的表達水平下降(P<0.05)。與貝伐珠單抗組相比,聯合用藥組SKOV3細胞中VEGF/HIF-1α/NF-κB蛋白的表達水平明顯下降(P<0.05),見圖1,表1。結果提示,貝伐珠單抗聯合化療藥物對SKOV3細胞中VEGF/HIF-1α/NF-κB通路具有抑制作用。
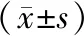
表1 SKOV3細胞中NF-κB/HIF-1α/VEGF通路的相對表達水平
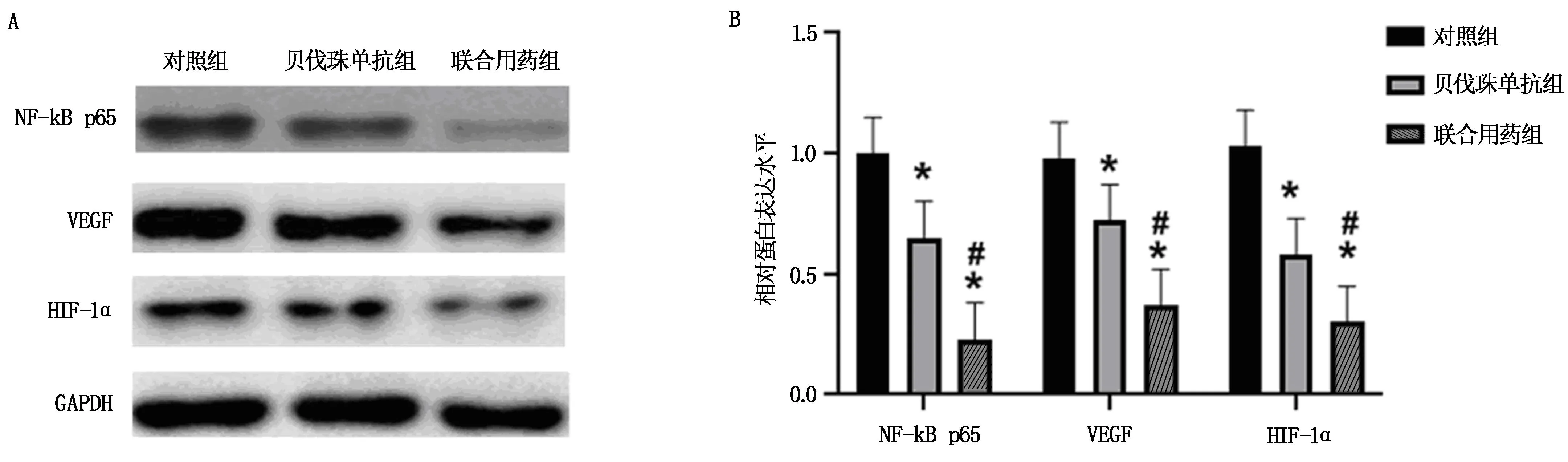
注:A為Western blotting分析結果;B為Western blotting實驗結果。
2.2 貝伐珠單抗聯合化療藥物對SKOV3細胞增殖和侵襲的影響
與對照組相比,貝伐珠單抗組、聯合用藥組SKOV3細胞增殖能力、侵襲能力均下降(P<0.05)。與貝伐珠單抗組相比,聯合用藥組SKOV3細胞增殖、侵襲能力明顯下降,差異均有統計學意義(P<0.05),見圖2和表2。結果提示,貝伐珠單抗聯合化療藥物對SKOV3細胞的增殖、侵襲能力具有抑制作用。
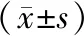
表2 貝伐珠單抗聯合化療藥物對SKOV3細胞增殖、侵襲的影響
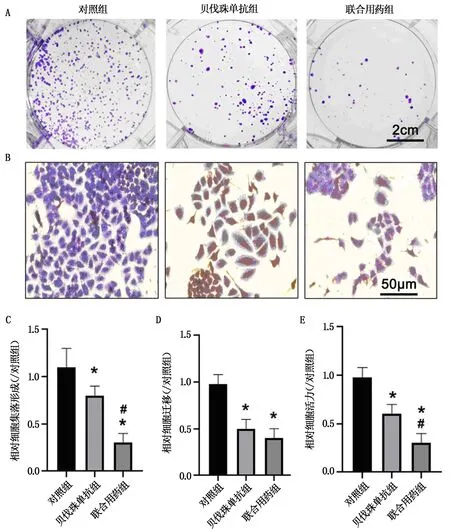
注:A為SKOV3細胞集落形成實驗結果;B為細胞侵襲實驗結果(400×);C為細胞集落形成實驗結果的統計分析;D為細胞侵襲實驗結果的統計分析;E為MTT實驗結果的統計分析。
2.3 貝伐珠單抗聯合化療藥物對SKOV3細胞凋亡的影響
與對照組相比,貝伐珠單抗組、聯合用藥組SKOV3細胞凋亡率增高(P<0.05)。與貝伐珠單抗組相比,聯合用藥組SKOV3細胞凋亡率明顯增高(P<0.05),見表3和圖3。結果提示,貝伐珠單抗聯合化療藥物能夠促進SKOV3細胞凋亡。
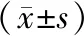
表3 貝伐珠單抗聯合化療藥物對SKOV3細胞凋亡的影響
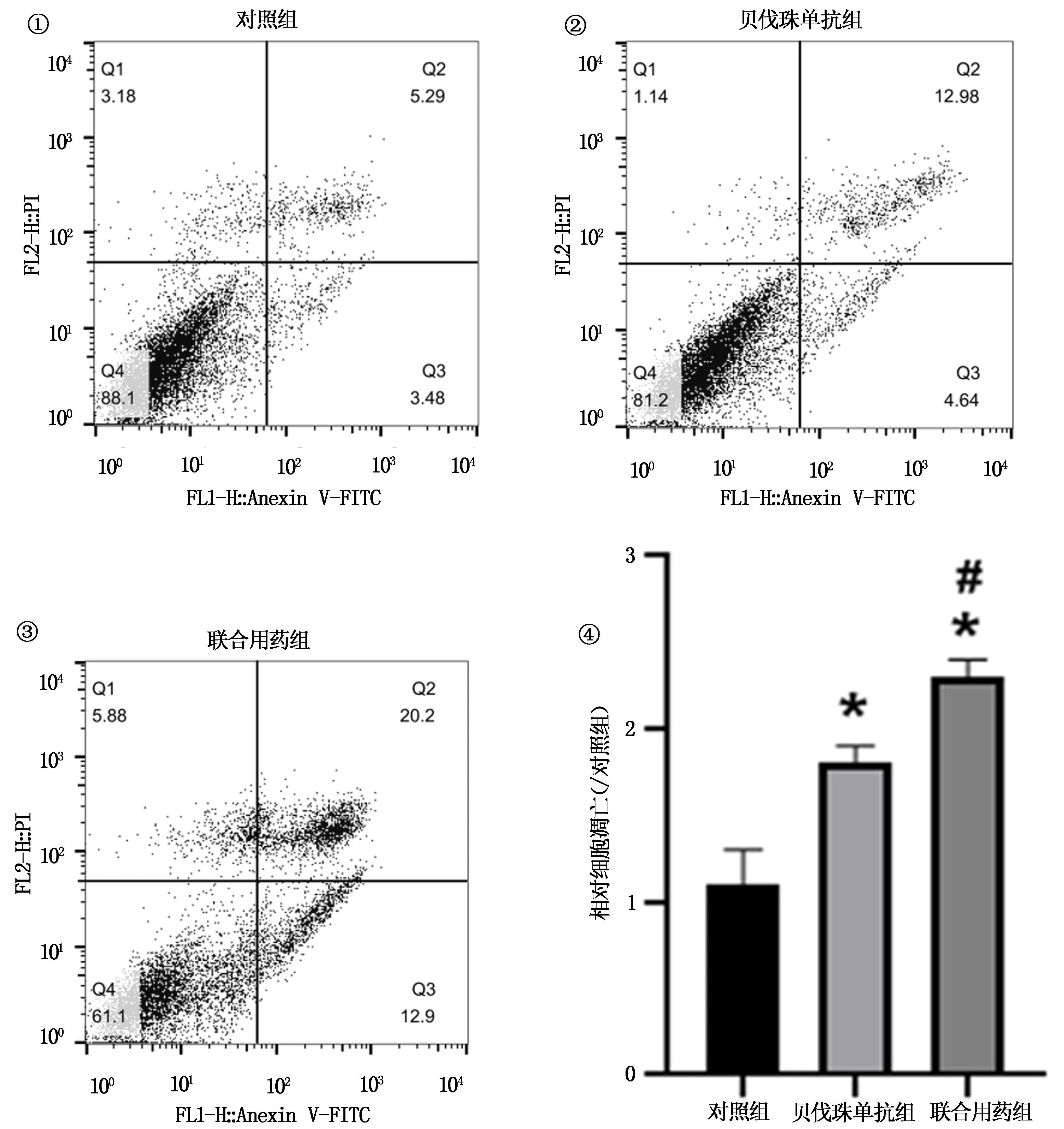
注:①②③為流式細胞術檢測SKOV3細胞凋亡結果圖像;④為細胞凋亡率的統計分析。
2.4 貝伐珠單抗聯合化療藥物對裸鼠移植腫瘤NF-κB/HIF-1α/VEGF通路的影響
往BALBc-Nude裸鼠體內植入SKOV3細胞5周后,與對照組相比,貝伐珠單抗組、聯合用藥組裸鼠移植腫瘤中VEGF/HIF-1α/NF-κB蛋白的表達水平下降(P<0.05)。與貝伐珠單抗組相比,聯合用藥組裸鼠移植腫瘤中VEGF/HIF-1α/NF-κB蛋白的表達水平明顯下降(P<0.05),見表4和圖4。結果提示,貝伐珠單抗聯合化療藥物對裸鼠移植腫瘤VEGF/HIF-1α/NF-κB通路具有抑制作用。
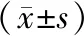
表4 腫瘤組織中NF-κB/HIF-1α/VEGF通路的相對表達水平
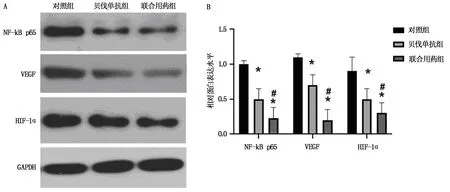
注:A為Western blotting分析NF-κB/HIF-1α/VEGF通路蛋白表達的結果;B為Western blotting實驗結果的統計分析。
2.5 貝伐珠單抗聯合化療藥物對裸鼠移植腫瘤的影響
往BALBc-Nude裸鼠體內植入SKOV3細胞5周后,與對照組比較,貝伐珠單抗組、聯合用藥組裸鼠移植腫瘤體積均縮小,差異均有統計學意義(P<0.05)。與貝伐珠單抗組相比,聯合用藥組裸鼠移植腫瘤體積明顯縮小(P<0.05)。此外,免疫組化結果顯示,與對照組比較,貝伐珠單抗組、聯合用藥組裸鼠移植腫瘤中Ki-67表達降低,凋亡相關蛋白Bax/Bcl-2的比值升高(P<0.05),與貝伐珠單抗組相比,聯合用藥組裸鼠移植腫瘤中Ki-67表達明顯降低,凋亡相關蛋白Bax/Bcl-2的比值升高(P<0.05),見圖5。結果提示,貝伐珠單抗聯合化療藥物能夠抑制裸鼠移植腫瘤的生長。
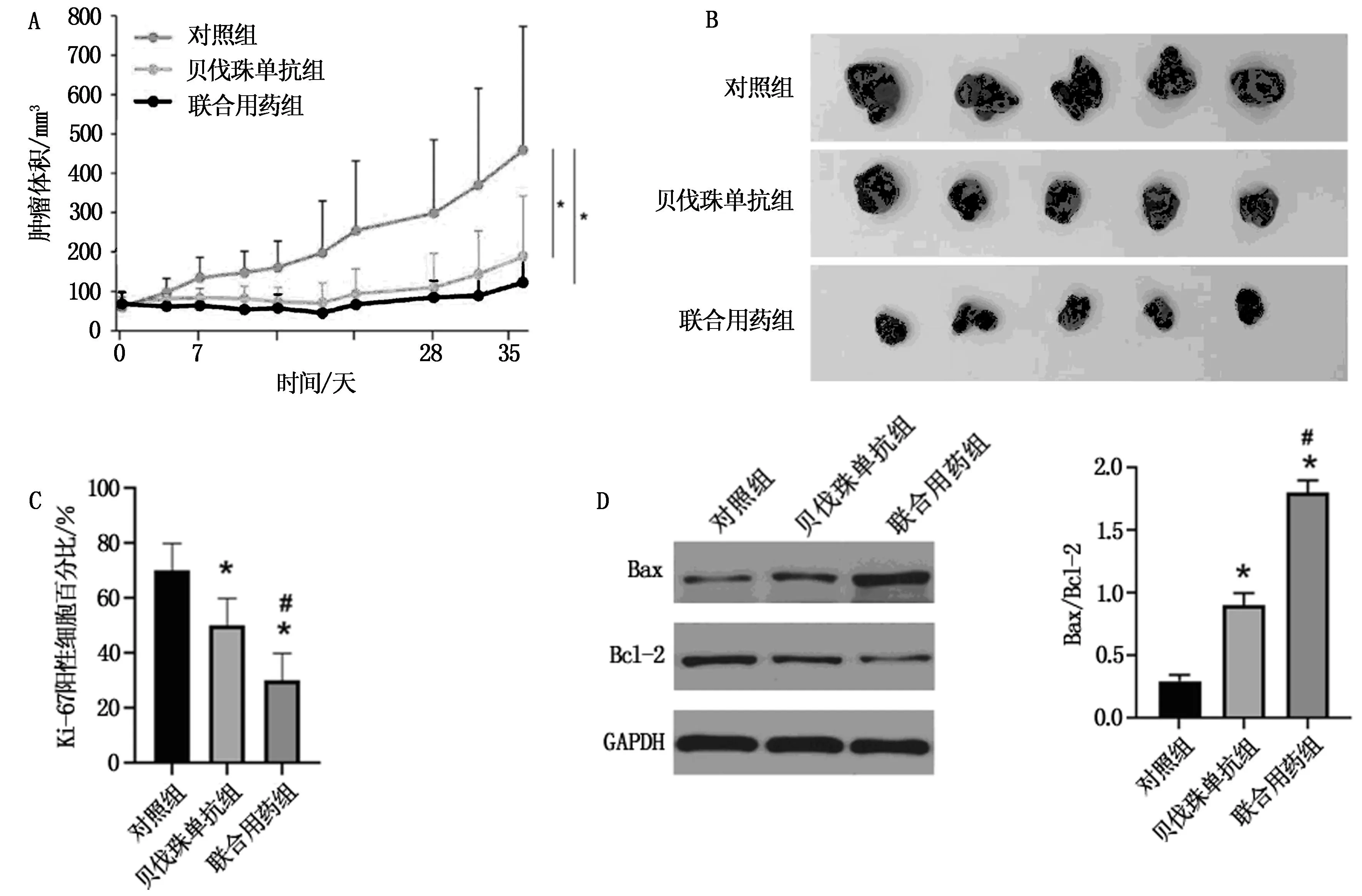
注:A為三組腫瘤生長曲線比較;B為三組腫瘤體積比較;C為Ki-67在各組織中的表達;D為Western blotting分析Bax和Bcl-2蛋白表達。
3 討論
上皮性卵巢癌是最常見的卵巢癌類型,由于70%的病例在Ⅲ期或Ⅳ期被診斷,因此預后較差,開發新的治療技術手段有利于提高卵巢癌患者總生存期[1]。卵巢癌的發病率和死亡率很高,部分原因是患者往往被診斷為晚期,嚴重影響了他們的生活質量。值得慶幸的是,貝伐珠單抗已被發現可以與VEGF進行結合,阻斷生物活性,減少腫瘤血管形成,抑制腫瘤生長[9]。
在本研究中,我們發現貝伐珠單抗以及聯合化療在體外和體內誘導卵巢癌細胞凋亡并降低細胞活力。另外,考慮到NF-κB/HIF-1α/VEGF通路在腫瘤發展中的促進作用,我們進一步研究了貝伐珠單抗以及聯合化療對卵巢癌細胞NF-κB、HIF-1α和VEGF表達的影響以及可能的分子機制,研究結果發現,貝伐珠單抗聯合化療抑制卵巢癌的作用可能與NF-κB/HIF-1α/VEGF通路相關。
HIF-1α作為癌細胞缺氧轉錄反應的主要調節因子,該因子上調一系列支持腫瘤細胞的基因,以補償缺氧微環境[13]。有研究檢測了37例接受光動力學療法(PDT)治療的早期食管癌中HIF-1α和HIF-2α的表達,他們發現HIF-1α的高表達與光動力學療法(PDT)的作用呈負相關。此外,他們對食管癌細胞作用的研究表明,缺氧誘導的HIF-1α過度表達通過血管生成減弱了PDT的療效[14]。VEGF是HIF-1α的下游靶基因,是最重要的血管生成蛋白之一。它與特定受體的結合可誘導靜脈內皮細胞的增殖和遷移,改善血管通透性,最終促進血管生成[15]。另外,有研究在乳腺癌小鼠中發現貝伐珠單抗介導的PDT誘導異二聚體HIF-1轉錄因子的HIF-1α亞單位表達,并增加VEGF蛋白水平[16]。Ding等在裸鼠顱內膠質母細胞瘤異種移植物上使用了抗VEGF的單克隆抗體,發現該抗體可以顯著增強PDT的作用[17]。所有這些研究表明,HIF-1α和VEGF的表達增加后可以誘導血管生成并減弱貝伐珠單抗療效。
NF-κB是一種調節各種細胞過程的關鍵轉錄因子,包括胚胎發育、免疫、凋亡、血管生成和增殖。在活化之前,NF-κB蛋白主要通過與IκB家族成員結合而局限于胞漿[18]。IκB激酶對IκB-的磷酸化觸發Iκ-B的降解,并允許NF-κB移位到細胞核[19]。既往研究發現,NF-κB過表達后增加了小鼠乳腺癌細胞的存活信號,并加劇了小鼠RAW 264.7巨噬細胞的炎癥反應[20]。這些結果表明,抑制NF-κB可改善腫瘤發展惡化。腫瘤組織中NF-κB的表達與HIF-1α的表達、VEGF的表達以及血管侵犯的存在顯著相關。NF-κB抑制劑,如BAY11-7028,也可以可以抑制HIF-1α和VEGF表達。此外,此外,姜黃素類似物在胰腺癌中的抗血管生成作用的研究表明,姜黃素類似品EF31和UBS109可以抑制NF-κB轉錄,在體內誘導HIF-1α和VEGF的下調。然而,HIF-1α沉默后,細胞的NF-κB p65沒有變化。因此,我們猜想貝伐珠單抗以及聯合化療通過NF-κB/HIF-1α/VEGF信號通路抑制卵巢癌的發展。在本研究中,考慮到NF-κB/HIF-1α/VEGF通路在腫瘤發展中的促進作用,通過貝伐珠單抗以及聯合化療藥物處理SKOV3細胞后,NF-κB p65蛋白表達被抑制,同時HIF-1α和VEGF的蛋白表達也受到抑制。另外,在裸鼠移植瘤的研究中發現,貝伐珠單抗以及聯合化療藥物處理后,移植瘤的NF-κB p65蛋白表達被抑制,同時HIF-1α和VEGF的蛋白表達也受到抑制,這一研究結果證實了我們前面的猜想,貝伐珠單抗聯合化療抑制卵巢癌的作用可能與NF-κB/HIF-1α/VEGF通路相關。
綜上所述,本研究發現,貝伐珠單抗聯合化療方案能夠抑制卵巢癌的體內外發展,該作用可能與抑制NF-κB/HIF-1α/VEGF信號通路相關。

