華蟾素通過調控M2型巨噬細胞極化抑制結直腸癌轉移
尚 靖,王 云,陳進寶,唐東豪,賈琳琳,李 煒,于宏杰
結直腸癌(colorectal cancer,CRC)是常見的消化道腫瘤,發病率在世界范圍內呈上升趨勢[1]。腫瘤轉移是CRC患者死亡的主要原因[2-3]。腫瘤相關巨噬細胞(tumor-associated macrophages,TAMs)是腫瘤微環境(tumor microenvironment,TME)的主要組成部分,通常表現為促腫瘤的M2樣表型,與腫瘤轉移密切相關[4-5]。華蟾素是干蟾皮提取物,目前廣泛應用于抗惡性腫瘤治療,對多種癌癥均有明顯的治療作用。研究[6]顯示華蟾素可以通過調節M2型TAMs的極化發揮抗腫瘤作用。因此,該研究旨在探索華蟾素能否通過調控M2型巨噬細胞極化進而發揮抑制結直腸癌轉移的作用。
1 材料與方法
1.1 主要試劑RPMI-1640培養基、雙抗(青霉素/鏈霉素)溶液和胰蛋白酶均購自美國Gibco公司;胎牛血清(fetal bovine serum,FBS)和佛波酯(phorbol myristate acetate,PMA)購自美國Sigma公司;CD11b-PE抗體和CD206-FITC抗體購自美國BD Pharmingen公司;RNA提取試劑盒、逆轉錄試劑盒和實時定量聚合酶鏈反應(real-time quantitative polymerase chain reaction,RT-qPCR)試劑盒購自揚州艾瑞克生物科技有限公司;白細胞介素-10(interleukin-10,IL-10)和轉化生長因子-β(transforming growth factor-β,TGF-β)酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)試劑盒均購自武漢博士德生物工程有限公司;華蟾素注射液(國藥準字Z34020273)購自淮北華潤金蟾藥業股份有限公司;CCK-8試劑盒購自東仁化學科技(上海)有限公司;BD Matrigel基質膠購自美國BD公司。
1.2 細胞培養RPMI-1640完全培養基(含10%FBS和1%雙抗)培養人結直腸癌細胞HCT116和人單核細胞白血病細胞THP-1,在含有5% CO2的37 ℃恒溫恒濕培養箱中培養。
1.3 條件培養基(conditioned medium,CM)將HCT116細胞培養基更換為無血清RPMI-1640培養基,48 h后獲得CMHCT116;用華蟾素處理HCT116細胞24 h后,更換為無血清RPMI-1640培養基,48 h后獲得CMHCT116+華蟾素;THP-1細胞用RPMI-1640完全培養基(含400 ng PMA)培養48 h獲得貼壁的M0細胞;用CMHCT116和CMHCT116+華蟾素分別處理M0細胞48 h后,獲得HCT116-Mφ細胞和(HCT116+華蟾素)-Mφ細胞;將培養基更換為無血清RPMI-1640培養基,48 h后分別獲得CMHCT116-Mφ和CM(HCT116+華蟾素)-Mφ;CM用0.22 μm濾器過濾,存放在-20 ℃冰箱備用。
1.4 流式細胞術M0細胞用不同CM(含10% FBS)培養48 h并收集,取1×106個細胞,加入CD11b-PE抗體和CD206-FITC抗體各10 μl,室溫避光孵育25 min后,用流式儀器檢測。
1.5 RT-qPCRM0細胞用不同CM(含10% FBS)培養48 h,提取細胞總RNA,逆轉錄獲得cDNA,通過RT-qPCR反應,以β-actin作為內參,用2-ΔΔCt法計算IL-10和TGF-β的相對表達水平,引物序列見表1。

表1 引物序列
1.6 ELISAM0細胞用不同CM(含10% FBS)培養48 h,收集CM,用ELISA試劑盒檢測IL-10和TGF-β水平。酶標板孔加100 μl樣品,37 ℃、90 min;加抗體,37 ℃、60 min;加親和素-過氧化物酶復合物,37 ℃、30 min;加顯色液,37 ℃、25 min;加終止液,在450 nm處測吸光度。
1.7 劃痕實驗HCT116細胞接種于12孔板(5×105個),待細胞匯合,用槍頭劃出直線,PBS清洗,加入CM,分別于0 h和24 h拍照,用ImageJ軟件分析實驗結果。
1.8 遷移實驗HCT116細胞接種于6孔板(4×105個),培養過夜,用CM(含10% FBS)培養48 h,收集細胞并用無血清RPMI-1640培養基重懸,上室加入2×104個細胞,下室加入700 μl含20% FBS的RPMI-1640培養基,48 h后進行固定、結晶紫染色、清洗和拍照,用ImageJ軟件分析實驗結果。
1.9 侵襲實驗預先用基質膠包被Transwell上室的底膜,并按照1.8的方法完成侵襲實驗。
1.10 CCK-8實驗HCT116細胞接種于96孔板(1.5×104個),培養過夜,用含不同濃度華蟾素的新鮮培養基刺激24 h后,每孔加入CCK-8溶液10 μl,孵育30 min后在450 nm處檢測吸光度值。

2 結果
2.1 HCT116細胞使M0細胞形態發生變化用THP-1細胞經過PMA刺激后獲得貼壁的M0細胞,M0細胞經過CMHCT116刺激48 h獲得HCT116-Mφ細胞,形態變為梭形貼壁細胞(圖1)。
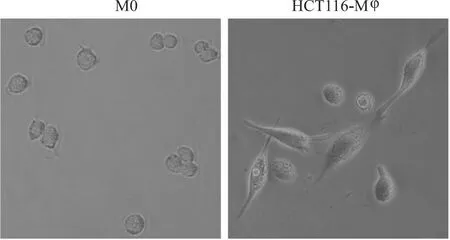
圖1 HCT116細胞使M0細胞形態發生變化 ×200
2.2 HCT116細胞促進M2型巨噬細胞極化為了觀察HCT116細胞對M2型巨噬細胞極化的影響,用CMHCT116刺激M0細胞48 h獲得HCT116-Mφ細胞,收集細胞進行流式實驗和RT-qPCR實驗,收集上清液進行ELISA實驗。流式實驗結果如圖2A所示,與M0相比,HCT116-Mφ細胞中CD11b+CD206+細胞(M2型巨噬細胞)比例明顯上升(t=14.85,P<0.001)。RT-qPCR實驗結果如圖2B所示,與M0相比,HCT116-Mφ細胞中M2型巨噬細胞的生物標志物IL-10和TGF-β的mRNA水平明顯升高(tIL-10=10.27,tTGF-β=8.694,P<0.001)。ELISA實驗(圖2C)也進一步驗證了該結果(tIL-10=7.072,tTGF-β=7.085,P<0.01)。以上結果表明HCT116細胞可以促進M2型巨噬細胞極化。

圖2 HCT116細胞促進M2型巨噬細胞極化
2.3 M2型巨噬細胞促進HCT116細胞轉移為了觀察M2型巨噬細胞對HCT116細胞轉移能力的影響,分別收集CMM0和CMHCT116-Mφ,刺激HCT116細胞后進行劃痕實驗和Transwell實驗。劃痕實驗結果如圖3A所示,與CMM0組相比,CMHCT116-Mφ處理的HCT116細胞的平均劃痕愈合率明顯升高(t=5.367,P<0.01)。Transwell遷移實驗(圖3B)也驗證了M2型巨噬細胞促進HCT116細胞遷移能力(t=9.871,P<0.001)。Transwell侵襲實驗結果如圖3C所示,與CMM0組相比,CMHCT116-Mφ處理的HCT116細胞發生侵襲的細胞數目明顯增多(t=8.557,P<0.01)。這些結果表明M2型巨噬細胞可以促進HCT116細胞轉移。

圖3 M2型巨噬細胞促進HCT116細胞轉移 ×100
2.4 華蟾素可以抑制M2型巨噬細胞極化為了研究華蟾素對M2型巨噬細胞極化的影響,選用非殺傷濃度 5 mg/ml(圖 4A)作為干預濃度。流式實驗結果如圖4B,與HCT116-Mφ細胞相比,(HCT116+華蟾素)-Mφ細胞中CD11b+CD206+細胞(M2型巨噬細胞)比例明顯下降(t=4.151,P<0.05)。RT-qPCR實驗結果如圖4C,與HCT116-Mφ細胞相比,(HCT116+華蟾素)-Mφ細胞中M2型巨噬細胞的生物標志物IL-10和TGF-β的mRNA水平明顯下降(tIL-10=11.88,tTGF-β=14.15,P<0.001)。ELISA實驗(圖4D)也具有同樣的趨勢(tIL-10=7.09,tTGF-β=5.567,P<0.01)。以上結果表明華蟾素可以抑制HCT116細胞介導的M2型巨噬細胞極化。

圖4 華蟾素可以抑制M2型巨噬細胞極化
2.5 華蟾素可以抑制M2型巨噬細胞介導的HCT116細胞轉移分別收集CMHCT116-Mφ和CM(HCT116+華蟾素)-Mφ,刺激HCT116細胞后進行劃痕實驗和Transwell實驗。劃痕實驗結果如圖5A所示,與CMHCT116-Mφ組相比,CM(HCT116+華蟾素)-Mφ處理的HCT116細胞的平均劃痕愈合率明顯下降(t=3.8,P<0.05)。Transwell遷移實驗(圖5B)亦有同樣趨勢(t=3.505,P<0.05)。Transwell侵襲實驗結果如圖5C所示,與CMHCT116-Mφ組相比,CM(HCT116+華蟾素)-Mφ處理的HCT116細胞發生侵襲的細胞數目明顯減少(t=3.540,P<0.05)。這些結果表明華蟾素可以抑制M2型巨噬細胞介導的HCT116細胞轉移。

圖5 華蟾素可以抑制M2型巨噬細胞介導的HCT116細胞轉移 ×100
3 討論
越來越多的證據[7]表明,TAMs作為TME中豐富且活躍的浸潤性炎癥細胞,不僅在CRC的生長和轉移中起著至關重要的作用,而且與患者的預后不良密切相關。TAMs可以極化為M1型巨噬細胞和M2型巨噬細胞,M1型巨噬細胞可以通過產生促炎細胞因子和激活腫瘤免疫反應發揮抗腫瘤作用,M2型巨噬細胞通過促進血管生成、產生免疫抑制效應、誘導乏氧TME、促進腫瘤細胞增殖和轉移發揮促腫瘤作用,而TAMs通常被腫瘤細胞誘導極化為M2型巨噬細胞。例如,Cai et al[8]研究發現,TAMs分泌的TGF-β一旦在與CRC細胞上的受體結合,就會激活Smads/Snail信號通路,促進CRC的上皮間充質轉化進程,從而促進轉移。不僅如此,TAMs還通過促進腫瘤細胞內滲進入血管、促進血液循環中的腫瘤細胞存活、促進腫瘤外滲遷移到血管外組織和參與轉移前生態位的形成等方式,促進腫瘤轉移和侵襲[9-10]。本研究用CMHCT116刺激M0巨噬細胞后,得到梭形的HCT116-Mφ細胞,流式細胞術檢測顯示HCT116-Mφ細胞中的CD11b+CD206+細胞比例明顯增多,PCR和ELISA實驗顯示HCT116-Mφ細胞中IL-10和TGF-β的水平明顯升高,表明HCT116細胞能促進M2型巨噬細胞極化。用CMM0和CMHCT116-Mφ刺激HCT116細胞后進行的劃痕實驗和Transwell實驗表明,M2型巨噬細胞能顯著提高HCT116細胞的轉移能力。
中醫藥作為治療CRC的有效手段之一,在改善手術、化療、放療、靶向治療和免疫治療引起的毒副作用的同時,可以通過抑制增殖、誘導凋亡、促進自噬、抑制血管生成等途徑發揮抗腫瘤作用,并延長患者的生存時間[11]。此外,中醫藥還能通過調節TME發揮抗腫瘤作用,例如調節TAMs的極化。華蟾素作為傳統中藥,已廣泛用于癌癥治療和基礎研究,包括CRC[12-14]。Wang et al[15]研究表明華蟾素在體外可以有效抑制結腸癌細胞增殖、遷移和侵襲,在體內可以有效抑制腫瘤轉移,其機制可能與抑制上皮間質轉化和抑制Wnt/β-catenin信號通路激活有關。本研究進一步探索了華蟾素是否通過調節M2型巨噬細胞極化來抑制轉移,通過流式細胞術、PCR和ELISA實驗表明華蟾素能明顯抑制M2型巨噬細胞極化。并通過劃痕和Transwell實驗表明,華蟾素可以抑制M2型巨噬細胞介導的HCT116細胞轉移。

