一鍋法高效合成氧雜卓并[2,3-c]吡唑類化合物
鄧俊豐,孫楓欽,何鑫星,牟清瀾,李詩媛,楊開川*
(1.成都大學 藥學院,四川 成都 610106; 2.四川大學 華西藥學院,四川 成都 610207)
含氧雜環化合物,尤其氧雜卓類化合物具有廣泛的生物活性,在抑制生長、抗病毒、抗抑郁以及抗真菌等領域都發揮著重要的作用[1-2]。如Radulanin A具有抑制植物生長活性,可以用于除草劑[3],而從紫金花Bauhinia saccocalyx根部分離出的化合物Bauhinoxepin A具有抗菌活性[4],Aranotin具有EGF受體拮抗劑活性[5](圖1)。另一方面,含吡唑結構單元的化合物通常具有抗炎、鎮痛、抗菌、抗驚厥、抗腫瘤以及農業驅蟲等活性[6-11],許多治療人類疾病的藥物分子中也含有吡唑核心結構[12-14]。
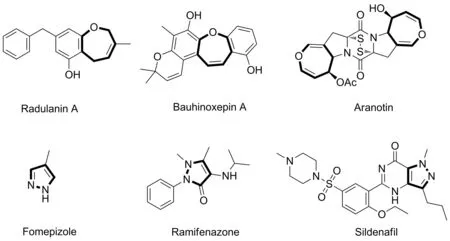
圖1 含氧雜卓環和吡唑結構單元的活性物質
基于新藥設計理念中將優勢藥物骨架多樣化組合的合成策略[15-16],把具有生物活性的多個砌塊拼接到同一分子中,密集其活性功能,拓展結構多樣性,發現更多高價值的藥物先導化合物,成為近年來藥物研究的熱點方向之一。因此,將氧雜卓環和吡唑環這2種優勢的活性骨架進行組合,合成一系列新型氧雜卓并吡唑稠環化合物,可以為后續的生物活性篩選提供更多的化合物源。對于該類化合物的合成,可以通過烯丙基硫葉立德與吡唑缺電子烯烴受體在堿的作用下[17]制備,但該方法需要先行制備烯丙基硫葉立德硫鹽,其極易吸水,保存周期短,不利于后續成環反應的使用以及操作,并且該硫鹽原料制備需要使用易制毒丙酮作溶劑[18],使得該路線的環境友好性大幅度降低,實際應用也會受到限制。因此,發掘更高效、更友好的合成方法尤為重要。
本文以吡唑類缺電子烯烴作為受體,在堿作用下,與二甲硫醚和4-溴丙烯酸酯通過具有步驟經濟性和操作簡便性的一鍋法[19-21]合成了系列氧雜卓并[2,3-c]吡唑類化合物,其結構經1H NMR、13C NMR和HR-MS(ESI-TOF)確證。對堿、溶劑以及物質的量之比等因素進行了考察,獲得了最優反應條件。
1 實驗部分
1.1 儀器與試劑
Büchi B-545型顯微熔點儀;Bruker-400型核磁共振儀(CDCl3為溶劑,TMS為內標);Bruker Q TOF型高分辨質譜儀。
實驗所用試劑和溶劑均為分析純。
1.2 3a~3u的合成
在15 mL試管中依次加入吡唑底物1a(52.5 mg,0.2 mmol,1.0 eq)、4-溴巴豆酸乙酯(58.0 mg,0.4 mmol,2.0 eq)、二甲硫醚(37.2 mg,0.6 mmol,3.0 eq)、碳酸鉀(41.5 mg,0.3 mmol,1.5 eq)和乙腈2.0 mL,室溫下攪拌過夜,TLC監測至反應完全。減壓蒸餾除去溶劑,殘余物經硅膠柱層析(洗脫劑:石油醚∶乙酸乙酯=40∶1~30∶1,V∶V)純化得到產物3a。
采用類似方法合成化合物3b~3u。
3a:白色粉末,收率86%,m.p.103~106 ℃;1H NMR(400 MHz,CDCl3)δ:7.69(d,J=8.8 Hz,2H),7.40(t,J=7.6 Hz,2H),7.32~7.18(m,7H),7.08(t,J=6.8 Hz,1H),5.32(s,1H),4.75(dd,J=13.6 Hz,7.2 Hz,1H),4.56(dd,J=13.6 Hz,6.4 Hz,1H),4.35~4.27(m,2H),2.18(s,3H),1.35(t,J=7.6 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.8,151.1,148.3,143.3,141.8,138.7,132.7,129.0,128.6,127.7,126.7,126.2,122.0,99.6,65.2,61.8,37.8,14.4,12.8; HR-MS(ESI-TOF)m/z:calculated for C23H22N2O3{[M+Na]+} 397.1523,found 397.1535。
3b:白色粉末,收率78%,m.p.111~113 ℃;1H NMR(400 MHz,CDCl3)δ:7.69(d,J=7.6 Hz,2H),7.44~7.37(m,2H),7.27~7.14(m,2H),7.12~6.99(m,4H),5.28(s,1H),4.77(dd,J=13.2 Hz,7.2 Hz,1H),4.55(dd,J=13.6 Hz,6.8 Hz,1H),4.36~4.26(m,2H),2.31(s,3H),2.18(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.7,151.0,148.3,143.2,141.9,138.7,138.2,132.6,128.9,128.4,128.1,127.5,126.1,124.6,121.9,99.5,65.2,61.8,37.6,21.7,14.3,12.8; HR-MS(ESI-TOF)m/z:calculated for C24H24N2O3{[M+Na]+} 411.1679,found 411.1684。
3c:白色粉末,收率81%,m.p.120~122 ℃;1H NMR(400 MHz,CDCl3)δ:7.68(d,J=7.6 Hz,2H),7.45~7.37(m,2H),7.32~7.17(m,5H),7.10(t,J=6.8 Hz,1H),5.27(s,1H),4.72(dd,J=13.6 Hz,6.8 Hz,1H),4.58(dd,J=13.6 Hz,6.8 Hz,1H),4.36~4.25(m,2H),2.18(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.5,151.0,148.0,145.3,140.7,138.5,134.5,133.2,129.8,128.9,127.6,126.9,126.2,125.7,121.9,99.3,65.3,61.9,37.6,14.3,12.7; HR-MS(ESI-TOF)m/z:calculated for C23H21ClN2O3{[M+Na]+}431.1133,found 431.1147。
3d:白色粉末,收率77%,m.p.138~141 ℃;1H NMR(400 MHz,CDCl3)δ:7.69(d,J=7.6 Hz,2H),7.47~7.31(m,4H),7.28~7.21(m,2H),7.15(t,J=8.0 Hz,1H),7.09(t,J=6.8 Hz,1H),5.27(s,1H),4.71(dd,J=13.6 Hz,7.2 Hz,1H),4.58(dd,J=14.0 Hz,6.4 Hz,1H),4.35~4.25(m,2H),2.18(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.5,151.0,148.0,145.6,140.7,138.5,133.2,130.5,130.1,129.872,129.865,128.9,126.2,122.8,121.9,99.3,65.3,61.9,37.6,14.3,12.8; HR-MS(ESI-TOF)m/z:calculated for C23H21BrN2O3{[M+Na]+}475.0628,found 475.0649。
3e:白色粉末,收率78%,m.p.107~110 ℃;1H NMR(600 MHz,CDCl3)δ:7.68(d,J=7.2 Hz,2H),7.44~7.36(m,2H),7.26~7.17(m,2H),7.07(t,J=6.0 Hz,1H),6.92~6.86(m,2H),6.76~6.72(m,1H),5.29(s,1H),4.78(dd,J=13.2 Hz,7.2 Hz,1H),4.54(dd,J=13.2 Hz,6.8 Hz,1H),4.35~4.26(m,2H),3.76(s,3H),2.19(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(150 MHz,CDCl3)δ:166.7,159.8,151.1,148.2,144.9,141.7,138.6,132.7,129.5,128.9,126.1,122.0,120.0,114.0,111.4,99.4,66.1,61.8,55.3,37.6,14.3,12.7; HR-MS(ESI-TOF)m/z:calculated for C24H24N2O4{[M+Na]+}427.1628,found 427.1643。
3f:白色粉末,收率82%,m.p.115~118 ℃;1H NMR(600 MHz,CDCl3)δ:7.68(d,J=7.2 Hz,2H),7.45~7.37(m,2H),7.28~7.17(m,3H),7.12~7.03(m,3H),5.28(s,1H),4.76(dd,J=13.6 Hz,7.2 Hz,1H),4.54(dd,J=13.2 Hz,6.8 Hz,1H),4.35~4.26(m,2H),2.30(s,3H),2.17(s,3H),1.34(t,J=7.2 Hz,3H);13C NMR(150 MHz,CDCl3)δ:166.8,151.1,148.2,141.9,140.3,138.7,136.3,132.6,129.3,128.9,127.4,126.1,121.9,99.7,65.2,61.7,37.4,21.1,14.3,12.8; HR-MS(ESI-TOF)m/z:calculated for C24H24N2O3{[M+Na]+} 411.1679,found 411.1691。
3g:白色粉末,收率79%,m.p.141~143 ℃;1H NMR(400 MHz,CDCl3)δ:7.68(d,J=8.0 Hz,2H),7.43~7.36(m,2H),7.27~7.19(m,3H),7.05(t,J=6.8 Hz,1H),6.85~6.79(m,2H),5.25(s,1H),4.76(dd,J=13.6 Hz,6.8 Hz,1H),4.55(dd,J=13.6 Hz,6.8 Hz,1H),4.35~4.26(m,2H),3.76(s,3H),2.17(s,3H),1.34(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.8,158.3,151.1,148.1,141.8,138.6,135.3,132.5,128.9,128.5,126.0,121.9,113.9,99.9,65.2,61.7,55.3,37.1,14.3,12.7; HR-MS(ESI-TOF)m/z:calculated for C24H24N2O4{[M+Na]+} 427.1628,found 427.1656。
3h:白色粉末,收率81%,m.p.107~109 ℃;1H NMR(600 MHz,CDCl3)δ:7.68(d,J=7.2 Hz,2H),7.40(t,J=7.6 Hz,2H),7.33~7.19(m,3H),7.07(t,J=6.0 Hz,1H),6.96(t,J=8.8 Hz,2H),5.27(s,1H),4.72(dd,J=13.6 Hz,6.8 Hz,1H),4.56(dd,J=13.6 Hz,6.8 Hz,1H),4.34~4.25(m,2H),2.17(s,3H),1.33(t,J=7.2 Hz,3H);13C NMR(150 MHz,CDCl3)δ:166.6,161.6(d,J=244.0 Hz,1C),151.0,147.9,141.0,138.9,138.5,132.9,128.9,126.1,121.8,115.4,115.2,99.8,65.2,61.7,37.2,14.2,12.7; HR-MS(ESI-TOF)m/z:calculated for C23H21FN2O3{[M+Na]+} 415.1428,found 415.1411。
3i:白色粉末,收率80%,m.p.124~127 ℃;1H NMR(600 MHz,CDCl3)δ:7.67(d,J=7.2 Hz,2H),7.47~7.36(m,2H),7.32~7.24(m,5H),7.08(t,J=6.0 Hz,1H),5.26(s,1H),4.71(dd,J=13.6 Hz,6.8 Hz,1H),4.58(dd,J=13.6 Hz,6.8 Hz,1H),4.35~4.26(m,2H),2.16(s,3H),1.34(t,J=7.2 Hz,3H);13C NMR(150 MHz,CDCl3)δ:166.6,151.1,148.0,141.8,141.0,138.5,133.1,132.6,129.0,128.9,128.7,126.3,122.0,99.6,66.4,61.9,37.5,14.3,12.8; HR-MS(ESI-TOF)m/z:calculated for C23H21ClN2O3{[M+Na]+}431.1133,found 431.1135。
3j:白色粉末,收率76%,m.p.112~115 ℃;1H NMR(600 MHz,CDCl3)δ:7.67(d,J=7.2 Hz,2H),7.44~7.37(m,4H),7.27~7.18(m,3H),7.08(t,J=7.2 Hz,1H),5.24(s,1H),4.70(dd,J=13.6 Hz,6.8 Hz,1H),4.57(dd,J=13.6 Hz,6.8 Hz,1H),4.36~4.25(m,2H),2.16(s,3H),1.34(t,J=7.2 Hz,3H);13C NMR(150 MHz,CDCl3)δ:166.6,151.0,148.0,142.3,140.8,138.5,133.1,131.6,129.3,128.9,126.3,121.9,120.8,99.5,65.3,61.8,37.5,14.1,12.7; HR-MS(ESI-TOF)m/z:calculated for C23H21BrN2O3{[M+Na]+}475.0628,found 475.0637。
3k:白色粉末,收率83%,m.p.109~111 ℃;1H NMR(400 MHz,CDCl3)δ:7.70(d,J=7.6 Hz,2H),7.45~7.37(m,2H),7.26~7.15(m,3H),6.91~6.82(m,2H),6.76(t,J=7.6 Hz,1H),5.38(s,1H),4.81(dd,J=12.8 Hz,7.2 Hz,1H),4.44(dd,J=13.2 Hz,6.8 Hz,1H),4.34~4.26(m,2H),3.79(s,3H),2.17(s,3H),1.36(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:167.2,156.3,151.4,148.2,143.4,138.7,131.5,129.4,128.95,128.90,128.1,126.0,121.9,120.4,110.7,98.3,64.5,61.3,55.1,33.9,14.5,12.6; HR-MS(ESI-TOF)m/z:calculated for C24H24N2O4{[M+Na]+}427.1628,found 427.1683。
3l:白色粉末,收率75%,m.p.96~99 ℃;1H NMR(400 MHz,CDCl3)δ:7.66(d,J=8.0 Hz,2H),7.52(d,J=7.6 Hz,2H),7.45~7.31(m,3H),7.29~7.10(m,3H),6.96(t,J=6.8 Hz,1H),5.56(s,1H),4.91(dd,J=15.6 Hz,6.8 Hz,1H),4.67(dd,J=15.6 Hz,4.8 Hz,1H),4.26~4.18(m,2H),2.27(s,3H),1.29(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.7,150.9,147.6,141.0,138.4,138.2,133.4,133.0,130.4,130.1,129.0,128.2,127.0,126.3,122.0,102.8,66.8,61.7,36.4,14.2,13.3; HR-MS(ESI-TOF)m/z:calculated for C23H21ClN2O3{[M+Na]+}431.1133,found 431.1182。
3m:白色粉末,收率79%,m.p.127~129 ℃;1H NMR(400 MHz,CDCl3)δ:7.64(d,J=8.4 Hz,2H),7.49(d,J=8.0 Hz,1H),7.45~7.36(m,3H),7.26(t,J=7.2 Hz,1H),7.19~7.15(m,1H),7.02~6.97(m,1H),5.52(s,1H),4.90(dd,J=12.0 Hz,6.4 Hz,1H),4.71(dd,J=16.0 Hz,4.4 Hz,1H),4.26~4.18(m,2H),2.27(s,3H),1.29(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.5,150.9,147.4,139.8,138.3,137.0,134.3,133.6,133.2,131.3,129.7,129.0,127.5,126.5,122.0,103.4,67.2,61.8,36.1,14.3,13.4; HR-MS(ESI-TOF)m/z:calculated for C23H20Cl2N2O3{[M+Na]+}465.0743,found 465.0784。
3n:白色粉末,收率67%,m.p.105~107 ℃;1H NMR(400 MHz,CDCl3)δ:7.67(d,J=7.6 Hz,2H),7.42~7.35(m,2H),7.22(t,J=7.2 Hz,1H),7.16~7.08(m,2H),6.91~6.82(m,2H),5.48(s,1H),4.91(dd,J=12.8 Hz,6.8 Hz,1H),4.57(dd,J=12.8 Hz,7.2 Hz,1H),4.36~4.26(m,2H),2.12(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:167.0,151.0,147.9,147.3,141.3,138.5,133.1,128.8,126.7,126.1,124.6,124.3,121.9,99.4,64.8,61.7,33.9,14.2,12.7; HR-MS(ESI-TOF)m/z:calculated for C21H20N2O3S{[M+Na]+}403.1087,found 403.1001。
3o:白色粉末,收率84%,m.p.131~132 ℃;1H NMR(400 MHz,CDCl3)δ:8.43(d,J=8.4 Hz,1H),7.73(d,J=7.2 Hz,1H),7.75~7.62(m,4H),7.59~7.53(m,1H),7.51~7.46(m,1H),7.45~7.36(m,3H),7.29~7.23(m,1H),7.01~6.95(m,1H),5.99(s,1H),5.13(dd,J=14.4 Hz,6.4 Hz,1H),4.65(dd,J=14.8 Hz,5.2 Hz,1H),4.24~4.16(m,2H),2.15(s,3H),1.21(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:167.0,151.1,147.6,139.7,139.4,138.6,134.2,133.5,131.2,129.0,127.8,127.1,126.25,126.17,125.7,125.5,124.2,122.07,122.06,102.8,66.0,61.7,35.3,14.2,13.3; HR-MS(ESI-TOF)m/z:calculated for C27H24N2O3{[M+Na]+}447.1679,found 447.1634。
3p:白色粉末,收率86%,m.p.115~117 ℃;1H NMR(400 MHz,CDCl3)δ:7.82~7.65(m,6H),7.52~7.37(m,5H),7.28~7.21(m,1H),7.10(t,J=7.2 Hz,1H),5.48(s,1H),4.81(dd,J=13.6 Hz,7.2 Hz,1H),4.53(dd,J=13.6 Hz,6.8 Hz,1H),4.41~4.25(m,2H),2.21(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.8,151.2,148.3,141.5,140.7,138.7,133.3,133.0,132.3,128.9,128.4,127.9,127.6,126.3,126.1,126.0,125.9,125.8,121.9,99.4,65.1,61.8,37.9,14.3,12.8; HR-MS(ESI-TOF)m/z:calculated for C27H24N2O3{[M+Na]+}447.1679,found 447.1662。
3q:白色粉末,收率81%,m.p.106~109 ℃;1H NMR(400 MHz,CDCl3)δ:7.67(d,J=7.6 Hz,2H),7.44~7.37(m,2H),7.28~7.21(m,5H),7.07(t,J=6.8 Hz,1H),5.25(s,1H),4.71(dd,J=13.6 Hz,6.8 Hz,1H),4.57(dd,J=14.0 Hz,6.4 Hz,1H),3.84(s,3H),2.16(s,3H);13C NMR(100 MHz,CDCl3)δ:167.1,151.0,148.0,141.7,140.6,138.5,133.4,132.6,129.0,128.9,128.7,126.2,121.9,99.6,65.3,52.8,37.5,12.7; HR-MS(ESI-TOF)m/z:calculated for C22H19ClN2O3{[M+Na]+}417.0976,found 417.0931。
3r:白色粉末,收率84%,m.p.118~120 ℃;1H NMR(400 MHz,CDCl3)δ:7.68(d,J=8.0 Hz,2H),7.41(t,J=7.6 Hz,2H),7.28~7.24(m,5H),7.06(t,J=7.6 Hz,1H),5.26(s,1H),5.20~5.10(m,1H),4.70(dd,J=13.2 Hz,6.8 Hz,1H),4.57(dd,J=13.6 Hz,6.4 Hz,1H),2.16(s,3H),1.32(t,J=6.0 Hz,
6H);13C NMR(100 MHz,CDCl3)δ:167.1,151.1,148.0,141.8,141.3,138.5,132.8,132.5,128.95,128.91,128.7,126.2,121.9,99.5,69.5,65.3,37.4,21.96,21.90,12.7; HR-MS(ESI-TOF)m/z:calculated for C24H23ClN2O3{[M+Na]+}445.1289,found 445.1233。
3s:白色粉末,收率80%,m.p.113~116 ℃;1H NMR(400 MHz,CDCl3)δ:7.55(d,J=8.4 Hz,2H),7.36~7.26(m,5H),7.24~7.18(m,3H),7.08(t,J=7.2 Hz,1H),5.32(s,1H),4.74(dd,J=13.2 Hz,7.2 Hz,1H),4.55(dd,J=13.6 Hz,6.8 Hz,1H),4.36~4.26(m,2H),2.37(s,3H),2.18(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.8,151.0,147.9,143.4,141.7,136.2,136.0,132.85,129.5,128.6,127.5,126.7,122.1,99.5,65.2,61.8,37.8,21.1,14.4,12.8; HR-MS(ESI-TOF)m/z:calculated for C24H24N2O3{[M+Na]+}411.1679,found 411.1637。
3t:白色粉末,收率72%,m.p.107~109 ℃;1H NMR(400 MHz,CDCl3)δ:7.87(d,J=7.2 Hz,2H),7.50~7.40(m,3H),7.35~7.26(m,4H),7.10(t,J=6.8 Hz,1H),5.35(s,1H),4.77(dd,J=13.6 Hz,7.2 Hz,1H),4.57(dd,J=13.6 Hz,6.8 Hz,1H),4.38~4.25(m,2H),2.22(s,3H),1.34(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.7,150.0(d,J=289.5 Hz,1C),143.2,141.7,133.5,132.7,128.6,128.1,127.5,126.7,126.6,121.1,119.2,99.8,65.2,61.8,37.8,14.3,12.8; HR-MS(ESI-TOF)m/z:calculated for C23H21FN2O3{[M+Na]+}415.1428,found 415.1458。
3u:白色粉末,收率81%,m.p.129~131 ℃;1H NMR(400 MHz,CDCl3)δ:7.68~7.62(m,3H),7.37~7.17(m,6H),7.12~7.04(m,4H),5.32(s,1H),4.74(dd,J=13.6 Hz,7.2 Hz,1H),4.54(dd,J=13.6 Hz,7.2 Hz,1H),4.36~4.26(m,2H),2.17(s,3H),1.35(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.7,162.1,159.6,151.0,148.3,143.2,141.9,134.8,132.6,129.2,128.6,127.5,126.7,123.74,123.66,115.8,115.7,115.6,99.4,65.2,61.8,37.7,14.3,12.7; HR-MS(ESI-TOF)m/z:calculated for C27H24N2O3{[M+Na]+}447.1679,found 447.1684。
2 結果與討論
2.1 反應條件優化分析
以吡唑底物(1a)和4-溴巴豆酸乙酯(2a1)以及二甲硫醚(2a2)的一鍋法反應為模板反應,對合成氧雜卓并[2,3-c]吡唑類化合物的反應條件進行篩選,實驗結果如表1所示。

表1 反應條件的優化a
首先,在室溫下的乙腈溶劑體系中研究了化合物1a和化合物2a1以及化合物2a2在堿的作用下一鍋法反應的可行性。結果表明:室溫下以NaHCO3為堿,乙腈為溶劑時反應可以順利進行,以36%的收率得到氧雜卓并[2,3-c]吡唑類化合物3a(No.1)。再篩選無機堿和有機堿,結果表明:K2CO3作堿時反應效果最好(No.4,收率83%)。于是以K2CO3為堿,對溶劑進行進一步篩選,發現乙腈仍然是最優反應溶劑(No.7~11在同等條件下將乙腈變換成其它溶劑THF,DCM,DCE等,收率都較乙腈低)。再對參與反應的物質的量之比進行優化,發現增大2a的比率可以進一步提高反應的收率至86%(No.13)。因此,最后反應條件確定為:室溫下,以乙腈為溶劑,K2CO3作堿,參與反應的各物質的量之比為1.0∶2.0∶3.0∶1.5(No.13),反應過夜。
2.2 底物擴展分析
在最優反應條件下,本文對反應底物進行了擴展,實驗結果如圖2所示。實驗結果表明:吡唑底物1a和4-溴巴豆酸乙酯以及二甲硫醚在堿的作用下一鍋法反應都可以順利進行,吡唑Michael受體β位苯環上的取代基無論在鄰位、間位或對位都可以進行反應,取代基的電子屬性對反應沒有明顯影響,可以中等到較高收率得到一系列氧雜卓并[2,3-c]吡唑類化合物(3b~3m);而β位為其它芳香環如噻吩和萘環時,反應也可以順利進行(3n~3p);然后4-溴巴豆酸乙酯變為相應的甲酯或者異丙酯的時,對反應沒有明顯影響(3q~3r),最后改變吡唑環N連接苯環上的取代基或者換成萘環時,同樣能夠以中等到良好的收率(72%~81%)得到目標產物(3s~3u)。
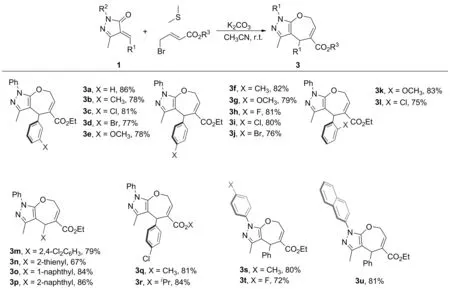
圖2 底物拓展
2.3 放大反應及衍生轉化分析
為了驗證該反應的實用性,本文將該反應放大到克級,反應能順利進行但是收率會降至61%(圖3),同時將產物進行了衍生轉化,利用鈀催化的偶聯反應得到了功能更密集的聯苯類化合物4,白色粉末,收率56%; m.p.123~126 ℃;1H NMR(400 MHz,CDCl3)δ:7.70(d,J=7.6 Hz,2H),7.58~7.48(m,4H),7.44~7.36(m,6H),7.32(t,J=7.2 Hz,1H),7.27~7.21(m,1H),7.11(t,J=6.8 Hz,1H),5.35(s,1H),4.80(dd,J=13.2 Hz,6.8 Hz,1H),4.58(dd,J=13.6 Hz,6.8 Hz,1H),4.39~4.26(m,2H),2.21(s,3H),1.36(t,J=7.2 Hz,3H);13C NMR(100 MHz,CDCl3)δ:166.8,151.2,148.3,142.3,141.6,140.8,139.6,138.7,132.9,129.0,128.9,127.9,127.3,127.1,126.2,123.7,122.0,99.7,66.3,61.8,37.6,14.4,12.8; HR-MS(ESI-TOF)m/z:calculated for C29H26N2O3{[M+Na]+}473.1836,found 473.1845。

圖3 克級反應和衍生轉化
2.4 反應機理的探討分析
根據產物的結構式以及相關文獻報道[22],本文提出了該反應可能的反應機理(圖4):二甲硫醚與4-溴巴豆酸酯反應生成烯丙基硫葉立德后,在K2CO3堿性作用下,生成烯丙基碳負離子AB共振式,然后與吡唑底物1a發生Michael加成反應生成中間體C,經過2步質子轉移生成中間體F,再經過分子內親核取代發生關環得到最終產物3a。

圖4 反應機理推測
3 結論
在無機堿K2CO3作用下,吡唑類缺電子烯烴、二甲硫醚以及4-溴丙烯酸酯通過具有步驟經濟性和操作簡便性的一鍋法發生[4+3]環合反應,合成了一系列氧雜卓并[2,3-c]吡唑類化合物3a~3u,收率67%~86%,其結構經1H NMR、13C NMR和HR-MS(ESI-TOF)確證,為后續生物活性篩選提供了候選化合物。

