雞血藤在大鼠體內(nèi)的排泄動力學(xué)研究△
楊秀偉,劉曉艷,徐嵬,張鵬,趙威,龔云,劉逆夫
1.北京大學(xué) 藥學(xué)院 天然藥物學(xué)系/天然藥物及仿生藥物國家重點實驗室,北京 100191;
2.株洲千金藥業(yè)股份有限公司,湖南 株洲 412000
在長期臨床實踐中,中醫(yī)形成了以口服為主的給藥方式防治疾病并延續(xù)至今。雞血藤(Spatholobi Caulis)為豆科植物密花豆Spatholobus suberectusDunn的干燥藤莖[1],始載于《本草綱目拾遺》,史謂“諸病要藥”[2]。其味苦、微甘,性溫,歸肝、腎經(jīng),具有行血補血、調(diào)經(jīng)、舒筋活絡(luò)之功效,主治月經(jīng)不調(diào)、痛經(jīng)、閉經(jīng)、風(fēng)濕痹痛、手足麻木、肢體癱瘓、血虛萎黃。口服雞血藤或其制劑后,要經(jīng)過吸收入血,隨后到達(dá)全身各器官組織,在體內(nèi)發(fā)揮作用后,以原型藥物或代謝產(chǎn)物的形式排出體外。雞血藤中含有黃酮[3-4]和非黃酮[4-5]類成分,不同化學(xué)結(jié)構(gòu)類型的化合物吸收不同[6-7],大鼠灌胃雞血藤水提取物后大部分吸收入血的化合物,特別是異黃酮類化合物,具有良好的藥動學(xué)行為[8]。但雞血藤為天然藥物,其生長情況及藥效物質(zhì)基礎(chǔ)的積累受環(huán)境因素影響較大,樣品批次不同,在物質(zhì)基礎(chǔ)含量上存在差異[9]。為闡明雞血藤的效應(yīng)物質(zhì),有必要從排泄物探究的角度逆向推論其在體內(nèi)的吸收、分布、代謝過程和性質(zhì)[10]。此外,鮮見文獻(xiàn)報道雞血藤在大鼠體內(nèi)的排泄研究。
本研究在雞血藤藥動學(xué)研究[8]的基礎(chǔ)上,用超快速液相色譜-質(zhì)譜法(UFLC-MS/MS)研究雞血藤水提取物灌胃給予大鼠,其內(nèi)含化合物在大鼠尿液和糞便中的排泄情況,為全面闡明雞血藤的體內(nèi)吸收、分布、代謝、排泄過程和作用(ADME/Act)提供參考。
1 材料
1.1 實驗動物
健康清潔級雄性SD 大鼠,體質(zhì)量200~220 g,由北京大學(xué)醫(yī)學(xué)部實驗動物科學(xué)部提供,使用許可證號:SYXK(京)2016-0041。在相對濕度為(60±5)%、室溫為(22±2)℃的條件下用普通飼料飼養(yǎng)3 d以適應(yīng)環(huán)境,期間給予晝夜交替12 h的節(jié)律性光照,實驗前大鼠禁食12 h,但正常飲水。本研究經(jīng)北京大學(xué)生物醫(yī)學(xué)倫理委員會批準(zhǔn),審批號為LA2021275。
1.2 藥材
雞血藤藥材產(chǎn)于云南省普洱市,經(jīng)北京大學(xué)藥學(xué)院楊秀偉教授鑒定為豆科植物密花豆Spatholobus suberectusDunn 的干燥藤莖,憑證標(biāo)本(標(biāo)本號:Y008-1608010)保存于北京大學(xué)藥學(xué)院天然藥物及仿生藥物全國重點實驗室和株洲千金藥業(yè)有限公司。
1.3 儀器與試藥
UFLC-MS/MS 8050 型液相色譜-質(zhì)譜儀 [包括Nexera X2 系列UFLC 系統(tǒng),配備SPD M30A 型光電二極管陣列(PDA)檢測器、LC-30AD 型二元泵、SIL-30AC 型自動進(jìn)樣器、CTO-20AC 型柱溫箱、電噴霧離子源(ESI)和LabSolution 工作站,日本島津公司];Kinetex?C18色譜柱(100 mm×2.1 mm,2.6 μm,美國Phenomenex 公司),帶有配套的Phenomenex p/n AJ0-9000 C18保護柱;3K15 型高速(冷凍)離心機(德國Sigma 公司);KQ5200 型超聲波清洗儀(昆山市超聲儀器有限公司,功率:250 W,頻率:40 kHz);CV200型真空離心濃縮儀(北京吉艾姆科技有限公司);XW-80A 型渦旋混勻器(江蘇省海門市其林貝爾儀器制造有限公司);AR4120 型萬分之一電子天平(奧豪斯國際貿(mào)易上海有限公司);XS105 型十萬分之一電子分析天平(瑞士Mettler-Toledo 公司);Millipore Milli-Q 型超純水儀(美國Millipore公司)。
對照品煙酸(nicotinic acid,1)、對羥基苯甲酸(p-hydroxybenzoic acid,2)、水楊酸(salicylic acid,3)、6,9-二羥基大柱香波龍-4,7-二烯-3-酮(6,9-dihydroxymegastigma-4,7-dien-3-one,4)、大豆苷(daidzin,5)、8,9-二羥基大柱香波龍-4,6-二烯-3-酮(8,9-dihydroxymegastigma-4,6-dien-3-one,6)、異落葉松脂素(isolariciresinol,7)、芒柄花素(formononetin,8)、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基異黃酮(4′,8-dimethoxy-7-O-β-Dglucosylisoflavone,9)、(+)-松脂酚[(+)-pinoresinol,10]、(+)-表松脂酚[(+)-epipinoresinol,11]、8-甲雷杜 辛(8-O-methylretusin,12)、芒柄花素鈉(formononetin sodium,13)、3′-甲氧基大豆素(3′-methoxydaidzein,14)、雞血藤黃醇A(spasuberol A,15)、毛蕊異黃酮(calycosin,16)、艷紫鉚素A(butesuperin A,17)、奧刀拉亭(odoratin,18)、鷹嘴豆芽素A(biochanin A,19)和 (6aR,11aR)-高麗槐素 [(6aR,11aR)-maackiain,20] 均由本課題組從雞血藤中分離制備純化而得[3-5],化學(xué)結(jié)構(gòu)經(jīng)質(zhì)譜和核磁共振波譜確定,高效液相色譜法(HPLC)和液相色譜-質(zhì)譜法(LC-MS/MS)檢測純度均大于98%,化學(xué)結(jié)構(gòu)見圖1。

圖1 雞血藤中大鼠排泄研究對照品化合物1~20的化學(xué)結(jié)構(gòu)
β-葡萄糖醛酸苷酶(β-glucuronidase,批號:G0251)、硫酸酯酶(sulfatase,批 號:S9626)、HPLC 級乙酸銨均購于美國Sigma-Aldrich 公司;三水合乙酸鈉(北京偶合科技有限公司,批號:20191114);冰乙酸(北京化工廠);LC-MS 級甲醇和乙腈(美國Fisher 公司);內(nèi)標(biāo)卡馬西平(北京百靈威科技有限公司,批號:LLA0P07,純度:98%);實驗用超純水由Millipore Milli-Q 超純水儀制備。
2 方法
2.1 樣品的制備
稱取干燥雞血藤藥材70 kg,加5 倍量水回流提取2次,每次2 h,合并提取液,減壓濃縮,75 ℃真空干燥7 h,得雞血藤干浸膏6 kg(收率為8.57%,相當(dāng)于11.67 g·g-1干浸膏,以生藥量計)。稱取適量的凍干粉,用0.9% 氯化鈉溶液配制得到0.35 g·mL-1提取物溶液,-4 ℃保存,備用。
2.2 對照品溶液配制
精密稱取20個對照品適量,加入LC-MS級甲醇配制成質(zhì)量濃度為1 mg·mL-1的儲備液。精密稱取內(nèi)標(biāo)化合物卡馬西平適量,加入甲醇配制成質(zhì)量濃度為0.5 mg·mL-1的儲備液。精密量取各化合物的儲備液適量,配制成含所有對照品和內(nèi)標(biāo)卡馬西平的混合對照品溶液,逐級對倍稀釋,得到一系列不同質(zhì)量濃度的混合對照品溶液,4 ℃保存,備用。
2.3 動物分組與給藥
12 只大鼠隨機分成6 籠,每籠2 只,1 籠為對照組,另外5 籠為給藥組。給藥組大鼠按照30 g·kg-1劑量灌胃給藥,隨后立即置于代謝籠內(nèi),分別在給藥后的2、4、6、8、12、24、48 h 收集每組的糞便和尿液,并記錄質(zhì)量或體積,置于4 ℃冰箱保存,備用。
2.4 排泄動力學(xué)樣品的收集和處理
2.4.1 尿液樣品的處理 稱取適量三水合乙酸鈉,加入適量冰醋酸和去離子水,配成0.2 mol·L-1的乙酸鈉緩沖溶液(記為溶液A),稱取適量β-葡萄糖醛酸苷酶和硫酸酯酶,分別用適量溶液A 溶解,配成終濃度為100 U·mL-1的溶液B 和溶液C。量取大鼠尿液3 份,每份1000 μL,分別向其中加入溶液A、B 和C 1000 μL,適當(dāng)混勻,于37 ℃、60 r·min-1水浴振搖12 h,每個樣品加入內(nèi)標(biāo)溶液10 μL,混勻后加入3 倍體積的甲醇-乙腈(2∶1)混合溶液,渦旋2 min,超聲1 min,15 000×g離心10 min,轉(zhuǎn)移上清液,殘渣再加入3 倍體積的甲醇-乙腈混合液,重復(fù)操作1 次,合并上清液,在45 ℃、430×g條件下離心濃縮4 h 至干,殘渣加入甲醇200 μL 復(fù)溶,渦旋1 min,超聲溶解2 min,15 000×g離心10 min,取上清液4 μL進(jìn)樣分析。
2.4.2 糞便樣品的處理 取大鼠糞便適當(dāng)碾碎,每個樣品稱取200 mg 置于離心管中,加入內(nèi)標(biāo)溶液10 μL,再加入0.9%氯化鈉溶液1000 μL 充分混勻,隨后加入3 倍體積的甲醇-乙腈(2∶1)混合溶液,渦旋2 min,超聲1 min,在15 000×g離心10 min,轉(zhuǎn)移上清液,殘渣再加入3 倍體積的甲醇-乙腈(2∶1)重復(fù)上述步驟1次,合并上清液,置離心濃縮儀中,在45 ℃、430×g條件下離心濃縮4 h 至干,殘渣加入甲醇200 μL 復(fù)溶,渦旋混勻1 min,超聲2 min,15 000×g離心10 min,取上清液4 μL 進(jìn)樣分析。
2.5 色譜與質(zhì)譜條件
2.5.1 色譜條件 Kinetex?C18色譜柱(100 mm×2.1 mm,2.6 μm);柱溫為30 ℃;流動相為0.5 mmol·L-1的乙酸銨水溶液(A)-乙腈(B),梯度洗脫(0~2.5 min,5.0%~7.5%B;2.5~3.0 min,7.5%~18.0%B;3.0~3.5 min,18.0%~26.0%B;3.5~10.0 min,26.0%~49.0%B;10.0~10.1 min,49.0%~52.0%B;10.1~11.2 min,52.0%~55.0%B;11.2~11.4 min,55.0%~95.0%B;11.4~14.4 min,95.0%B);自動進(jìn)樣器溫度為4 ℃;流速為0.35 mL·min-1;進(jìn)樣量為4 μL。
2.5.2 質(zhì)譜條件 ESI,掃描方式為多反應(yīng)監(jiān)測(MRM),分別對待測物進(jìn)行離子對優(yōu)化;霧化氣體為氮氣,霧化氣流速為3 L·min-1,加熱氣流速為10 L·min-1,干燥氣流速為10 L·min-1,接口加熱器溫度為300 ℃,脫溶劑管溫度為250 ℃,接口電壓為3.0 kV,檢測器電壓為1.80 kV。分析物和內(nèi)標(biāo)的檢測參數(shù):保留時間(tR)、先驅(qū)離子種、先驅(qū)離子、碎片離子、停留時間(DT)、四極桿1預(yù)桿偏壓(Q1)、碰撞能量(CE)和Q3參考文獻(xiàn)[8]。
2.5.3 方法學(xué)考察 根據(jù)美國食品藥品監(jiān)督管理局《Guidance for Industry Bioanalytical Method Validation》指導(dǎo)意見進(jìn)行UFLC-MS/MS 定量的方法學(xué)考察[11]。
2.5.3.1 專屬性 分別取空白尿液和糞便樣品、混合對照品溶液 [質(zhì)量控制(QC)樣品]、尿液和糞便的含藥樣品,按照2.4項下方法處理,按照2.5項下方法進(jìn)樣分析,考察樣品的內(nèi)源性成分和空白基質(zhì)是否會干擾雞血藤分析物和內(nèi)標(biāo)成分的定性和定量。
2.5.3.2 標(biāo)準(zhǔn)曲線、檢測下限(LLOD)和定量下限(LLOQ)取空白尿液和糞便,分別加入對倍稀釋的各化合物混合對照品溶液適量和內(nèi)標(biāo)溶液10 μL,按照2.4 項下方法對尿液和糞便分別進(jìn)行處理,制作各分析物的標(biāo)準(zhǔn)曲線。每個分析物的標(biāo)準(zhǔn)曲線至少設(shè)置6個質(zhì)量濃度點,按照2.5項下方法測定各分析物的峰面積,以質(zhì)量濃度為橫坐標(biāo)(X),以峰面積與內(nèi)標(biāo)峰面積比值為縱坐標(biāo)(Y)繪制標(biāo)準(zhǔn)曲線,得到線性回歸方程。將線性方程的最低質(zhì)量濃度點繼續(xù)逐級對倍稀釋,分別將信噪比(S/N)為3 ∶1 和10∶1 對應(yīng)的質(zhì)量濃度定為LLOD和LLOQ。每個樣品平行測定3次。
2.5.3.3 準(zhǔn)確度和精密度 用QC 樣品分別考察所建方法的日內(nèi)、日間精密度和準(zhǔn)確度。分別取空白尿液和糞便,定量加入各分析物的混合對照品儲備液和10 μL 內(nèi)標(biāo)溶液,配制成高、中、低和LLOQ 4個質(zhì)量濃度的QC 樣品溶液,每個質(zhì)量濃度平行制備6 份,按照尿液和糞便處理項下方法處理,按照2.5 項下方法檢測分析。用所建標(biāo)準(zhǔn)曲線計算各個樣品的質(zhì)量濃度,用6 份樣品的RSD為指標(biāo)評價方法的精密度,用計算質(zhì)量濃度和實際質(zhì)量濃度的比值為指標(biāo)評價方法的準(zhǔn)確度。各樣品1 d內(nèi)連續(xù)測定3 次,計算日內(nèi)精密度和準(zhǔn)確度;連續(xù)測定3 d,計算日間精密度和準(zhǔn)確度。精密度的RSD 不超過15%(LLOQ 的RSD 不超過20%)、準(zhǔn)確度為100%±15%(LLOQ的范圍為100%±20%)則方法可行。
2.5.3.4 穩(wěn)定性 用QC 樣品分別考察儲備液穩(wěn)定性、常溫穩(wěn)定性、循環(huán)凍融穩(wěn)定性和長期穩(wěn)定性,以驗證樣品在制備、處理和分析過程中采取的每步操作及使用的儲存條件不會影響分析物的質(zhì)量濃度。取空白尿液和糞便,分別向其中加入各分析物的混合對照品儲備液適量和內(nèi)標(biāo)溶液10 μL,配制成高、中、低3個質(zhì)量濃度的QC 樣品溶液,每個樣品平行制備3 份,按2.4 項下方法處理,按2.5 項下方法檢測分析,考察樣品的儲存穩(wěn)定性;將每個質(zhì)量濃度的QC樣品在室溫條件下密閉放置24 h,按照上述方法處理、進(jìn)樣分析后測定質(zhì)量濃度,考察常溫穩(wěn)定性;每個質(zhì)量濃度的QC 樣品在-20 ℃和室溫環(huán)境下反復(fù)凍融3次(-20 ℃存放時間為12 h),處理后進(jìn)樣分析,考察循環(huán)凍融穩(wěn)定性;QC樣品在-20 ℃條件下凍存30 d,處理后進(jìn)樣分析,測定質(zhì)量濃度,考察長期穩(wěn)定性。
2.5.3.5 回收率和基質(zhì)效應(yīng) 用QC 樣品考察回收率和基質(zhì)效應(yīng),以驗證尿液和糞便空白基質(zhì)中的某些干擾物質(zhì)或未被識別的成分是否會引起分析物響應(yīng)的變化。取各分析物的混合對照品溶液適量,配成高、中、低3個質(zhì)量濃度的QC 樣品溶液,每個質(zhì)量濃度平行6份,加入內(nèi)標(biāo)溶液10 μL、乙酸鈉緩沖溶 液1000 μL 和甲醇-乙腈(2∶1)混合溶劑4000 μL,按照2.4.1 項下方法進(jìn)行處理,按照2.5項下方法測定各分析物和內(nèi)標(biāo)的峰面積,標(biāo)記為A;取各分析物的混合對照品溶液適量,配成高、中、低3個質(zhì)量濃度的QC 樣品溶液,每個質(zhì)量濃度平行6 份,加入內(nèi)標(biāo)溶液10 μL、0.9% 氯化鈉溶液1000 μL 和甲醇-乙腈(2∶1)混合溶劑3000 μL,按照2.4.2項下方法進(jìn)行處理,按照2.5項下方法測定各分析物和內(nèi)標(biāo)的峰面積,標(biāo)記為B;取空白尿液和糞便,分別加入同A 和B 等量的各分析物的混合對照品儲備液,配制成高、中、低3 個質(zhì)量濃度的QC 樣品溶液,每個質(zhì)量濃度平行6 份,按照2.4項下方法處理,按照2.5 項下方法測定各分析物及內(nèi)標(biāo)的峰面積,將尿液和糞便的回收率考察樣品分別標(biāo)記為C 和D;另取空白尿液和糞便適量,分別加入同2.4 項下方法各自等量的乙酸鈉緩沖溶液、0.9%氯化鈉溶液和甲醇-乙腈(2∶1)混合溶劑,渦旋2 min、超聲1 min,在15 000×g條件下離心10 min,轉(zhuǎn)移上清液,殘渣再加入甲醇-乙腈(2∶1)混合溶劑重復(fù)1次,合并上清液,加入同A和B 等量的化合物儲備液和內(nèi)標(biāo)溶液10 μL 濃縮至干,其余步驟按照2.4 項下方法繼續(xù)處理,按照2.5項下方法測定分析物和內(nèi)標(biāo)的峰面積,將尿液和糞便的基質(zhì)考察樣品分別標(biāo)記為E 和F。以C/A 和D/B的比值分別評價尿液和糞便樣品的回收率,用E/A和F/B 的比值分別作為尿液和糞便樣品基質(zhì)效應(yīng)的評價指標(biāo)。
2.6 數(shù)據(jù)分析
用Microsoft Excel 2018 根據(jù)相關(guān)化合物的峰面積計算藥物的質(zhì)量濃度,將數(shù)據(jù)導(dǎo)入GraphPad Prism 7.0 繪制累積排泄率曲線圖,相關(guān)數(shù)據(jù)均用(±s)表示。
3 結(jié)果
3.1 方法學(xué)考察
3.1.1 專屬性 從大鼠的尿液和糞便空白樣品和灌胃雞血藤水提取物后的含藥樣品的MRM 總離子流圖可以看出(圖2、圖3),將尿液樣品的離子流圖放大相應(yīng)的倍數(shù)后,含藥藥品的色譜峰在相同保留時間的空白樣品上幾乎沒有對應(yīng)其他雜質(zhì)峰存在,說明尿液樣品在處理和分析過程中沒有其他內(nèi)源性或干擾性物質(zhì)影響。糞便樣品的總離子流圖色譜峰明顯,在相同的保留時間內(nèi),僅有個別峰在糞便的空白樣品中可見微弱的信號,但對樣品的定量分析不會造成明顯的影響,幾乎可以忽略不計。總體而言,樣品的制備過程符合定量分析要求,專屬性可靠。

圖2 大鼠尿液中20個雞血藤分析物的總離子流圖

圖3 大鼠糞便中20個雞血藤分析物的總離子流圖
3.1.2 標(biāo)準(zhǔn)曲線、LLOD 和LLOQ 從表1、表2可知,大鼠尿液和糞便中各個分析物標(biāo)準(zhǔn)曲線的r分別為0.999 1~0.999 8 和0.998 5~0.999 9,說明線性范圍良好,可用于樣品含量的計算。

表1 大鼠尿液中20個分析物的標(biāo)準(zhǔn)曲線、LLOD和LLOQ
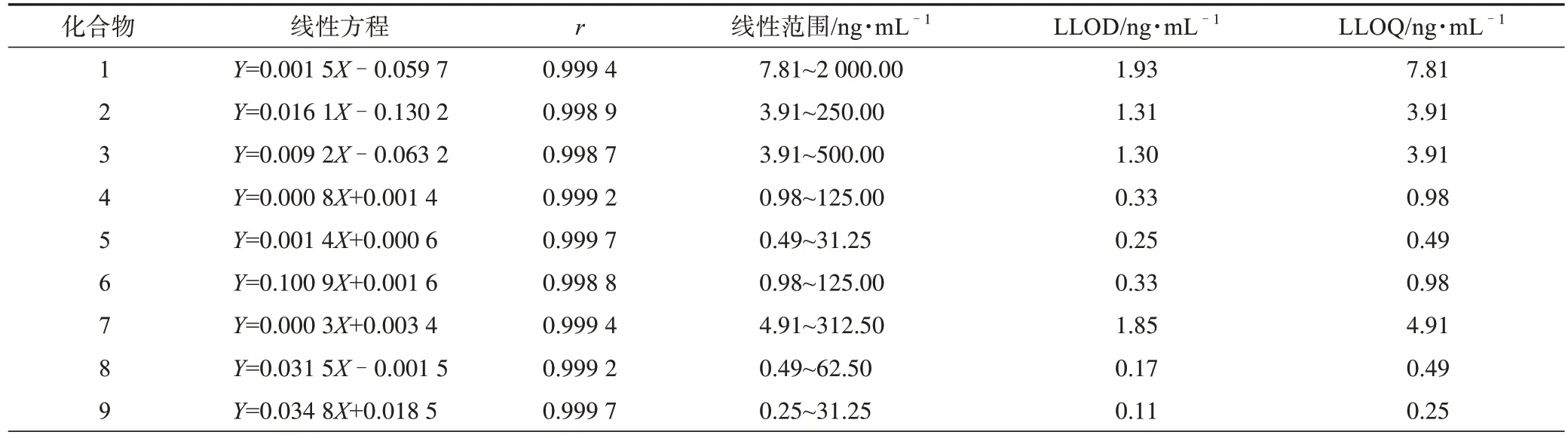
表2 大鼠糞便中20個分析物的標(biāo)準(zhǔn)曲線、LLOD和LLOQ
3.1.3 準(zhǔn)確度和精密度 表3、表4 顯示,大鼠尿液和糞便中雞血藤Q(mào)C 樣品的日內(nèi)、日間的準(zhǔn)確度和精密度,及其RSD 均在定量要求的范圍內(nèi),說明二者均符合要求。

表3 大鼠尿液中所檢測分析物的準(zhǔn)確度和精密度 %

表4 大鼠糞便中所檢測分析物的準(zhǔn)確度和精密度 %
3.1.4 穩(wěn)定性 將尿液和糞便中的樣品在不同條件下放置,考察樣品的穩(wěn)定性,結(jié)果見表5、表6。
表5 大鼠尿液中所測分析物在不同條件下的穩(wěn)定性(±s,n=3) %
續(xù)表5
表6 大鼠糞便中所測分析物在不同條件下的穩(wěn)定性(±s,n=3) %
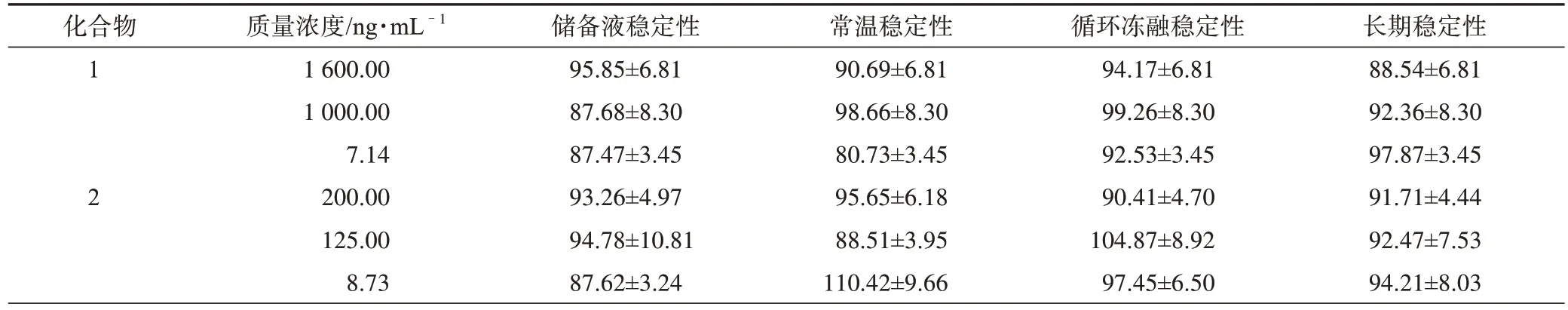
表6 大鼠糞便中所測分析物在不同條件下的穩(wěn)定性(±s,n=3) %
續(xù)表6

表6 大鼠糞便中所測分析物在不同條件下的穩(wěn)定性(±s,n=3) %
續(xù)表6

表6 大鼠糞便中所測分析物在不同條件下的穩(wěn)定性(±s,n=3) %
根據(jù)樣品測得的數(shù)據(jù)可知,尿液和糞便樣品中各分析物能夠在不同的條件下保持較好的穩(wěn)定性,幾乎不受儲存溫度、時間和處理步驟等因素的影響。
3.1.5 回收率和基質(zhì)效應(yīng) 根據(jù)表7、表8 中分析物的回收率和基質(zhì)效應(yīng)結(jié)果可知,尿液和糞便中的各個分析物回收率合格,基質(zhì)效應(yīng)不明顯,所建方法適合整體生物樣品的定量。
表7 大鼠尿液中所測分析物的回收率和基質(zhì)效應(yīng)(±s,n=6) %

表7 大鼠尿液中所測分析物的回收率和基質(zhì)效應(yīng)(±s,n=6) %
續(xù)表7
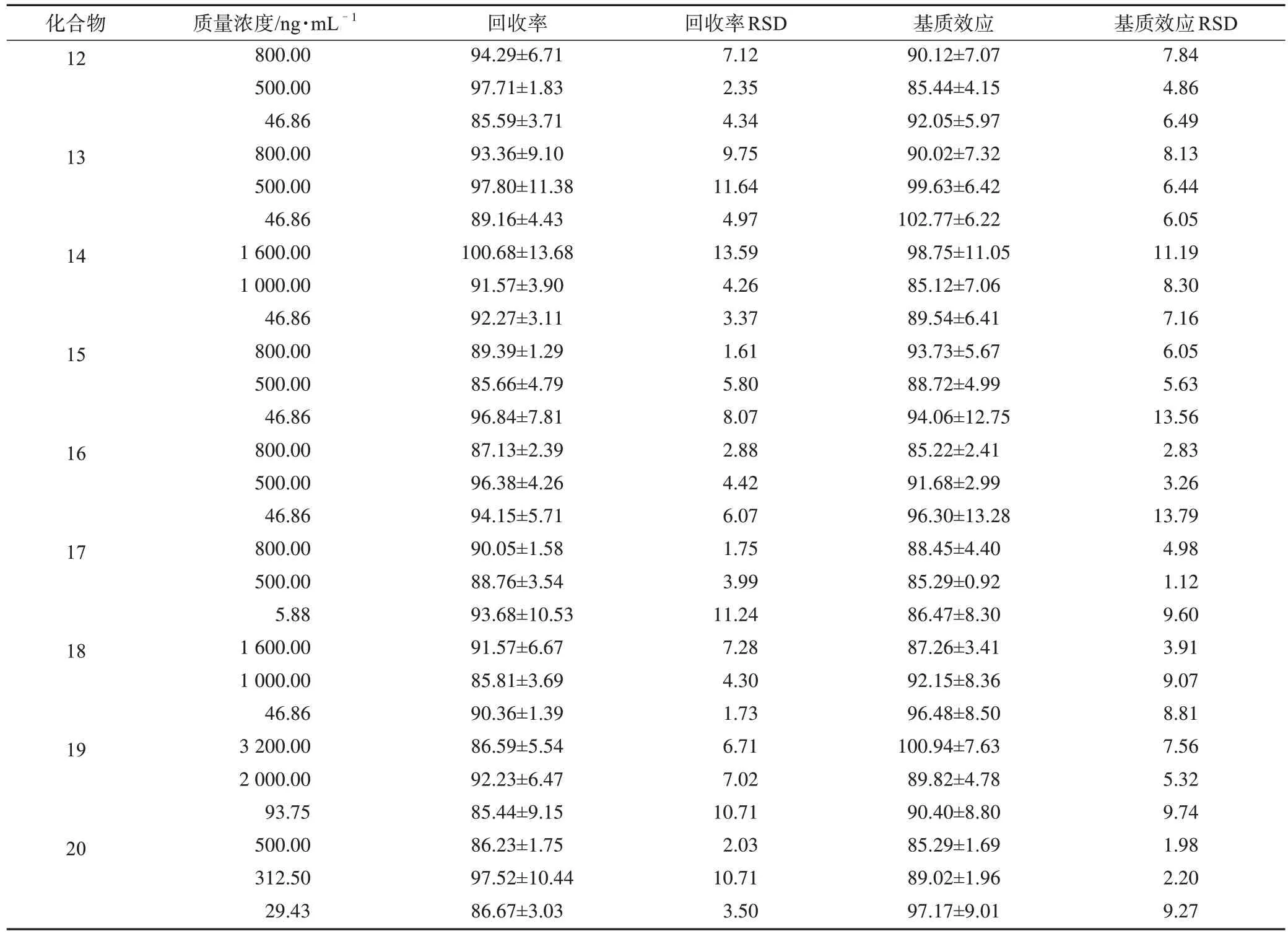
表7 大鼠尿液中所測分析物的回收率和基質(zhì)效應(yīng)(±s,n=6) %
表8 大鼠糞便中所測分析物的回收率和基質(zhì)效應(yīng)(±s,n=6) %
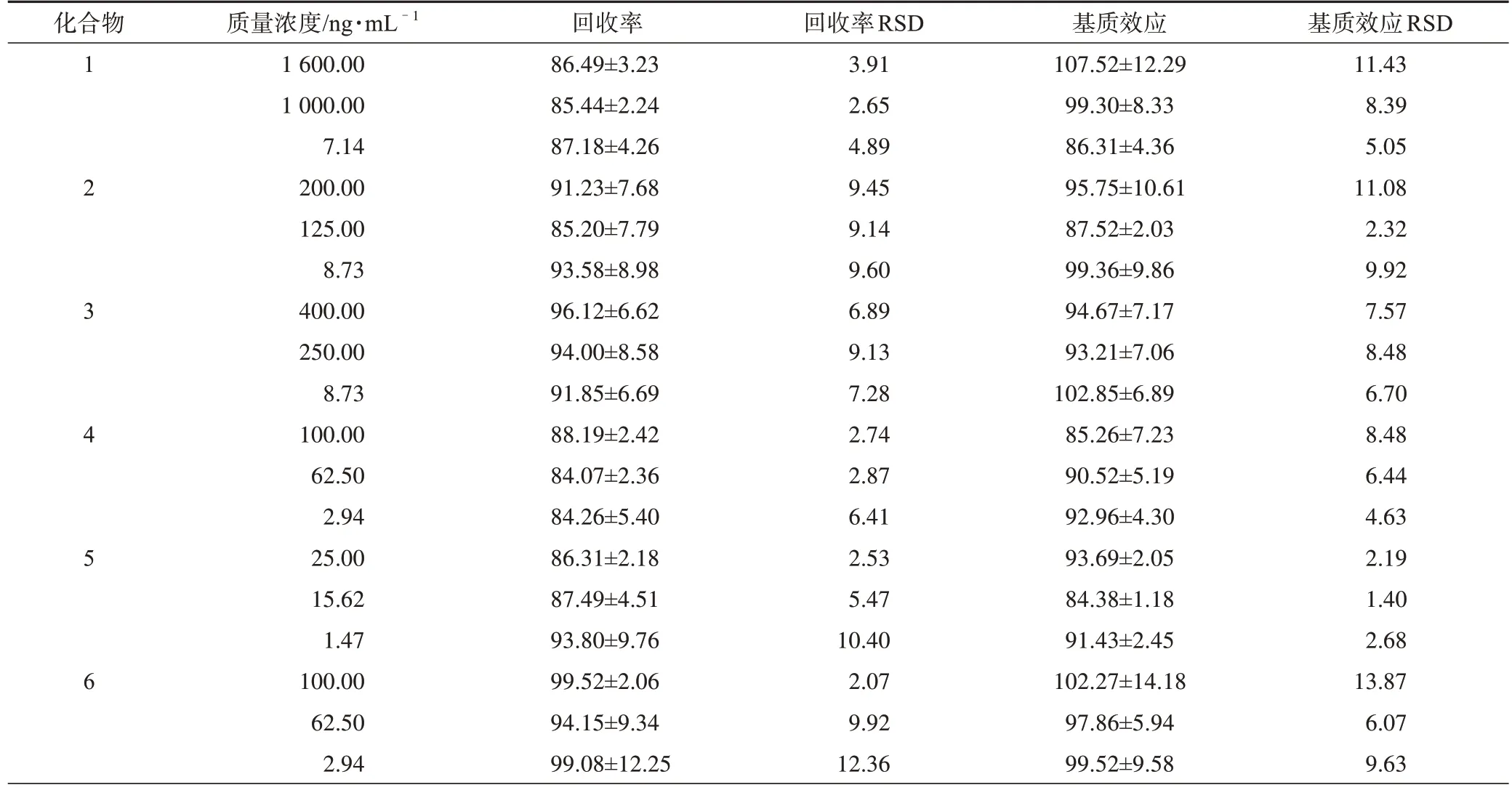
表8 大鼠糞便中所測分析物的回收率和基質(zhì)效應(yīng)(±s,n=6) %
續(xù)表8
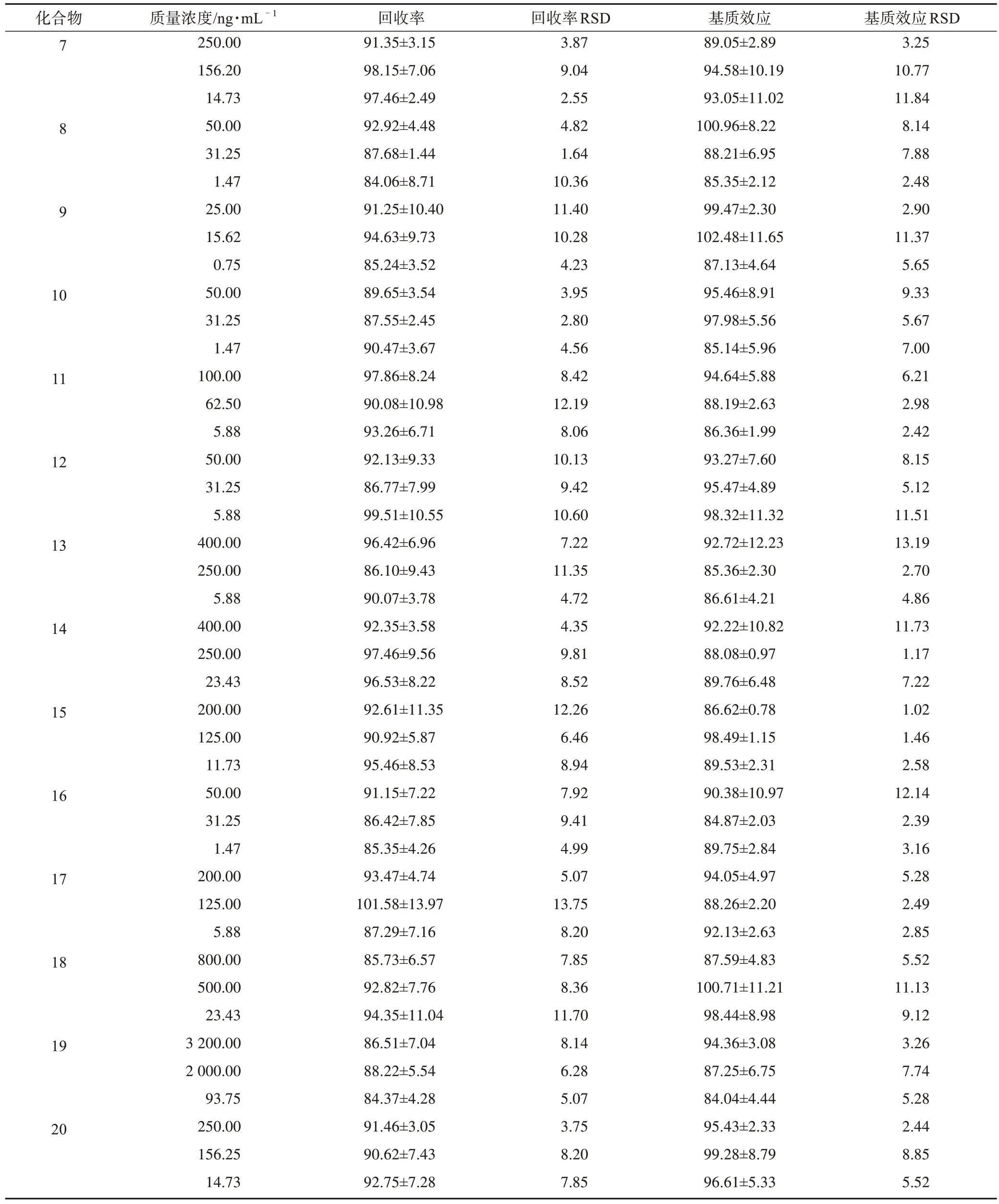
表8 大鼠糞便中所測分析物的回收率和基質(zhì)效應(yīng)(±s,n=6) %
3.1.6 原型化合物在尿液中的排泄 大鼠灌胃雞血藤水提取物后,從尿液中檢測到的20個原型化合物的累積排泄率見圖4。在48 h內(nèi),對羥基苯甲酸(2)和奧刀拉亭(18)的累積排泄率最高,達(dá)到50%及以上;水楊酸(3)、6,9-二羥基大柱香波龍-4,7-二烯-3-酮(4)、8,9-二羥基大柱香波龍-4,6-二烯-3-酮(6)、3′-甲氧基大豆素(14)、雞血藤黃醇A(15)和毛蕊異黃酮(16)的累積排泄率在30%左右,8-甲雷杜辛(12)和艷紫鉚素A(17)的累積排泄率在15%左右;芒柄花素(8)、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基異黃酮(9)和 (6aR,11aR)-高麗槐素(20)累積排泄率最少,在1%以下,其余化合物的排泄率為2%~10%。
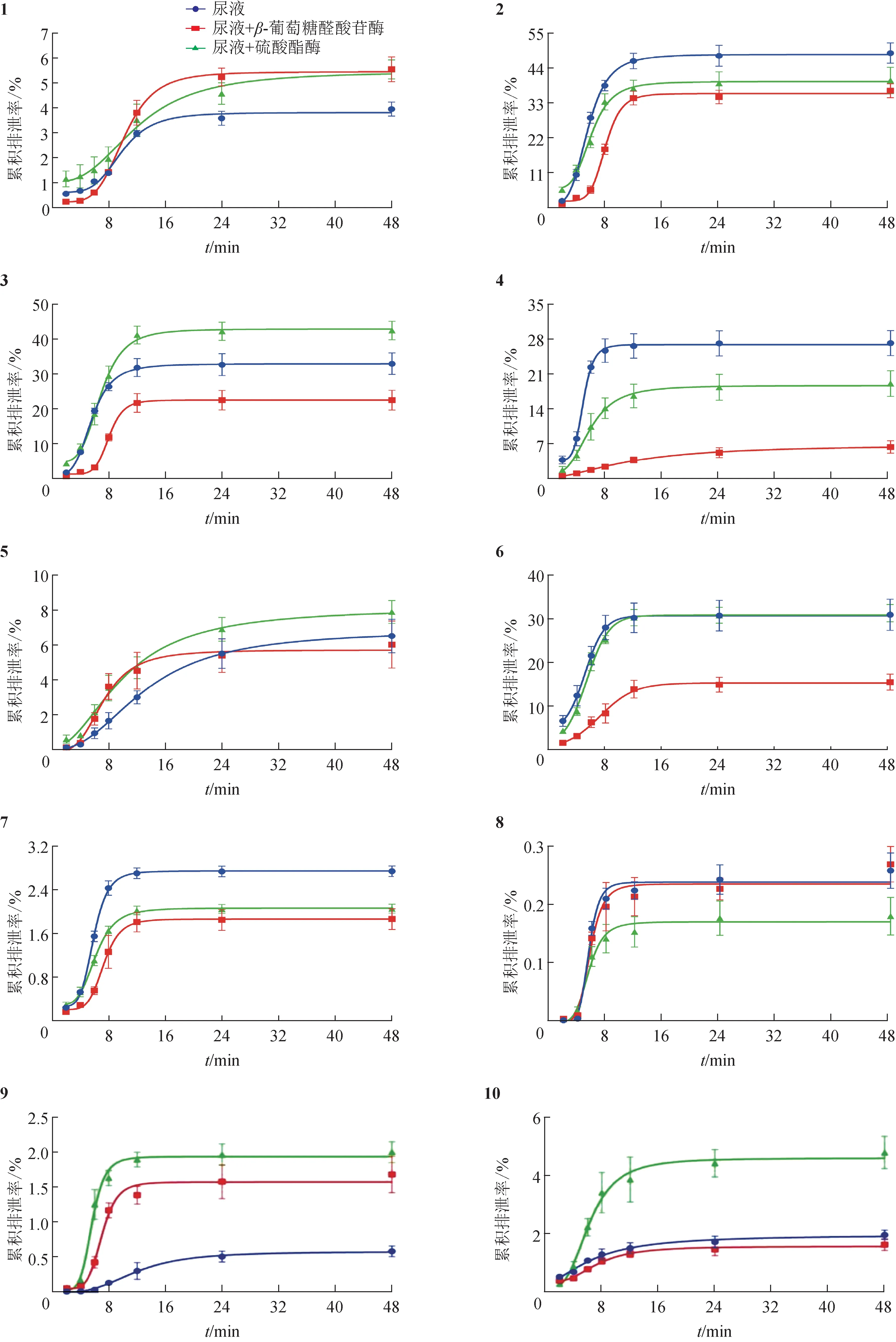
圖4 大鼠尿液中20個雞血藤分析物的累積排泄率(±s,n=3)
尿液樣品經(jīng)β-葡萄糖醛酸苷酶進(jìn)一步處理后,化合物1、9、11和20的累積排泄率明顯增加,推測這些化合物在體內(nèi)代謝過程中發(fā)生了葡萄糖醛酸結(jié)合反應(yīng),生成相應(yīng)水溶性更高的β-葡萄糖醛酸苷隨尿液排出體外,經(jīng)酶水解后原型藥物在體外的排泄率增加。化合物9 和11 經(jīng)酶處理后原型化合物的累積排泄率增加1倍及以上,說明這2個化合物在體內(nèi)的結(jié)合產(chǎn)物量比較高。加入β-葡萄糖醛酸苷酶后,化合物2~4、6、7 和17 的尿液累積排泄率出現(xiàn)不同程度的降低,推測這些化合物可能在加入酶之后在尿液中其他酶或生物活性物質(zhì)的作用下,原型化合物發(fā)生了不同形式的生物轉(zhuǎn)化,使得原型化合物的累積排泄率出現(xiàn)降低的情況。而化合物5、10、12~16、18 和19 的累積排泄率幾乎不受β-葡萄糖醛酸苷酶的影響,說明這些化合物在代謝過程中很少或沒有發(fā)生相應(yīng)的結(jié)合反應(yīng)。
尿液樣品經(jīng)硫酸酯酶處理后,化合物1、3、5、9~11、16、17、19 和20 的累積排泄率出現(xiàn)不同程度的增加,說明這些化合物在體內(nèi)代謝的過程中出現(xiàn)硫酸酯結(jié)合反應(yīng),生成相應(yīng)的硫酸酯隨尿液排出,在體外經(jīng)硫酸酯酶作用后,硫酸酯鍵發(fā)生斷裂釋放出原型化合物,表現(xiàn)出排泄率增加。化合物1、9、10 和20 經(jīng)硫酸酯酶作用后累積排泄率增加了1 倍及以上,說明這些化合物硫酸酯結(jié)合反應(yīng)的產(chǎn)物量比較高。同時,在尿液中加入酶之后,化合物2、4、7 和8 累積排泄率降低,推測這4 個化合物可能在尿液中經(jīng)酶或其他尿液成分的作用出現(xiàn)生物轉(zhuǎn)化現(xiàn)象,具體情況有待進(jìn)一步研究。化合物5、12~16、18 和19 在加入硫酸酯酶后的累積排泄率沒有發(fā)生明顯變化,說明這些化合物在代謝的過程中幾乎不涉及硫酸酯結(jié)合反應(yīng)。
總之,大鼠灌胃雞血藤水提取物后,所檢測到的20 個化合物幾乎都是從腎臟中隨尿液排出體外,從排泄速率來看,給藥6~8 h排泄速率最高,之后隨時間的延長排泄速率明顯降低,12 h 之后排泄速率幾乎不再增加。大多數(shù)化合物以原型藥物的形式排出,部分化合物會發(fā)生葡萄糖醛酸或硫酸酯結(jié)合反應(yīng),化合物1、9、11 和20 可以同時發(fā)生2 種形式的結(jié)合反應(yīng),生成水溶性更強的結(jié)合產(chǎn)物隨尿液排出體外。
3.1.7 原型化合物在糞便中的排泄 給大鼠灌胃雞血藤水提取物后,在糞便中檢測到的20 個原型化合物的累積排泄率如圖5 所示。水楊酸(3)、3′-甲氧基大豆素(14)和毛蕊異黃酮(15)的平均累積排泄率最高,為8%~12%(圖5C);煙酸(1)、8-甲雷杜辛(13)和奧刀拉亭(18)累積排泄率次之,為5%~7%(圖5A);6,9-二羥基大柱香波龍-4,7-二烯-3-酮(4)、大豆苷(5)、芒柄花素(6)、芒柄花苷(9)和4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基異黃酮(10)的累積排泄率在1%以下(圖5D、圖5E);化合物5 和9 累積排泄率低于0.1%,其他化合物為1%~3%。

圖5 大鼠糞便中20個雞血藤分析物的累積排泄率(±s,n=3)
從排泄速率來看,幾乎所有的化合物在給藥6~8 h 累積排泄速率變化最快,多數(shù)化合物在給藥12 h后排泄速率不再增加,累積排泄率逐漸達(dá)到穩(wěn)定狀態(tài)。而化合物14、15和20在給藥48 h依舊保持累積排泄率增加的趨勢。
以上結(jié)果表明,在糞便中檢測到的原型化合物的變化趨勢和在尿液中的變化趨勢幾乎一致,但糞便中的平均累積排泄率明顯小于尿液中相應(yīng)化合物的平均累積排泄率,說明雞血藤口服給藥后的大多數(shù)化合物的排泄途徑為腎排泄,此結(jié)果也與化合物快速廣泛地分布于各個組織臟器中的結(jié)果推測一致。
4 小結(jié)與討論
本研究在大鼠灌胃雞血藤水提取物后的尿液和糞便中分別檢測到了雞血藤中20 個原型化合物,按照原型成分在雞血藤生藥中的含量[9],折算成灌胃給藥的劑量,在給藥48 h,尿液中化合物的累積排泄率為0.13%~60.09%,糞便中化合物的累積排泄率為0.03%~11.38%,各化合物在尿液中的累積排泄率較高,說明大多數(shù)化合物的主要排泄途徑為腎排泄。
在經(jīng)尿液排泄的過程中,部分化合物在體內(nèi)會經(jīng)過葡萄糖醛酸苷或硫酸酯共價結(jié)合的形式,生成更易溶于水的結(jié)合產(chǎn)物排出體外。化合物煙酸(1)、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基異黃酮(9)、(+)-表松脂酚(11)和 (6aR,11aR)-高麗槐素(20)能同時發(fā)生2 種形式的結(jié)合反應(yīng)。這些藥物形成葡萄糖醛酸苷之后,水溶性增加,容易經(jīng)腎和膽汁排泄,經(jīng)膽汁排泄的部分進(jìn)入腸之后,又會經(jīng)腸內(nèi)細(xì)菌的作用轉(zhuǎn)化為原型藥物或代謝產(chǎn)物的形式被腸道重吸收形成腸肝循環(huán)。根據(jù)這4 種化合物的給藥劑量,結(jié)合化合物的血漿藥物代謝動力學(xué),以及在腸和肝臟中的組織分布情況(另文報道)可知,這4 個化合物存在不同程度的腸肝循環(huán)。煙酸(1)在糞便中的累積排泄率為6.5%,4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基異黃酮(9)、(+)-表松脂酚(11)和(6aR,11aR)-高麗槐素(20)分別為2.1%、2.5%和2.8%,與在糞便中所檢測到的其他化合物相比,累積排泄率處于中等水平,說明這些化合物大部分被吸收入血后進(jìn)入組織,發(fā)生葡萄糖醛酸結(jié)合反應(yīng)后經(jīng)膽汁排泄進(jìn)入腸,經(jīng)腸內(nèi)菌的生物轉(zhuǎn)化或代謝,還原為原型化合物被重吸收形成腸肝循環(huán),未被重吸收的部分原型化合物與灌胃給藥時未被吸收的部分則隨糞便排出體外。
8-甲雷杜辛(12)、3′-甲氧基大豆素(14)、雞血藤黃醇A(15)和奧刀拉亭(18)在尿液中幾乎不受葡萄糖醛酸苷酶和硫酸酯酶的影響,主要以原型化合物的形式經(jīng)腎排泄,在糞便中與其他化合物相比也有較高的累積排泄率。而大豆苷(5)、芒柄花素(8)、(+)-松脂酚(10)在給藥劑量比較高的情況下在尿液和糞便中的累積排泄率均比較低,結(jié)合這些化合物較低的血藥濃度和較低的組織分布量綜合分析,可能是這些化合物進(jìn)入胃腸道后被腸內(nèi)菌代謝或發(fā)生其他生物轉(zhuǎn)化,以代謝產(chǎn)物的形式吸收入血在組織器官中發(fā)揮作用。
值得注意的是,芒柄花素鈉在給藥劑量明顯低于芒柄花素的情況下尿液累積排泄率明顯高于后者,加之在糞便中沒有檢測到芒柄花素鈉的存在,說明其更容易被吸收入血;結(jié)合兩者的組織分布情況,芒柄花素鈉的組織分布更快速廣泛,同一時間點的含量也比芒柄花素的含量更高,說明芒柄花素鈉相比于芒柄花素更容易隨血液進(jìn)入機體各個組織器官,以原型藥物發(fā)揮作用后經(jīng)腎排泄。在人源腸Caco-2單層模型吸收實驗[7]中,兩者均屬于易于被腸道吸收的化合物,由于芒柄花素鈉的給藥劑量偏低,又容易吸收入血,在藥代動力學(xué)-時間變化過程中沒有出現(xiàn)表示腸肝循環(huán)的雙峰現(xiàn)象,所以在糞便中不容易檢測到原型化合物。芒柄花素可能在整體給藥的過程中,多種化合物相互作用限制了該化合物的吸收情況,以及口服進(jìn)入胃腸道之后被腸內(nèi)菌代謝,致使芒柄花素的組織分布量下降,累積排泄率降低。
芒柄花苷是芒柄花素結(jié)構(gòu)的7-位碳連接了1 個葡萄糖基形成的苷類,僅在糞便中檢測到了該化合物原型化合物,累積排泄率僅為0.02%,雖然給藥劑量比較高,由于血藥濃度比較低,僅在胃、小腸、肝和腦4 個組織中有分布,分布量也不高(另文發(fā)表),說明該化合物不容易被吸收入血,Caco-2單層模型吸收實驗也證實了這一現(xiàn)象;經(jīng)灌胃給藥后該原型化合物被腸內(nèi)菌代謝為其他代謝產(chǎn)物進(jìn)入血液發(fā)揮作用,致使其分布量和累積排泄率均比較低。
本研究運用UFLC-MS/MS,對雞血藤水提取物灌胃給藥大鼠之后的20 個化合物進(jìn)行了定性、定量檢測分析,所檢測的血漿中25 化合物有20 個在12~24 h 基本消除,個別化合物如對羥基苯甲酸、鷹嘴豆芽素A 的血藥濃度能持續(xù)到48 h。部分化合物如原兒茶酸、對羥基苯甲酸、奧刀拉亭、鷹嘴豆芽素A 和(6aR,11aR)-高麗槐素等存在雙峰現(xiàn)象[8],提示這些化合物的吸收過程中可能存在腸肝循環(huán),并且具有較長的半衰期和體內(nèi)生物利用度。在大鼠10 個組織檢測到的21 個分析物(另文報道)可知,大部分化合物能夠廣泛分布于各個組織,分布量最多的組織為胃、小腸、肝、腎和肺,部分化合物還能通過血腦或血睪屏障進(jìn)入腦和睪丸,在給藥0.5~1.0 h左右達(dá)峰后濃度逐漸下降。各個組織器官中的化合物發(fā)揮作用后隨血液循環(huán)到達(dá)排泄器官,以原型藥物或代謝產(chǎn)物的形式主要經(jīng)腎臟隨尿液排出,有些化合物如煙酸、4′,8-二甲氧基-7-O-β-D-吡喃葡萄糖基異黃酮等在代謝的過程中還會發(fā)生葡萄糖醛酸基或硫酸基結(jié)合,以更易溶于水的結(jié)合產(chǎn)物形式排出體外;部分化合物,以及存在腸肝循環(huán)和未被吸收的化合物會經(jīng)糞便排泄。總之,本研究對雞血藤的體內(nèi)過程進(jìn)行了研究與分析,在此基礎(chǔ)上將進(jìn)一步展開相關(guān)的藥效學(xué)研究,探討藥物到達(dá)相關(guān)的組織器官后發(fā)揮的藥效及藥物和靶器官之間的應(yīng)答機制,為深入研究雞血藤的藥理藥效和毒理提供了參考。
[利益沖突]本文不存在任何利益沖突。

