“茶葉對水中金屬離子的吸附”物理化學設計性實驗
王 慧,畢慧琴,顏 瑞,衛艷新
(1.合肥師范學院化學與化學工程學院,安徽合肥 230601;2.安徽工程大學化學與環境工程學院,安徽蕪湖 241000)
水是人類賴以生存和社會發展的自然資源,也是社會可持續發展的重要因素。隨著社會工業的不斷發展,水的重金屬污染越來越嚴重,重金屬容易通過食用水、糧食等途徑進入人體內部,對人體健康造成影響[1]。因此找到一些方法去除廢水中的重金屬尤為重要。近年來,各國學者都在積極研制價格低廉、高吸附性能的新型吸附劑,其中生物質材料在吸附方面的應用研究引起了人們的關注,其具有低成本、可再生、安全無毒、可重復利用、節能減排等特點,在處理重金屬方面占據了很重要的地位。茶葉是一種具有多孔結構的生物質材料,具有優異的空隙結構,使其可以與被吸附物質充分接觸,達到良好的吸附效果[2]。
傳統的物理化學驗證實驗一般難度較低,實驗內容單一,實驗成績考核方式較簡單,無法達到培養創新型人才的目的。物理化學設計性實驗的開展有助于學生在實驗設計的過程中培養創新能力和獨立思考能力。設計性實驗不只是簡單地重復一些基礎實驗,而是基礎實驗的提升,要求學生對于基礎實驗的內容學以致用。本次物理化學設計性實驗是在大三上學期開課,學生已經在分析化學實驗、儀器分析化學實驗、有機化學實驗和無機化學實驗中進行了大量的實驗基本技能操作訓練,擁有了一定的實驗基本技能,通過物理化學設計性實驗可以培養學生的科學研究能力。本實驗利用茶葉良好的吸附性能,研究影響茶葉吸附重金屬的初始濃度、吸附時間、pH、吸附溫度等因素,分析學習吸附能力及吸附動力學內容。
1 實驗目的
(1)了解吸附法的基本原理和主要應用領域,理解吸附量、飽和吸附量、等溫吸附方程。
(2)設計實驗方案,研究茶葉對金屬離子的吸附性能。
(3)設計水中金屬離子的定量分析方法。
2 實驗要求
(1)設計一種重金屬離子溶液的配制和含量測定方法。
(2)優化茶葉對重金屬離子的吸附條件,考查茶葉對重金屬離子的等溫吸附方程。
(3)處理實驗數據,歸納總結茶葉對重金屬離子的性能影響,提出吸附的最佳工藝條件。
3 實驗原理
吸附量按下式計算:
式中:Г—吸附量,mol/g;C0、C—吸附前后金屬離子濃度,mol/L;V—被吸溶液的體積,L;w—吸附劑茶葉的質量,g。
若為單分子層吸附,平衡吸附量與吸附平衡濃度之間符合Langmiur等溫吸附方程:
式中:Г—吸附量,mol/g;Г∞—飽和吸附量,mol/g;c—吸附平衡溶液濃度,mol/L;b—吸附系數,L/mol。
Fe3+的檢測方法:鄰二氮雜菲分光光度法測定Fe2+,測定之前需要先加鹽酸羥胺將Fe3+全部還原為Fe2+,其反應方程式為:
在pH=2~9 的條件下,Fe2+與鄰二氮雜菲生成穩定的橘紅色配合物[Fe(Phen)3]2+,該配合物的最大吸收峰在510 nm 處,摩爾吸光系數ε510=1.1×104L/(mol·cm)。測定時,控制溶液的酸度(pH=1左右),防止Fe2+水解,影響顯色。本實驗主要研究茶葉對水中Fe3+的吸附。
分光光度法在測定物質含量時,一般要經過取樣、顯色和測量等步驟。為了得到較高的靈敏度、選擇性和準確度,必須選擇適宜的顯色條件和吸光度測量條件。吸光度測量條件主要有測量波長、吸光度范圍和參比溶液等,該測定方法不僅靈敏度高,穩定性好,而且選擇性高。
茶葉中含有大量的吸附活性中心,如-OH、=NH、>C=C<、>C=O、二氮雜環及多元酚類等,這些基團在適宜條件下與金屬離子發生不同反應,即可將金屬離子吸附在茶葉上,并且多元酚類物質具有活性羥基,可使多種金屬離子沉淀,用甲醛處理后發生酚醛縮合,既提高了物理吸附能力,又增強了化學吸附能力[4]。
4 實驗試劑與儀器
4.1 實驗試劑
1 g/L 鄰二氮雜菲溶液,1 mol/L NaAc 溶液,2 mol/L HCl溶液,10 μg/mL鐵標液,100 g/L鹽酸羥胺溶液(用時現配),1 000 μg/mL Fe3+溶液。
4.2 實驗儀器
50 mL容量瓶若干,圓底燒瓶,紫外-可見光分光光度計,電子天平,1 000 mL 容量瓶若干,1 mL、2 mL、3 mL、10 mL吸量管若干,100 mL碘量瓶若干,燒杯,恒溫水浴鍋等。
5 實驗過程與結果討論
5.1 改性茶葉的制備
稱取10 g茶葉于圓底燒瓶中,依次加入50 mL 40%的甲醛溶液,200 mL 0.02 mol/L 的稀硫酸溶液,充分振蕩,60℃水浴加熱回流4 h,用水洗至中性,烘干,備用。
5.2 不同濃度Fe3+溶液的配制
分別從1 000 μg/mL 鐵貯備液的容量瓶中移取20 mL、40 mL、60 mL、80 mL、100 mL的鐵溶液加入到對應的1 000 mL 容量瓶中,調至pH=1 左右,定容搖勻得到對應的鐵溶液,即濃度為20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL的鐵溶液。
5.3 吸收曲線與標準曲線的繪制
取6 個容積為50 mL 的容量瓶,編號1~6,分別準確移取10 μg/mL 鐵標液0.0 mL、2.0 mL、4.0 mL、6.0 mL、10.0 mL于6個容量瓶中(其中不加鐵標液的所得為空白溶液,用來作參比溶液),然后向容量瓶中各加入1 mL 鹽酸羥胺溶液,搖勻靜置2 min,依次加入5 mL NaAc溶液和3 mL 鄰二氮雜菲溶液,加入蒸餾水定容放置10 min。以空白溶液作參比,用1 cm的比色皿,選擇4 號容量瓶(即濃度為1.2 μg/mL 的鐵標液)中的溶液,在430~560 nm 之間,每隔10 nm 測定一次吸光度(其中在490~530nm 之間每隔5 nm 測定一次),并記錄數據,找到最大吸收波長。從測試的數據可以看出最大吸收波長為510 nm,見圖1。
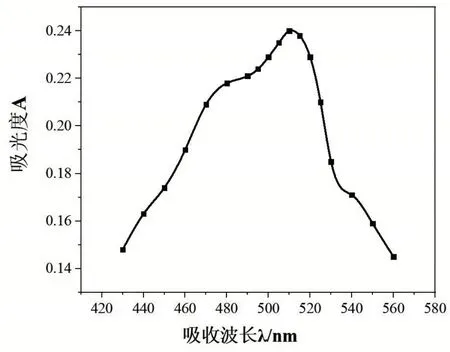
圖1 鐵標液的吸收波長與對應的吸光度
以空白溶液作參比溶液,用1 cm比色皿,在最大波長處分別測定2~6號容量瓶的溶液吸光度,記錄數據并繪制標準曲線,見圖2。
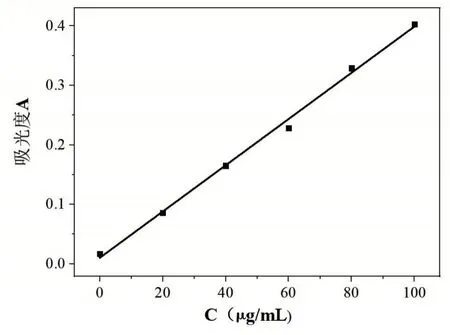
圖2 鐵標液標準曲線圖
從濃度為20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL 的五個鐵溶液容量瓶中分別移取1 mL溶液加入到50 mL 容量瓶中,編號7~11。向容量瓶中分別加入1 mL鹽酸羥胺溶液,搖勻靜置2 min之后依次加入5 mL NaAc 溶液和3 mL 鄰二氮雜菲溶液,加入蒸餾水定容搖勻放置10 min。以空白溶液作參比,用1 cm 比色皿,在最大吸收波長510 nm 處測定編號為7~11 的容量瓶中溶液的吸光度,記錄數據并對照吸收曲線,確定各濃度溶液的準確濃度,見表1。
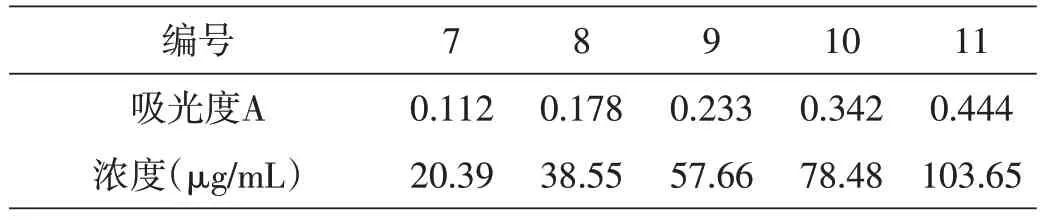
表1 各濃度鐵溶液的吸光度對應的濃度大小
5.4 吸附時間對吸附的影響
量取50 mL 初始濃度為60 μg/mL 的鐵溶液加入到碘量瓶中,加入約0.5 g(準確稱量并記錄)改性后的茶葉,在50℃水浴鍋中水浴加熱,從加入茶葉開始計時,每隔半個小時(30 min、60 min、90 min、120 min、150 min)從碘量瓶中吸取1 mL 的溶液轉移到50 mL 容量瓶中,按照時間順序容量瓶編號12~16,向容量瓶中分別加入1 mL 鹽酸羥胺溶液,搖勻靜置2 min 之后依次加入5 mL NaAc 溶液和3 mL 鄰二氮雜菲溶液,加入蒸餾水定容搖勻放置10 min。以空白溶液作參比,用1 cm 比色皿,在最大吸收波長510 nm 處測定編號為12~16 容量瓶中溶液的吸光度,并記錄數據,吸附時間對吸附的影響結果如圖3所示。
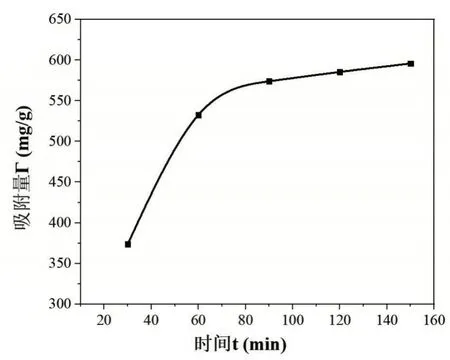
圖3 吸附時間對吸附的影響
由圖3 可知,在60 min 時吸附增長減慢,在此之前吸附量與時間呈直線上升關系,吸附量增長迅速,顯示出離子交換的特征。60 min 之后,增長較緩慢,吸附時間越長,曲線越趨于平緩。另外,由于茶葉中的茶氨酸、茶多酚和咖啡因以及酚類衍生物對重金屬有絡合作用,因此這個過程還包括Fe3+被快速絡合和吸附[4]。由此可以看出,最佳的吸附時間為60 min 左右。吸附時間小于60 min 時,吸附量隨時間變化增長較快,時間越短,吸附效果越差;吸附時間大于60 min時,吸附量隨時間增長變化不大,沒有實際意義。
5.5 初始濃度對吸附的影響
量取50 mL 不同初始濃度的鐵溶液(20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、100 μg/mL)加入到碘量瓶中,置于50℃的水浴鍋中預熱10 min,然后向碘量瓶中分別加入0.5 g(準確稱量并記錄)改性后的茶葉,加入茶葉后開始計時,吸附進行90 min后,分別從碘量瓶中移取1 mL溶液至50 mL容量瓶中,編號17~21。向容量瓶中分別加入1 mL鹽酸羥胺溶液,搖勻靜置2 min之后依次加入5 mL NaAc 溶液和3 mL 鄰二氮雜菲溶液,加入蒸餾水定容搖勻放置10 min。以空白溶液作參比,用1 cm 比色皿,在最大吸收波長510 nm 處測定編號為17~21的容量瓶中溶液的吸光度,結果見圖4。
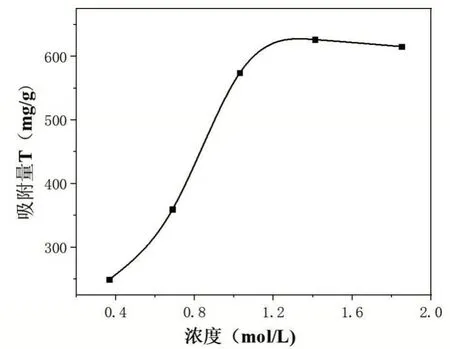
圖4 初始濃度對吸附的影響
由圖4可知,當初始濃度C0<1.20 mol/L時,隨著初始濃度C0的增加,吸附劑對Fe3+的吸附量逐漸增加,并且初始濃度C0與吸附量呈直線的增長趨勢。當初始濃度C0>1.20 mol/L 時,吸附量隨初始濃度的增長變化較小,增長緩慢,當初始濃度C0≈1.70 mol/L 時,達到吸附劑對Fe3+的最大吸附量,吸附達到飽和。之后隨著初始濃度C0的增加,吸附量呈現緩慢的減少趨勢。由此可以看出,實驗最佳的初始濃度在1.20~1.30 mol/L,小于最佳初始濃度達不到最好的吸附效果,大于該濃度隨初始濃度的增長吸附量增長較小,達不到理想效果。
5.6 吸附溫度對吸附的影響
量取50 mL 初始濃度為60 μg/mL 的鐵溶液加入到碘量瓶中,在不同溫度(30℃、50℃、70℃、90℃)的環境下進行吸附。在不同溫度(30℃、50℃、70℃、90℃)的水浴鍋中水浴預熱10 min,然后分別加入約0.5 g(準確稱量并記錄)改性后的茶葉,從加入茶葉開始計時,90 min后從4 個碘量瓶中分別吸取1 mL 的溶液轉移到50 mL 容量瓶中,容量瓶編號22~25,向容量瓶中分別加入1 mL鹽酸羥胺溶液,搖勻靜置2 min 之后依次加入5 mL NaAc溶液和3 mL鄰二氮雜菲溶液,加入蒸餾水定容搖勻放置10 min。以空白溶液作參比,用1 cm比色皿,在最大吸收波長510 nm處測定編號為22~25容量瓶中溶液的吸光度,并記錄數據,吸附溫度對吸附的影響如圖5所示。

圖5 吸附溫度對吸附的影響
由圖5可知,溫度較低時,吸附鍵的強度大,鍵能分布較寬,吸附活性點較多[5],因此吸附量較大。在T<50℃時,隨著溫度的升高,吸附劑對Fe3+的吸附量增加迅速;當溫度T>50℃時,隨著溫度的升高,吸附量會急劇減少,溫度過高會加速溶液中Fe3+的水解,不利于吸附劑對Fe3+的吸附。除此之外,溫度過高會使得吸附劑過度溶脹,破壞了表面吸附,使得吸附減弱[4]。由此可以看出,吸附溫度在48℃~53℃之間,吸附效果較好。
6 教學建議
在實驗設計之前,老師首先應給出實驗課題,講解一些設計性實驗的要點、實驗室具備的儀器和試劑條件等,對學生進行啟發引導,鼓勵學生先查閱相關文獻資料,將理論知識掌握理解透徹再設計方案。學生在實驗正式開展之前應提前上交自己設計的實驗方案,教師審查實驗方案的可行性和安全性,對于存在問題的設計方案,及時給出修改意見,讓學生對實驗有更深層次的理解,不斷優化自己的實驗方案。老師最終提交可行性方案和所需試劑及儀器設備清單給相關的實驗技術人員,提前準備相關儀器設備以確保實驗正常進行。
對于本設計性實驗的課時安排,實驗前安排1個課時給學生講解設計性實驗的要點、實驗室具備的儀器和試劑條件等,要求學生在課余時間完成設計性實驗預習報告內容的撰寫,并在實驗正式進行之前審核學生的實驗設計方案。實驗課程安排3~4個課時,學生需要獨立完成整個設計性實驗并記錄相關數據。在實驗探索過程中學生遇到問題,老師應及時引導學生分析問題,允許實驗失敗,但應給出盡可能詳細的分析說明。
對于本設計性實驗的成績評價,參考其他院校的經驗,結合學校實際情況,教師應從以下幾個方面對學生的設計性實驗做出評價:實驗方案是否簡潔,基本操作是否準確,實驗報告的條理性和表達能力,是否進行相關問題的分析與討論[6]。按照總評=實驗前設計性預習報告撰寫*0.3+實驗操作*0.4+實驗結果的分析及科技報告的撰寫*0.3,給予學生物理化學設計性實驗課程的成績評價。
7 結束語
從上述實驗結果可以得到,改性茶葉對Fe3+吸附時,最佳溶液pH在0.9~1.0之間;Fe3+初始濃度在1.20~1.30 mol/L 之間吸附量較大,吸附50 min 基本達到飽和,吸附溫度范圍為48℃~53℃有較大的吸附量。通過本實驗,學生可以鍛煉查閱文獻、收集和整理數據的能力。本實驗操作簡單,應用性強,實驗過程主要以學生為主,實驗綜合性較強,學生可以通過本實驗將之前學習的理論知識與實驗過程建立鏈接,深化學生對專業理論知識的理解與認知,激發學生學習物理化學實驗的積極性和主動性,培養學生的創造力和科研探究能力。

