模擬太陽光下驅動H2O2生成及含量測定的綜合實驗
劉浩,申屠寧,賴志楠,曾曉飛,朱喬虹
杭州師范大學材料與化學化工學院,杭州 311121
1 引言
隨著2020年中國“雙碳”政策[1]的出臺以及全球環保浪潮的興起,新能源的重要性和緊迫性在當前環境下愈發凸顯。太陽能取之不竭且環保無污染[2],使得其能成為推動可持續發展的重要力量。然而,目前在化學本科生的教育和實驗中,對太陽能的應用了解仍然有所欠缺。化學本科生對如何利用太陽能進行能源轉化的實驗技術和知識了解不足,這限制了學生對新能源利用和可持續發展概念的深入理解和創新思維開發。因此,為使得低碳可持續化學的概念深入人心,我們迫切需要加強對化學本科生在能源利用和轉換方面的教育和實踐教學,以培養出具備深入了解和創新太陽能技術的專業人才。
過氧化氫具有良好的氧化還原特性,且反應后幾乎不產生污染物,在有機化工[3]、外科手術[4]、生物醫學[5]、廢水處理[6]、儲能[7]等領域發揮著舉足輕重的作用。傳統工業生產過氧化氫的方法是蒽醌法,有能耗大、污染排放嚴重等缺點[8],不能充分滿足綠色化學發展的理念。而利用太陽能驅動產生過氧化氫的過程,依靠太陽能可為反應提供持續的能源來源,從而降低生產成本。其次,反應產物綠色環保,一定程度上解決了蒽醌法需要大量排放污染物的問題,減少環境壓力,有助于建立可持續的工業生產模式。從Web of Science的檢索結果可知(圖1),基于g-C3N4太陽能驅動H2O2合成[9]領域相關的研究逐年增多,2022年更是有4078篇相關工作被報道。

圖1 基于g-C3N4太陽能驅動H2O2合成領域論文發文數量統計
基于以上原因,我們設計了“模擬太陽光下驅動H2O2生成及含量測定的綜合實驗”。該實驗包括熱聚合法制備光催化劑、光催化劑的結構表征、光催化合成H2O2活性測試和H2O2含量測定。在正式開展實驗之前,鼓勵學生查閱文獻,了解熱聚合法制備g-C3N4和光催化生成H2O2的機理;實驗過程中,讓學生熟悉有氧環境的具體操作方法和紫外-可見光分光光度計的使用,全過程操作簡單且安全;實驗后,讓學生記錄分析測試結果、使用Origin進行建模,制作誤差棒,結合X射線衍射儀(XRD)、傅立葉變換紅外光譜(FTIR)、透射電子顯微鏡(TEM)綜合分析實驗結果,培養學生獨立思考、總結經驗的能力。在實驗內容的編排上,該實驗將無機化學、物理化學、分析化學等基礎化學知識與光催化等熱門前沿課題結合,拉近學生與化學前沿的距離,激發學生對科研的熱情,同時加深對綠色化學理念的理解,拓展學生思維,讓學生知道“光”也是重要的反應條件,滿足學生發展需求。本實驗總耗時約8 h,符合基礎教學實驗的要求。
2 實驗部分(以雙氰胺為例)
2.1 實驗原理
2.1.1 熱聚法制備g-C3N4形成機制
如圖2所示,當溫度上升至60–300 °C,雙氰胺開始脫氨縮聚形成三聚氰胺;溫度繼續上升至350 °C,三聚氰胺脫氨形成三聚氰胺二聚體;當溫度升至390 °C以上,三聚氰胺二聚體進一步脫氨,重排,形成3-s-三嗪(Melem);Melem作為g-C3N4單體在500 °C繼續脫氨,形成聚合度較低的Melon,當溫度到達520 °C后,Melon聚合形成g-C3N4[10],一種硬度可以和金剛石相媲美而在自然界中尚未發現的共價化合物。

圖2 g-C3N4熱聚法形成示意圖
2.1.2 光催化產H2O2機理
在能級圖中,處于同一能級或者能量差異微小的能級為能帶。其中,允許被電子占據的能帶為“允帶”,允帶之間不允許電子占據的范圍稱為“禁帶”。在基態下,被電子占據的允帶稱為“價帶”,上面未被電子占據的允帶稱為“導帶”。導體的禁帶很窄,因此可以認為其能帶是連續的,電子可以在價帶與導帶之間自由移動;絕緣體的禁帶很寬,電子無法從價帶穿越禁帶到達導帶[11]。而半導體介于兩者之間,當太陽光入射給予一定能量后,半導體會產生電子空穴對,具有還原性的電子(e?)可以從價帶躍遷到導帶,而具有氧化性的空穴(h+)則遺留在價帶。太陽能驅動H2O2生成的機理可分為以下步驟:首先受模擬太陽光照射,半導體被激發,產生電子空穴對;氧氣被電子還原產生結合H+產生再次被導帶電子還原產生,最后與H+結合產生H2O2[12](4),以此循環,實現太陽能到化學能的轉換和儲能。
2.2 試劑
本實驗所需主要試劑如表1所示。

表1 所需主要實驗試劑
2.3 儀器
本實驗所用主要儀器如表2所示。

表2 所用主要實驗儀器
2.4 實驗步驟/方法
2.4.1 g-C3N4催化劑的制備
采用熱聚合法制備g-C3N4(圖3)。在坩堝中加入雙氰胺至三分之二處,在馬弗爐中以10 °C·min?1的升溫速率加熱至550 °C,保溫2 h,冷卻至室溫。將得到的黃色固體仔細研磨,轉移至離心管中,即得g-C3N4,標記為YCN。

圖3 光催化劑制備實驗流程圖
2.4.2 g-C3N4催化劑的結構表征
樣品用X射線光電子能譜儀測定得XRD圖,以識別樣品的相結構并推斷樣品的晶體結構和結晶度。
取微量樣品與KBr粉末混合研磨后壓片,并將制好的薄片輕輕放在鎖式試樣架上,用傅里葉紅外光譜儀掃描得FTIR圖,以分析樣品中化學基團與化學鍵等信息。
將少量樣品分散于乙醇溶液中進行超聲處理。30 min后將混合液滴于銅網上,待干燥后,用透射電子顯微鏡拍攝得TEM圖,以觀察樣品的形貌結構。
2.4.3 光催化合成H2O2
取20 mg光催化劑于石英試管中,加入磁子、45 mL去離子水和5 mL乙醇[13],待超聲后塞上橡膠塞,貼好封口膜。用水泵抽去試管內空氣,邊抽邊振蕩,在觀察到橡膠塞凹陷時,拔出針管同時插入氧氣氣球,氣球針頭需伸入液面以下(對照實驗環境為空氣和氬氣)。重復三次抽換氣操作,制造充滿氧氣的光催化反應環境。將試管固定在磁力攪拌器上,設置攪拌速率,戴上護目鏡,開啟攪拌器,在模擬太陽光照條件下進行合成H2O2實驗(圖4),實驗進行1 h。每隔10 min取1次樣,用0.22 μm注射過濾器除去光催化劑后注入離心管待用。

圖4 模擬太陽光驅動H2O2生成實驗裝置圖
2.4.4 H2O2的含量測定及條件優化
用碘量法測定H2O2的濃度。用移液槍取100 μL待測溶液,加入到螺口玻璃瓶中,標記順序1至6。分別在待測溶液中加入400 μL的去離子水,2000 μL的碘化鉀溶液(0.1 mol·L?1)和50 μL的四水合鉬酸銨溶液[14](0.01 mol·L?1),搖勻,采用紫外-可見分光光度計在350 nm處檢測吸光度,重復三次。此外,使用標準濃度H2O2溶液,以上述步驟測定吸光度A*,重復三次。根據朗伯-比爾定律:A=lg(1/T) = Kbc(A為吸光度;T為透射比,是出射光強度I比入射光強度I0;K為摩爾吸光系數,它與吸收物質的性質及入射光的波長λ有關;b為吸收層厚度,單位為cm;c為吸光物質的濃度,單位為mol·L?1。)將A*帶入公式,制作標準曲線(A= 0.0183c+ 0.0492);再將待測溶液吸光度A代入標準曲線,計算生成H2O2的含量。使用Origin軟件計算三次反應的誤差棒,用于顯示實驗的誤差情況。
2.5 教學實踐
本實驗采用兩人一組形式,一名學生負責主要操作,另一名學生負責輔助操作以及數據處理。為確保實驗安全性,本實驗在一堂實驗課中安排10組學生,共20人。本實驗以一整天形式展開,上午制備一輪g-C3N4催化劑和進行g-C3N4結構表征的教學,下午進行三輪光催化合成H2O2及其含量測定,總耗時約8 h。為保證實驗高效性,學生僅以雙氰胺為原料制備g-C3N4;煅燒期間,以三種預先制備的標準樣,對學生進行g-C3N4結構表征的同步教學;催化劑性能測試時,雙氰胺(YCN)為原料的g-C3N4為學生制備,以尿素(UCN)、三聚氰胺(MCN)為原料的g-C3N4由實驗教師預先準備。實驗過程中,使用馬弗爐涉及高溫操作,必須待爐內溫度降至100 °C再用坩堝鉗取出坩堝;氙燈發出的強光對眼睛存在潛在傷害,因此,在光催化期間打開通風廚操作時必須戴上護目鏡。絕大多數學生反映,通過本實驗,學會如何操作馬弗爐,了解光化學反應機理,加深對綠色化學的認識,基本達到預定教學目標。
3 結果與討論
3.1 用于制備H2O2的g-C3N4催化材料的原料優化
g-C3N4可以通過各種富氮原料合成,不同原料合成的材料在催化合成H2O2的性能有所差別。為探究更適合本科的實驗教學,選用經濟的尿素、雙氰胺和三聚氰胺作為原料,以同樣的策略合成g-C3N4,分別標記為UCN、YCN和MCN,測定其催化合成雙氧水的性能。
3.2 結構表征
為使學生將在結構化學中學習的晶體理論知識與實驗相結合,采用XRD測定材料的晶體特征出峰(圖5)。在13°附近的出峰對應的是g-C3N4(100)晶面,代表三嗪環結構單元,即面間堆積基元;在27°附近的出峰對應g-C3N4(002)晶面,代表類石墨相物質的層狀排列,即π–π層間堆積基元。不同原料合成的g-C3N4均展現明顯的特征峰,說明以尿素、雙氰胺、三聚氰胺為原料,均可成功制備層狀g-C3N4催化材料。此外,XRD顯示沒有雜峰的出現,表明所有樣品均為高純相。

圖5 YCN、UCN、MCN的XRD圖
為提升學生分析樣品內化學基團與化學鍵情況的能力,實驗采用FTIR對材料進行表征。觀察圖6可知,在808 cm?1處YCN、UCN和MCN均存在尖銳的特征吸收峰,歸因于g-C3N4的三嗪環結構;在1200–1650 cm?1處的吸收帶是指雜環的C―N和C=N伸展振動;3000–3600 cm?1的寬吸收帶對應N―H伸縮振動峰。紅外進一步證實,以三種原料都可以成功實現該材料的制備。
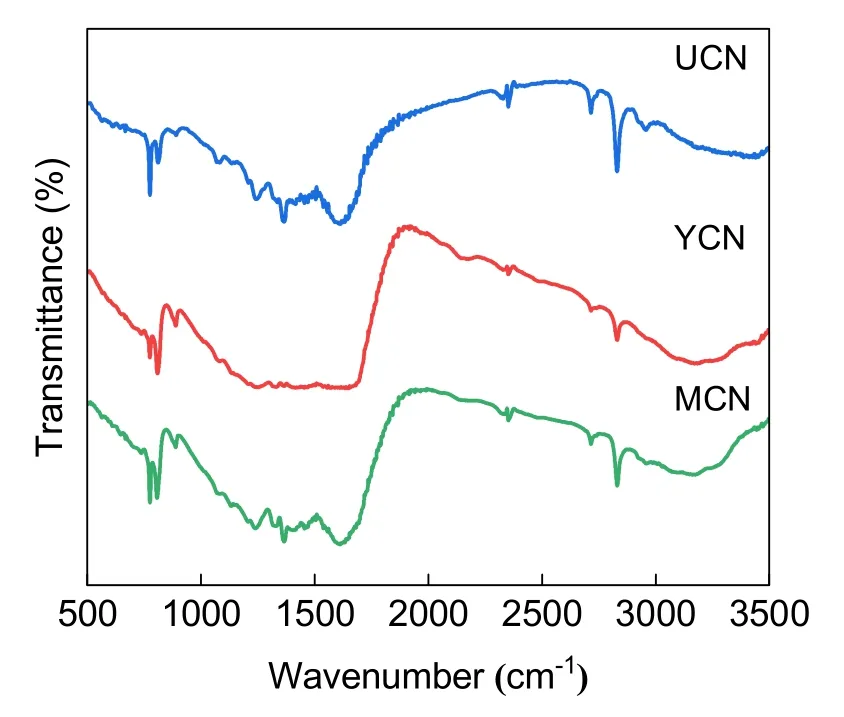
圖6 YCN、UCN、MCN的FTIR圖
為使學生更直觀了解材料實際微觀形貌,將TEM引入實驗中,結合相機進行介紹,測試結果如圖7所示。三種材料均具有g-C3N4典型的層狀結構,對應g-C3N4材料的π–π層間堆積。其中UCN形貌最薄且具有較多孔洞,說明面間堆積和層間堆積相對較弱,與XRD中兩個特征峰峰強度較弱相互印證。

圖7 (a) YCN的TEM圖像;(b) UCN的TEM圖像;(c) MCN的TEM圖像
3.3 催化性能測試
基于紫外-可見分光光度計測試,通過朗伯-比爾定律將吸光度轉化為濃度,出于還需加入碘量法所需試劑以及防止超過紫外分光光度計最大量程的考慮,故將試樣進行稀釋,計算結果的5倍為真實產率。結果如圖8顯示,不同原料合成的g-C3N4都能驅動過氧化氫生成,速率由快到慢依次為YCN、MCN、UCN,最高的雙氧水濃度達到282 μmol·L?1(YCN)。通過該過程,可提升學生的邏輯思維能力和數據分析能力。

圖8 在太陽光照射下H2O2產生的時間過程圖
在具體的實驗教學中,為提升學生自主設計實驗優化反應條件和探究相關機理的能力,可更換氣體氛圍進行對照實驗測試(圖9)。隨著環境中氧氣濃度的降低,雙氧水產量大幅下降。在純氧氣氛圍下產量最高,而在無氧的氬氣氛圍下產量幾乎為0,這歸因于半導體受光照激發后,氧氣直接被電子還原為,從而促進雙氧水的合成。

圖9 在不同條件下基于YCN的太陽能驅動合成H2O2產量對比圖
4 實驗拓展(該部分實驗數據均為實驗教師預先測得)
4.1 光催化材料元素組成和價態分析
基于前期的綜合實驗,供學有余力的學生進一步進行科學分析和創新研究,設計兩個拓展實驗。對于聚合物g-C3N4的清晰組成和價態分析,可以考慮用X射線光電子能譜(XPS),定性分析材料表面的組成,同時獲得樣品中的化學鍵存在信息(圖10)。

圖10 YCN、UCN、MCN的C 1s XPS圖和N 1s XPS圖
結合測試和分析結果,三種樣品的C 1sXPS出峰在288.5、286.40和284.80 eV處含有三個峰,分別對應于g-C3N4的雜環、C―NHX和不定碳的芳環中的N―C=N。N 1sXPS中可觀察到398.9、400.3和401.5 eV處的三個特征出峰,分別對應結構中的雙配位氮(C―N=C,N2C)、三配位氮(N―(C)3,N3C)和NHX基團。通過使用Origin對元素圖繪制曲線并進行出峰擬合,進一步將基礎的實驗技能和繪圖技能融合進本科教學中。
4.2 半導體帶隙計算
禁帶寬度是導帶的最低點和價帶的最高點的能量之差,是半導體材料的重要參數。禁帶寬度越大,電子由價帶被激發到導帶越難,本征載流子濃度就越低,電導率也就越低。基于儀器分析中最基礎的紫外-可見分光光度計,結合物理化學知識,可以計算本實驗中的半導體帶隙寬度。
如圖11(a)所示,首先利用截線法做出吸收波長閾值λg(nm),得出YCN、UCN、MCN的吸收波長閾值分別為518、466和485 nm。光學吸收系數滿足方程:αhν= Bd(hν?Eg)n[15](α為吸收系數;hν為入射光子能量;Eg為樣品的禁帶寬度(eV);Bd為吸收常數;n= 2)。利用該方程可以進行半導體禁帶寬度(Eg)的計算。如圖11(b)所示,將hν對(αhν)1/2作變化關系圖,做切線交于X軸,該交點即對應半導體材料的Eg,YCN、UCN、MCN三種材料的Eg分別為2.40、2.56和2.66 eV。然后如圖11(c)所示作價帶譜圖,可得材料價帶的能帶位置。用價帶減去禁帶寬度即可得材料導帶的位置,如圖11(d)所示。通過實驗操作和計算,使學生掌握常用的計算半導體帶隙的方法,熟悉紫外-可見吸收光度計在化學實操中的廣泛應用。

圖11 (a) 三種材料的UV-Vis差分反射光譜(DRS)圖;(b) 三種材料的的帶隙計算圖;(c) 三種材料的XPS價帶圖;(d) 能帶結構示意圖
5 結語
本實驗基于不同原料制備g-C3N4,設計了一個簡單的太陽能驅動過氧化氫合成實驗。催化反應在1 h內即可完成,并通過顯色法和紫外-可見分光光度計檢測實驗結果。結合材料表征、結構分析和形貌考察,確定了g-C3N4的成功合成。在對其光催化環境氛圍探究過程中發現,氧氣的存在對于反應有促進作用,證實該類反應在空氣中進行的可能性。
本實驗結合最新的研究熱點和研究進展,通過實驗實踐、討論分析和拓展衍生,結合無機化學、物理化學和分析化學的知識基礎,引導學生回顧紫外-可見分光光度計的原理和朗伯比爾定律,整合Origin作圖分析方法和現代化儀器表征分析方法,實現教學與科研的有效結合,將書本上的知識“實體化”,培養學生的開放思維和創新能力。

