右美托咪定通過SIRT3去乙酰化TFAM對HK-2細胞缺血再灌注損傷的影響*
胡 晨 劉玉麗
廣東省惠州市中心人民醫院 516001
缺血再灌注損傷(Schemia-reperfusion injury,IRI)是造成急性腎損傷(Acute kidney injury,AKI)的常見原因,也是腎臟手術圍術期常見并發癥,嚴重可出現多系統綜合征,危及患者的生命安全,是亟待解決的臨床問題[2]。圍術期的AKI以IRI為主要表現,其機制與炎癥反應、氧化應激等誘導的線粒體損傷有關[2]。右美托咪定(Dexmedetomidine,Dex)是一種高選擇性的α2腎上腺素能受體激動劑,能減小IRI誘發的線粒體損傷,而線粒體是細胞器中調節功能的重要物質,也是IR造成的氧化應激損傷靶點[3]。沉默信息調節因子2相關酶(Silence information regulator 2 homolog,SIRTs)被證實在細胞功能的調控和抗氧化防御中有重要作用,其中SIRT3被證明存在于線粒體中,可介導線粒體蛋白去乙酰化而減輕線粒體損傷[4]。線粒體轉錄因子A(Transcription factor A,TFAM)能調控線粒體DNA的拷貝數和轉錄活性并參與細胞凋亡[5]。目前關于Dex能否通過SIRT3去乙酰化TFAM影響腎小管上皮細胞(HK-2)的IRI有待于進一步研究,故本研究探討其相關機制,旨為AKI的機制研究及防治提供參考。
1 材料與方法
1.1 細胞與試劑 人HK-2細胞株(中科院上海細胞庫),鹽酸右美托咪定注射液(揚子江藥業集團有限公司,國藥準字H20183219,2ml∶0.2mg),SIRT3抑制劑(3-TYP,大連美侖生物技術有限公司),RPMI 1640培養基(北京諾為生物技術有限公司),胰蛋白酶(美國Biosciences),10%胎牛血清、細胞用青/鏈霉素(美國Sigma公司),BCA試劑盒(武漢艾迪康生物科技有限公司)、RIPA蛋白裂解液(北京索寶來科技有限公司),細胞計數試劑盒(CCK-8)、NAD+/NADH檢測試劑盒(上海碧云天生物技術有限公司),活性氧(ROS)檢測試劑盒(上海酶聯生物科技),MitoTracker Red CMXRos線粒體紅色熒光探針、質粒小提試劑盒(武漢賽默飛世爾科技中國),線粒體膜電位檢測試劑盒(JC-1,abcam中國),Protein A/G免疫磁珠(美國Med Chem Express公司),反轉錄試劑盒(海聯邁生物工程有限公司),IL-6、IL-8、IL-10酶聯免疫試劑盒(武漢生工生物工程有限公司)。兔抗SIRT3、TFAM單克隆抗、辣根過氧化酶標記的IgG抗體(美國Santa Cruz公司),Tanon凝膠成像系統(北京原平皓生物技術)。
1.2 IRI細胞模型建立 細胞復蘇后培養于含10%胎牛血清的RPMI 1640培養基,于常規條件下(5%CO2、37℃)培養,細胞單層貼壁生長鋪滿培養瓶后,胰酶消化重懸繼續培養傳代。取對數生長期細胞,制備2×105個/孔單細胞懸液,接種于6孔板中,以無血清的培養基培養,于37℃、5%CO2、1%O2、94%N2環境中培養,24h后更換正常完全培養基,常規條件繼續培養2h復氧,建立IRI細胞模型。
1.3 細胞培養及分組 將細胞分為對照組(常規培養)、缺血/灌注(I/R)組、Dex組、3-TYP組及Dex+3-TYP組。Dex組、3-TYP組及Dex+3-TYP組在I/R制備前分別給予0.015nmol/L的Dex、50μmol/L 3-TYP孵育2h及0.015nmol/L Dex+50μmol/L 3-TYP共同孵育2h;I/R組及對照組在建模前加入等量生理鹽水處理,對照組不予以I/R制備。
1.4 細胞活力檢測 對數生長期HK-2細胞消化重懸,以2×104/ml接種于96孔板,100μl/孔,按照對應分組處理24h、48h后,更換為CCK-8溶液(10%)濃度,繼續孵育2h后以酶標儀檢測A450nm的光密度值(OD),OD值越高表示細胞活性越強。
1.5 炎癥因子檢測 各組干預24h后細胞,收集上清液,以ELISA試劑盒檢測IL-6、IL-8、IL-10表達水平,嚴格按照試劑盒說明書操作,檢測A450nm的OD值,根據標準曲線計算各組細胞炎癥因子水平。
1.6 線粒體損傷情況檢測 (1)線粒體ROS表達情況:干預24h后細胞以線粒體提取試劑盒提取線粒體,加入NAD+/NADH工作液5μmol/L,37℃孵育10min,使用酶標儀檢測熒光強度,以對照組為標準差在熒光顯微鏡下觀察細胞熒光強度。(2)線粒體膜電位(Mitochondrial membrane potential,MMP)測定:各組細胞經PBS洗滌后重懸,與工作濃度為5μmol/L的JC-1共孵育15min(37℃),在熒光顯微鏡下觀察,以紅色與綠色熒光比值衡量線粒體去極化程度。以對照組為標準化,觀察比值。比值越高表明線粒體去極化降低MMP增加,反之則去極化增加,膜電位下降。(3)線粒體通透性轉換孔(mitochondrial permeability transition pore,mPTP)開放程度:各組細胞加入1ml的染色工作液混合均勻,37℃震蕩孵育10min,以mPTP熒光檢測試劑盒及酶標儀檢測(激發波長488nm、發射波長530nm)的熒光強度,熒光強度下降表明mPTP開放,增加表明mPTP被抑制。(4)線粒體DNA(mtDNA)檢測:收集各組干預24h細胞,DNA提取試劑盒分離DNA,NAD+/NADH確定mtDNA數量,以β-actin為內參基因,進行實時熒光定量PCR反應,引物序列:mtDNA-F:ACCGCTAACGCCTTAAGCATACT,mtDNA-R:CCGATCGGACATGFCACCCGTTA,根據試劑盒說明書設置反應體系及擴增條件,以內參基因與目的基因樣本Ct均值得出mtDNA拷貝數量變化率。
1.7 Western Blot(WB)檢測SIRT3表達及TFAM的去乙酰化 各組細胞提取蛋白經裂解液裂解后,4℃情況下12 000r/min離心5min,留取上層血清,經抗賴氨酸乙酰化抗體孵育,蛋白G免疫磁珠沉淀免疫復合物,洗滌后,95℃加熱變性。經BCA試劑盒檢測蛋白濃度,SDS-PAGE電泳分離,經半干轉膜法將蛋白轉移至PVDF膜,TBST溶液洗膜后室溫封閉,加入TFAM一抗稀釋液(1∶1 000),4℃孵育過夜,加入二抗(1∶5 000)室溫孵育1h,ECL顯影,凝膠成像系統測定蛋白條帶灰度值。SIRT3檢測,取蛋白經裂解液裂解后,取上清,檢測蛋白濃度,其余方法同TFAM檢測。
1.8 Co-IP驗證SIRT3與TFAM相互作用 對照組、3-TYP組與Dex細胞提取的總蛋白按照Protein A/G免疫磁珠進行蛋白提純,取30μl磁珠加入SIRT3及IgG一抗,充分混合后室溫孵育1h,清洗富集磁珠,蛋白樣本與磁珠充分混合,4℃孵育過夜,清洗磁珠,8 000r/min離心30s,自然沉淀2min,棄上清,以20倍磁珠體積的TBS溶液清洗沉積物,棄上清,經0.1mmol/L甘氨酸清洗磁珠,棄上清加入上樣緩沖液,水浴變性10min行WB檢測。
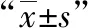
2 結果
2.1 細胞活力比較 與對照組比較,I/R組、Dex組、3-TYP組和Dex+3-TYP組24/48h的OD值均下降(P<0.05);與I/R組比較,Dex組和Dex+3-TYP組24/48h的OD值均升高,3-TYP組則下降(P<0.05);與Dex組比較,3-TYP組和Dex+3-TYP組24/48h的OD值均下降(P<0.05);與3-TYP組比較,Dex+3-TYP組24/48h的OD值均升高(P<0.05)。見表1。
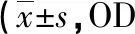
表1 各組細胞活力比較值)
2.2 細胞炎癥因子水平比較 與對照組比較,I/R組、Dex組、3-TYP組和Dex+3-TYP組IL-6、IL-8水平均升高,IL-10水平均下降(P<0.05)。與I/R組比較,Dex組和Dex+3-TYP組IL-6、IL-8水平均下降,3-TYP組IL-6、IL-8則升高;Dex組和Dex+3-TYP組的IL-10水平均升高,3-TYP組IL-10則下降(P<0.05)。與Dex組比較,3-TYP組和Dex+3-TYP組IL-6、IL-8水平均升高,IL-10水平均下降(P<0.05)。與3-TYP組比較,Dex+3-TYP組IL-6、IL-8水平均下降,IL-10水平升高(P<0.05)。見表2。
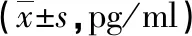
表2 各組細胞炎癥因子水平比較
2.3 線粒損傷指標比較 與對照組比較,I/R組、Dex組、3-TYP組和Dex+3-TYP組ROS水平升高,MMP、mPTP及mtDNA均下降(P<0.05)。與I/R組比較,Dex組和Dex+3-TYP組ROS水平均下降,MMP、mPTP及mtDNA均升高;3-TYP組的ROS水平升高,MMP、mPTP及mtDNA則下降(P<0.05)。與Dex組比較,3-TYP組和Dex+3-TYP組ROS水平均升高,MMP、mPTP及mtDNA均下降(P<0.05)。與3-TYP組比較,Dex+3-TYP組ROS水平下降,MMP、mPTP及mtDNA升高(P<0.05)。見表3。
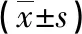
表3 各組線粒損傷指標比較
2.4 SIRT3表達及TFAM乙酰化水平比較 與對照組比較,其余各組SIRT3蛋白表達水平均降低,TFAM乙酰化水平均升高(P<0.05)。與I/R組比較,Dex組與Dex+3-TYP組的SIRT3蛋白表達水平升高,TFAM乙酰化水平下降;3-TYP組的SIRT3蛋白表達水平下降,TFAM乙酰化水平升高(P<0.05)。與Dex組比較,3-TYP組與Dex+3-TYP組的SIRT3蛋白表達水平均下降,TFAM乙酰化水平均升高(P<0.05)。與3-TYP組比較,Dex+3-TYP組的SIRT3蛋白表達水平升高,TFAM乙酰化水平下降(P<0.05)。見表4。
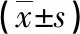
表4 各組細胞SIRT3表達及TFAM乙酰化水平比較
2.5 SIRT3與TFAM的結合情況 IP SIRT3蛋白條帶顯示,使用SIRT3進行沉淀試驗,SIRT3與TFAM均被沉淀,證實SIRT3與TFAM之間存在相互作用。見圖1。
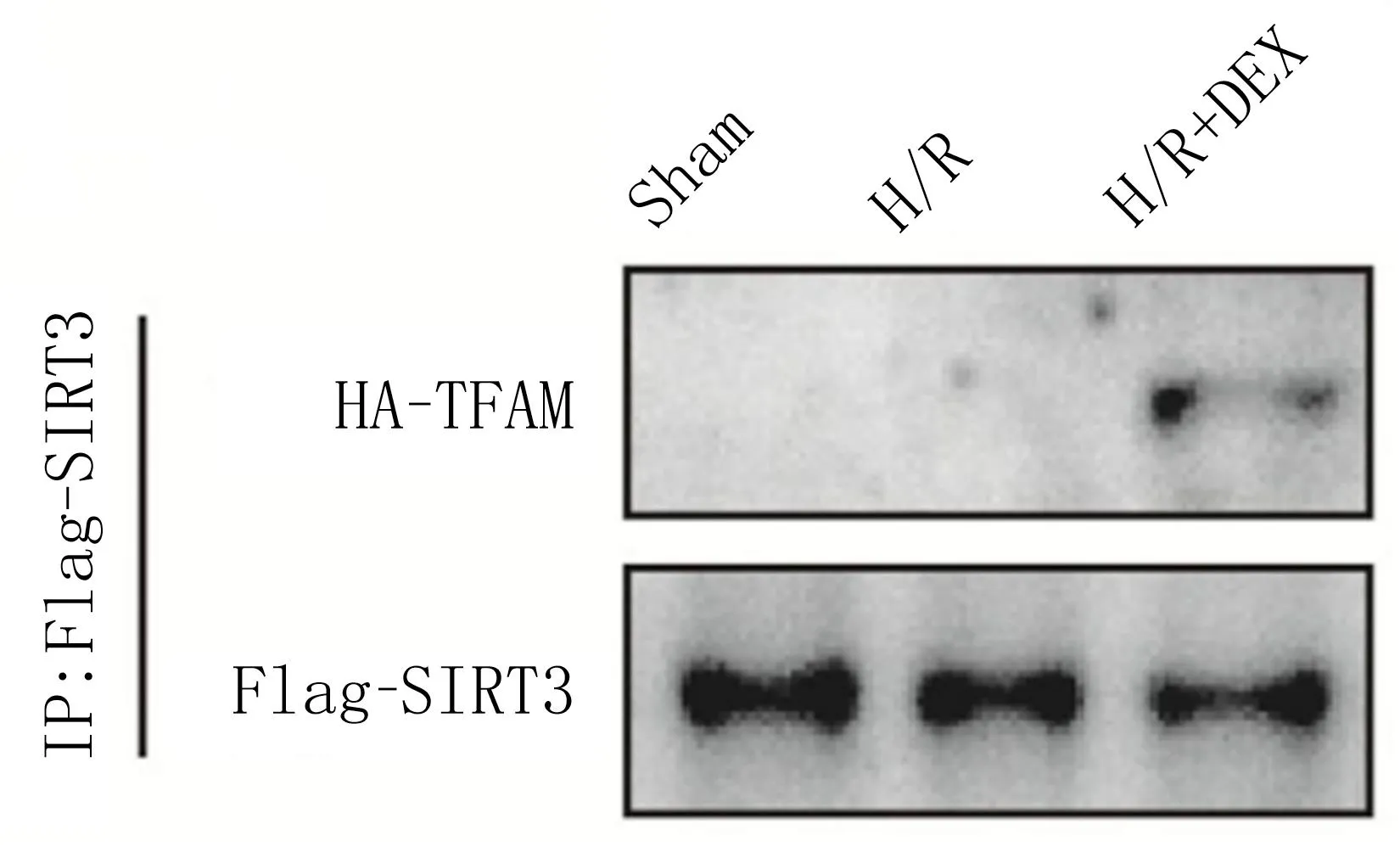
圖1 Co-IP檢測SIRT3和TFAM的物理相互作用
3 討論
AKI除可在短期內造成高死亡率外,還被認為是慢性腎臟病發展的重要危險因素,其機制涉及腎小管、微血管及炎癥的不同信號通路和分子[6]。線粒體功能障礙在IRI引起的AKI發生發展中有關鍵作用[7]。線粒體是高速動態的細胞器,豐富的線粒體能夠產生足夠的腺嘌呤核苷三磷酸維持腎臟生理功能[8],因此減輕腎臟細胞線粒體功能障礙是IRI及AKI治療的研究熱點。
本研究結果顯示,干預后的各組OD值、IL-10水平,線粒體MMP、mPTP及mtDNA較對照組下降,線粒體ROS水平及IL-6、IL-8水平較對照組升高,而3-TYP干預后的變化更為明顯,經Dex干預后的OD值、IL-10水平,線粒體MMP、mPTP及mtDNA則升高,線粒體ROS水平及IL-6、IL-8水平下降,Dex+3-TYP組變化介于I/R組與Dex組之間,說明Dex可增加IRI的HK-2細胞活性,抑制炎癥及氧化應激損傷,改善線粒體功能。Dex是臨床常用的鎮靜、止痛類藥物,有調節免疫、抗感染、抗氧化應激及抑制交感神經的作用[9]。腎IRI時發生劇烈的氧化應激損傷,使內皮細胞生成前列腺素E2及一氧化氮,細胞內抗氧化酶活性下降,ROS增多,而ROS可促進前列腺素、白三烯等物質的合成,增加IL-6、IL-8等炎癥介質的釋放,抗炎因子IL-10水平降低,加重細胞損傷[10]。楊昊天等[11]研究發現,Dex具有抗氧化作用,能減輕急性氧化應激腎損傷模型大鼠的氧化應激指標水平,改善腎損傷,在應激綜合征中具有潛在的治療作用。宋云飛等[12]則證實Dex能減輕APP/PS1小鼠海馬區炎性因子的分泌,抑制細胞凋亡。吳華兵[13]研究中亦發現Dex能抑制缺氧/復氧條件下心肌細胞PTEN誘導激酶1/E3泛素連接酶通路介導的線粒體自噬,減輕氧化應激損傷。上述研究證實了Dex在抗氧化應激、抗炎及改善線粒體功能方面的作用,與本研究結果具有同質性。
SIRT3是主要的線粒體乙酰轉移酶,能調節線粒體的穩態、代謝、基因轉錄、應激反應和基因組的穩定性,參與機體各種生理病理過程。研究發現,Sirt3缺陷型小鼠的壽命短于野生型,這可能與缺乏Sirt3調節的心臟線粒體功能障礙和造血干細胞中的ROS穩態失調引起的心力衰竭有關[14]。Si等[15]則認為Dex減輕腎IRI需要Sirt3的激活。TFAM是位于人和小鼠10號染色體長臂21區上的高遷移率蛋白,能與線粒體DNA上的輕鏈啟動子和高呼吸活性的細胞上游識別位點特異性結合刺激轉錄,調控mtDNA拷貝數并影響線粒體功能。TFAM的乙酰化使TFAM的基因表達及蛋白質活性被抑制,影響TFAM對線粒體功能的調控作用。本研究結果中,干預后的各組SIRT3蛋白表達水平較對照組降低,TFAM乙酰化水平較對照組升高,3-TYP干預后的細胞變化最明顯,而Dex干預后SIRT3蛋白表達水平則有所升高,TFAM乙酰化水平下降,Dex+3-TYP組變化介于I/R組與Dex組之間,Co-IP檢測SIRT3和TFAM存在物理相互作用,結果提示Dex可通過SIRT3去乙酰化減輕HK-2細胞的IRI。
綜上所述,Dex能減輕HK-2細胞的IRI,提高細胞活性,抑制炎癥,改善線粒體功能,其機制可能與SIRT3去乙酰化TFAM有關。

