聚合物囊泡的穩定性及H+透膜特性考察
卞康晴,郭靈怡,遲文雅,俞 媛 (海軍軍醫大學藥學系藥劑學教研室, 上海 200433)
聚合物囊泡(PSs) 是由兩親嵌段共聚物自組裝形成的囊泡狀“殼-核”結構微納米載體,其結構類似脂質體(liposomes)[1],常用的聚合物材料包括聚乙烯醇(PVA)、聚乙二醇(PEG)、聚己內酯(PCL)、聚乳酸(PLA)、聚乳酸-羥基乙酸共聚體(PLGA)等,作為生物膜模型、藥物控釋和基因轉染的載體而被廣泛研究。脂質體制備過程中,其穩定性受磷脂酰膽堿和膽固醇的比例、溫度和pH 等因素的影響,一定范圍內磷脂酰膽堿含量高,高溫和酸性環境都會破壞脂質體的穩定性。聚合物囊泡具有更加穩定和可控的結構特點,熵值較小,比脂質和表面活性劑更穩定,在化學修飾、生物分子偶聯和物理結構等方面具有更好的穩定性和靈活性[2,3],對(113.7±18.5)nm 水的滲透性較低,可抵抗更大的壓力[4]。聚合物囊泡既可以攜帶水溶性藥物(如氨基酸、多肽、蛋白類藥物),將藥物包封在內水相內,也可以攜帶脂溶性藥物,將藥物增溶在膜層中。根據聚合物的鏈長和分子量差異得到不同膜層厚度的聚合物囊泡,可提高疏水性藥物在囊泡中的包封率[5]。聚合物囊泡的特殊結構和性質決定其可用于生物膜模擬、藥物釋放、催化、提供反應的微環境等,因此,在分子封裝和控釋領域有很大的潛在應用價值。作為藥物載體,具有改變藥物在體內的分布、防止藥物降解失活、延長作用時間以及降低毒副作用等特點[6,7]。
聚合物囊泡的膜穩定性好,但用于藥物包載時可能影響藥物的釋放速率,達到藥物作用有效濃度時間長,影響治療效果[8]。不同嵌段聚合物制備的聚合物囊泡具有不同的膜厚度以及滲透特性。H+分子小、極性強、對囊泡膜的滲透性弱,Wu 等[6,9]的研究將H+的透膜性能作為考察囊泡膜壁的指標,通過考察H+的跨膜特性評估囊泡膜的滲透性,進一步模擬研究囊泡內外可否形成H+跨膜梯度,為囊泡的主動載藥提供依據,同時發現1,4-二氧六環可對膜滲透特性進行調節,有利于藥物包載。8-羥基-1,3,6-三磺酸芘鈉鹽(HPTS)是一種pH 響應性的熒光探針,特定波長下的熒光強度隨著溶液的pH 值發生變化,可用于監測溶液的酸堿性。因此,本文采用H+跨膜轉運考察聚合物囊泡的滲透性,對幾種不同聚合物材料制備的囊泡和脂質體進行比較 ,以 pH 敏感熒光探針HPTS 對載藥相關的透膜性能以及1,4-二氧六環對聚合物囊泡膜的透過性影響進行了考察[9],并與脂質體進行對比。
1 材料和方法
1.1 實驗儀器和材料
紫外分光光度儀(UV-2401PC,Shimadzu,日本),粒度/Zeta 電位測量儀, (NICOMPTM380 ZLS,NICOMP,美國),熒光分光光度儀(LS55 Luminescence spectroscopy,Perkin Elmer,英國),旋轉蒸發儀(R-200,Buchi,德 國),Satoris Mettler AE200 天 平(Satoris,德國),PHS-3TC pH 計(上海天達儀器,中國),葡聚糖凝膠(Sepharose CL-4B, Pharmacia,瑞典),8-羥基-1,3,6-三磺酸芘鈉鹽(8-hydroxypyrene-1,3,6-trisulfonic acid trisodium salt,HPTS,Acros,美國),大豆卵磷脂(上海愛康精細化工有限公司,中國),膽固醇(上海如吉生物科技發展有限公司,中國),MPEG-PLGA(實驗室自合成),PBD-b-PEO(聚氧乙烯-聚丁二烯,Polymer Source, 加拿大), PS-b-PEO(聚氧乙烯-聚苯乙烯,復旦大學高分子科學系黃駿廉教授惠贈),1,4-二氧六環(1,4-dioxane,AR,上海諾泰化工有限公司),其余試劑均為分析純(中國醫藥集團上海化學試劑公司,中國)。
1.2 聚合物囊泡及脂質體的制備
以開環聚合法合成PEG-PLGA,將20 mg PEG-PLGA 溶于2 ml 丙酮,緩慢注入PBS 緩沖液(0.01 mol/L)中自組裝制備聚合物囊泡(PSs-PLGA),超濾濃縮備用。薄膜分散法制備脂質體及兩種聚合物囊泡(PBD-b-PEO、PS-b-PEO),將15 mg 大豆磷脂與5 mg 膽固醇混合溶于10 ml 二氯甲烷中,20 mg PBD-b-PEO、20 mg PS-b-PEO 分別溶于10 ml二氯甲烷中,3 種載體材料分別采用旋轉揮發法成膜,減壓干燥24 h 后用PBS 緩沖液(0.01 mol/L)水化,冰浴探頭超聲得到脂質體、PSs-PBD 和PSs-PS,超濾濃縮備用[10]。
1.3 聚合物囊泡的穩定性
取適量已制備的脂質體和3 種聚合物囊泡,在4 ℃恒溫箱內靜置,測量并記錄時間t為0、2、4、8、15、20、30 d 時的粒徑,觀察溶液分層和沉淀情況。同上,另取一組上述溶液,在40 ℃恒溫箱內靜置,重復上述實驗。
1.4 聚合物囊泡的膜滲透性
在聚合物囊泡對藥物的包載釋放中,囊泡膜壁的組成成分和滲透性起著重要作用。研究者將H+的透膜性能作為考察囊泡膜壁的指標,研究H+的跨膜轉運可用于囊泡膜的滲透性研究。本文采用H+跨膜滲透考察囊泡的膜滲透性,對幾種不同聚合物材料制備的囊泡和脂質體做出對比。
1.4.1 HPTS 作為pH 敏感熒光探針
HPTS 是pH 響應性的熒光探針,熒光強度隨著溶液pH 值變化而發生變化,用于監測溶液的酸堿性。HPTS 的激發波長(λex)分別是403 nm 和454 nm,發射波長(λem)是 509 nm,激發波長的強度之比(I454/I403)與HPTS 溶液體系的pH 相關,而發射波長與HPTS 溶液體系的pH 無關。根據這些性質,HPTS 作為pH 敏感的熒光探針可用于測定聚合物囊泡外水相的pH 值變化[6]。
配制一系列不同pH 值梯度的緩沖溶液,分別加入適量HPTS(濃度為2.5 μmol/L),檢測并記錄激發光波長在403 nm 和454 nm 的熒光強度I403和I454,分別將I403/I454和I454/I403與pH 值按Boltzmann函數進行曲線擬合,得到I403/I454和I454/I403與pH 值的相關關系。
1.4.2 聚合物囊泡外水相的pH 測定
制備聚合物囊泡和脂質體,方法同“1.2”項。用0.2 mol/L 的檸檬酸緩沖溶液(pH 值 4.0)代替pH 值7.4 的PBS 溶液(0.01 mol/L)。將聚合物囊泡或脂質體過Sepharose CL-4B 柱,生理鹽水洗脫。將上述聚合物囊泡或脂質體混懸液中加入適量HPTS(濃度為2.5 μmol/L),檢測并記錄激發光波長在403 nm 和454 nm 的熒光強度I403和I454。根據I454/I403與pH 值的相關性計算囊泡外水相的pH 值與H+濃度。
1.4.3 H+跨膜速率的計算
根據Fick’s 第一定律,H+從單個聚合物囊泡擴散到外水相的速率為:
式中,M 為H+由聚合物囊泡傳播至外水相的量,A 為聚合物囊泡的表面積,K 為H+在聚已內酯(囊泡的膜層)與水中的分配系數,D 為H+的傳播系數,L 為聚合物囊泡的膜厚,△C 為囊泡的內水相H+濃度(Cin)和外水相H+濃度(Cout)之差。因此,囊泡外水相中H+濃度為:
式中,Vin為囊泡內腔體積,Vout為外水相體積。單個囊泡內腔體積Vin根據公式Vin=4/3π(D/2-L)3計算,其中,D 為囊泡的粒徑的平均數。由于K 值未知,所以可用表觀擴散系數D*代替DK。而由于Cin為定值0.1 mmol/L,因此方程(2)可轉化為:
參考文獻[9]進行推導,同時囊泡外水相中H+濃度與時間可按方程Cout+Cin=擬合,其中:
由于實驗中t(s)>>B,表明聚合物囊泡外水相中H+濃度(pH 值)與t1/2成正比,因此方程(3)最終可轉化為:
將聚合物囊泡外水相中H+濃度(pH 值)和時間按方程(4)擬合后,可求算H+在聚合物囊泡跨膜轉運過程中的表觀擴散系數D*。
2 實驗結果
2.1 聚合物囊泡及脂質體的制備
嵌段共聚物在溶液中自組裝形成聚合物囊泡的行為與共聚物疏水鏈段與親水鏈段的比例有關,當親水端比例為20%~40%時為囊泡的形成區域。PEG 與PLGA 以25∶75(w/w)的比例合成PEGPLGA,以溶劑注入法在溶液中自組裝制備PSs-PLGA,囊泡呈明顯的圓形囊壁狀結構,外壁厚度d 約為10 nm,粒徑為(113.7±18.5)nm[10,11]。以薄膜揮發法制備了PSs-PBD 和PSs-PS 及脂質體,粒徑分別為(139.2±13.1)、(128.0±12.54)、(132.1 ±10.5)nm。
2.2 聚合物囊泡的穩定性
粒徑穩定性試驗結果見圖1,與脂質體相比,3 種聚合物囊泡在4 ℃放置的粒徑變化均更小,不易出現沉淀和分層,而且隨著放置時間的延長,這種趨勢仍保持,說明聚合物囊泡相較脂質體更穩定。隨著時間延長,在40 ℃條件下,脂質體出現結構的破壞無法測定粒徑,PSs-PLGA 也逐漸顯示結構的破壞,而PSs-PBD 和PSs-PS 的粒徑相對保持較好,聚合物囊泡的結構穩定性優于脂質體。
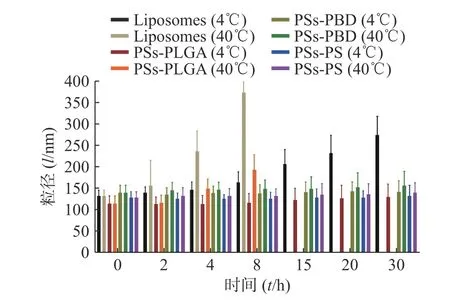
圖1 不同溫度聚合物囊泡及脂質體的粒徑穩定性
2.3 聚合物囊泡的膜滲透性
2.3.1 HPTS 作為pH 值敏感的熒光探針
圖2 為HPTS 在不同pH 值的緩沖液中的熒光激發光譜圖。如圖2 所示,HPTS 的熒光激發光光譜有明顯的pH 值依賴性。pH 值10.0 時,HPTS在454 nm 的熒光強度最高,而在403 nm 熒光強度最低,表明HPTS 的大部分-OH 離子化。隨著pH 的降低,HPTS 的-O-質子化逐漸增多,HPTS 在454 nm 的熒光強度逐漸降低,而在403 nm 的熒光強度逐漸升高。當pH 值< 6.0,454 nm 峰基本消失,而403 nm 峰強度隨著pH 值的降低繼續逐漸升高。
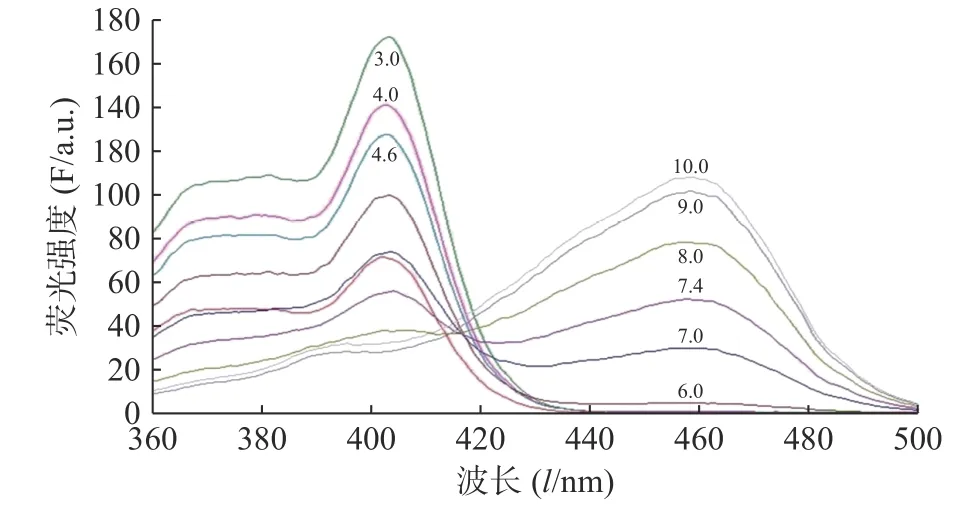
圖2 HPTS (2.5 μmol/L)與緩沖溶液pH 值的激發光譜(λem = 509 nm)
將I454/I403或I403/I454對pH 值作圖,如圖3 所示,I454/I403隨pH 值升高而增加。將I454/I403或I403/I454對pH 值按Boltzmann 函數回歸,即可得到I454/I403或I403/I454與pH 值的相關關系。在特定pH 范圍內,可通過I403/I454與pH 值的關系來測定聚合物囊泡外水相pH 值。
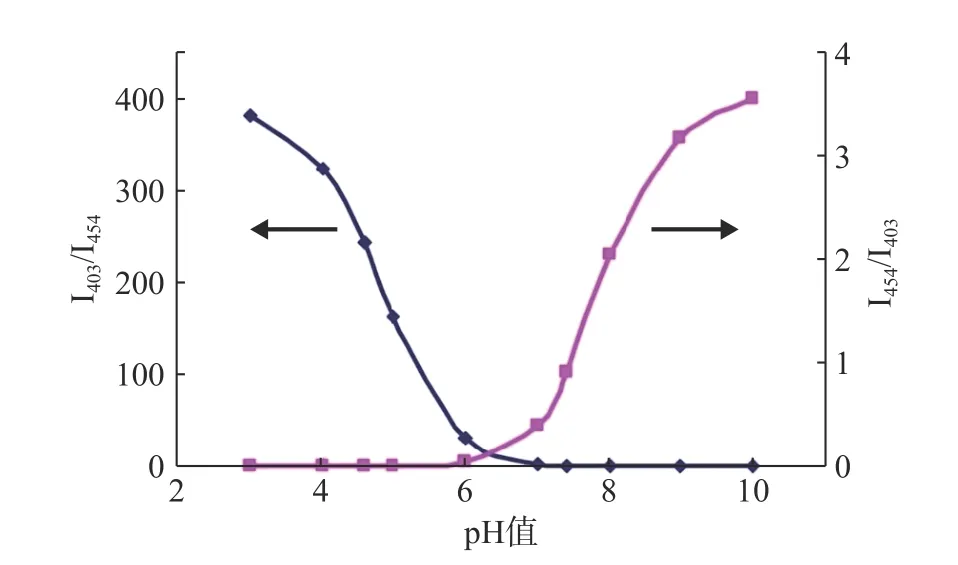
圖3 HPTS 校準曲線(I454/I403 或I403/I454 與pH 的關系)
I403/I454與pH 值:,R=0.995
2.3.2 聚合物囊泡外水相的pH 測定和H+跨膜速率的計算
聚合物囊泡或脂質體外水相pH 值測定結果見表1。將囊泡外水相中H+濃度[H+](Y)對t1/2(X)作圖(圖4),結果表明囊泡外水相中H+濃度與t1/2呈線性相關。
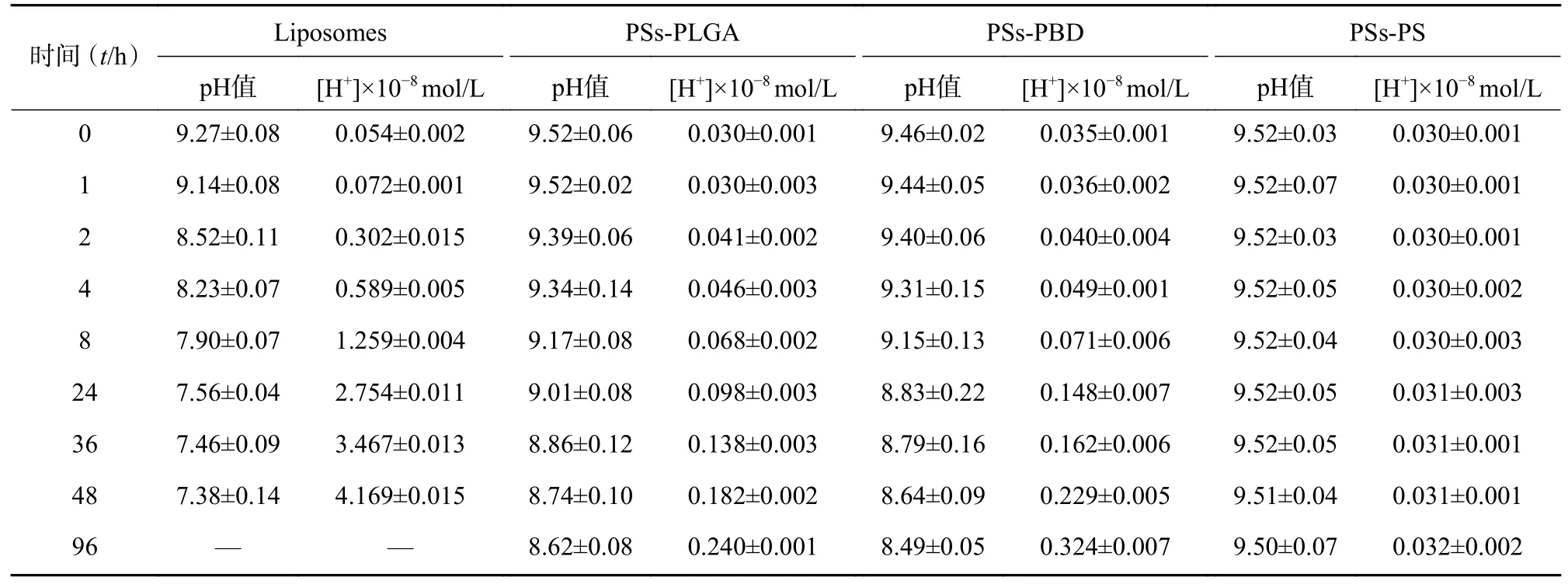
表1 聚合物囊泡和脂質體外水相中的氫離子濃度和pH 值(n=3)
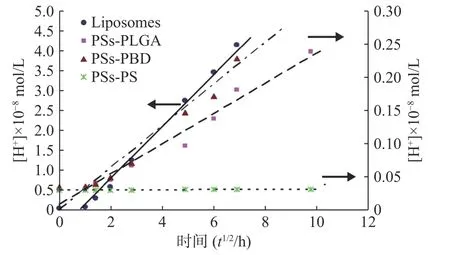
圖4 氫離子濃度與t1/2 的線性關系
脂質體:Y= 0.646 4X-0.442 3(R= 0.989);PSs -PLGA:Y= 0.028 8X+ 0.008 7 (R= 0.984);PSs-PBD:Y= 0.031 1X+ 0.001(R= 0.983);PSs-PS:Y=0.000 2X+ 0.03(R= 0.958)
從回歸方程的斜率可知,脂質體中H+的釋放速度遠遠大于囊泡中H+的釋放,而3 種聚合物囊泡相比,PSs-PLGA 的釋放速率大于PSs-PS,與PSs-PBD 沒有顯著差異,PSs-PS 在測定時間內幾乎沒有H+透膜現象發生,這與材料的屬性密切相關。將上述脂質體和PSs -PLGA 兩直線的斜率代入方程(10):
求得H+的表觀擴散系數。其中Cin= 0.1 mmol/L,Vout=2 ml,計算結果見表2。結果表明,H+在脂質體的表觀擴散系數D*=8.39×10-4cm2/s,是H+在PSs-PLGA 的表觀擴散系數D*=3.51×10-8cm2/s 的2.39×104倍。囊泡膜壁對H+的滲透性遠遠低于脂質體。這一性質將既有利于囊泡內被包封藥物的保存,又表明囊泡內外可以建立H+跨膜梯度,為囊泡的主動載藥提供依據。
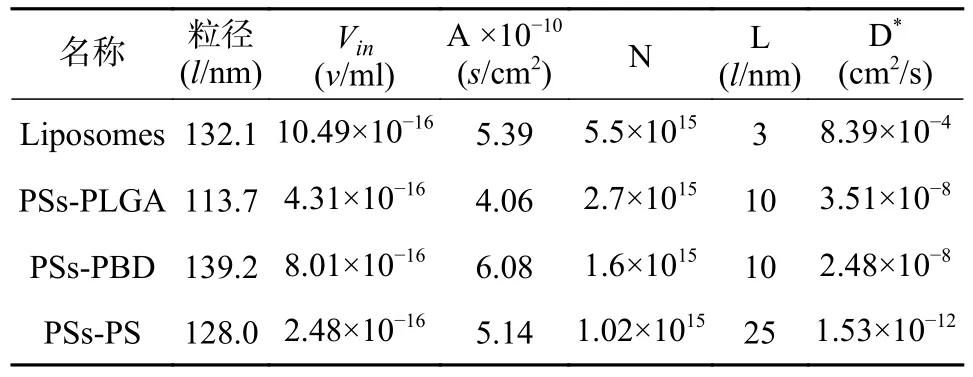
表2 脂質體和聚合物囊泡的膜表觀擴散系數(D*)
2.3.3 1,4-二氧六環對聚合物囊泡滲透性的調節作用
聚合物囊泡的膜壁較厚,而且分子間排列結構緊密,所以對分子的滲透性低。考察1,4-二氧六環對PEG-PLGA 以及PBD-b-PEO,PS-b-PEO 制備的囊泡的膜透過能力的影響。囊泡外水相加入1,4-二氧六環室溫孵育,濃度分別是5%、15%、20%,按時間點測定H+濃度,測定結果見圖5。隨著囊泡外水相中1,4-二氧六環含量的增加,由5%~20%,囊泡膜層對H+的滲透能力加強。上述實驗結果表明1,4-二氧六環對PEG-PLGA 囊泡膜的滲透性具有很好的調節作用,其作用與囊泡外水相中的1,4-二氧六環含量成正相關(P<0.05)。1,4-二氧六環對聚合物囊泡的滲透能力有顯著提高。

圖5 不同時間氫離子擴散濃度
3 小結與討論
本研究采用溶液中自組裝法制備PSs-PLGA,并與不同材料制備的聚合物囊泡以及脂質體進行穩定性及膜滲透特性的考察。HPTS 是pH 響應性的熒光探針,熒光強度隨著溶液的pH 值變化而發生變化,利用HPTS 對pH 的響應性,設計H+滲透實驗評價聚合物囊泡的膜滲透性性能。結果表明,PSs-PLGA 的膜滲透性較脂質體低,而比PBD-b-PEO 和PS-b-PEO 制備的囊泡膜滲透性高,適度的滲透性有利于囊泡中藥物釋放和裝載。同時1,4-二氧六環可以作為PSs-PLGA 的膜層增塑劑,調節膜的滲透性能,改善PSs-PLGA 的載藥和釋藥能力。FDA 批準PLGA 作為藥用高分子材料,因其具有良好的生物降解和與分子量相關的緩釋藥物作用。作為一種與脂質體結構類似的納米載體,與聚合物納米粒不同,聚合物囊泡由于是中空殼核結構,因此其藥物釋放更快且載體的降解周期更短。兼具穩定性的優點,結合靶向配體的修飾以及聚合物材料合成策略,PLGA 為基礎的聚合物囊泡在藥物靶向遞送中具有廣泛的研究價值[12]。

