烘干溫度對不同品系梔子有效成分含量的影響
摘 要 為探究烘干溫度對不同品系梔子活性成分含量的影響,采用高效液相色譜法對不同烘干溫度烘干的不同品系梔子樣品中的梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ含量進行測定,采用Pearson相關性分析烘干溫度與梔子有效成分間的相關關系。結果表明,在40~90 ℃范圍內,烘干溫度越高,烘干所需時間越短;不同烘干溫度下不同品系梔子的有效成分含量變化趨勢一致,烘干溫度與梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ含量呈極顯著負相關;渝梔1號、渝梔2號、渝梔3號和混合梔子分別在烘干溫度40、40、50和40 ℃下有效成分含量最高。烘干溫度對不同品系梔子有效成分含量影響較大,不同品系梔子的最適烘干溫度存在一定差異。
關鍵詞 梔子;烘干溫度;梔子苷;西紅花苷;高效液相色譜
中圖分類號:R282.4 文獻標志碼:A DOI:10.19415/j.cnki.1673-890x.2024.23.002
梔子是茜草科梔子屬植物梔子(Gardenia jasminoides Ellis)的干燥成熟果實,主產于我國中南、西南片區及東南亞地區[1],具有瀉火除煩、清熱利濕、涼血解毒等功效。梔子化學成分種類繁多,已分離鑒定到30多種,包括環烯醚萜、二萜、三萜、有機酸酯、黃酮類[2-5]等化學成分。梔子苷(geniposide)是環烯醚萜類的代表成分,歷版《中國藥典》均以其含量高于1.8%作為梔子的質控指標,其活性成分地位明確[6]。西紅花苷屬于二萜類化合物,是自然界存在的唯一水溶性胡蘿卜素,可用于補充人體維生素缺乏[7],具有腫瘤抑制[8]、抗動脈粥樣硬化[9]、神經保護[10]和肝臟保護[11]等多種生物學功能,具有巨大的藥用及經濟價值。因此,近年來許多學者也將西紅花苷含量作為評價梔子藥材品質的重要成分之一。
中藥材產地初加工是藥材品質形成的關鍵因素,決定了中藥材的質量,科學合理的產地初加工方法至關重要。目前關于加工方法對梔子品質影響的研究報道很多[12-15],均以市場上混雜的梔子栽培群體或市場購買的混合梔子樣品作為供試材料,而烘干溫度對單一品系梔子有效成分含量影響的研究還未見報道。本研究以團隊優選的不同品系梔子良種為試驗材料,采用HPLC法測定不同溫度烘干處理的梔子中梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ的含量變化規律,以期為梔子藥材產地初加工提供理論基礎和生產指導。
1" 材料與方法
1.1" 儀器及試劑
島津LC-20AT高效液相色譜儀(包括LCsoLution色譜管理處理軟件、CTO-20A柱溫箱、SIL-20A自動進樣器、SPD-M20A二極管陣列檢測器、CBM-20Alite系統控制器);METTLER AL104型電子天平、MoLecuLar標準智能型純水機、KQ-1000DE型數控超聲波清洗器。
水為臨用現制的超純水;甲醇(分析純,天津市化學試劑廠);乙醇(分析純,天津市化學試劑廠);乙腈(色譜純,美國Tedia公司);甲醇(色譜純,美國Tedia公司)。梔子苷對照品(批號PS010461,純度99.6%)購自成都普思生物科技股份有限公司;西紅花苷-Ⅰ對照品(批號111588-201704,純度88.4%)、西紅花苷-Ⅱ對照品(批號11589-201705,純度92.2%),均購自中國食品藥品檢定研究院。
1.2" 供試材料
梔子樣品包括項目組優選并已審定的梔子良種渝梔1號、渝梔2號、渝梔3號無性系梔子,以及有性繁殖的混雜梔子。經重慶市藥物種植研究所胡開治研究員鑒定原植物為梔子(Gardenia jasminoides Ellis)。
1.3" 試驗設計及樣品采集
所有梔子樣品均采自重慶市南川區三泉鎮梔子栽培基地(E107.2°,N29.1°),試驗點為肥力適中的砂壤土,采用耕地機松土、整平。按照株行距1.3 m×1.7 m種植,各品系及混合梔子采用相同方法管理,每年人工除草2次,均不噴灑農藥和施用化肥。
單一樣品的采集:分別隨機選取每個品系無性系植株5株,每株隨機摘取20顆梔子果實,混勻作為一個樣品,3次重復。混合樣品為栽培基地有性繁殖的混雜梔子,隨機選取5株有性繁殖的梔子植株,每株隨機采集20顆梔子果實,再將果實混勻為1個樣品,3次重復。各梔子樣品均先蒸制13 min [16],再分別采用40、50、60、70、80、90 ℃烘干。烘干過程中每隔4 h稱一次質量,同時記錄各溫度下梔子烘干所需時間。烘干后,全部粉碎、混勻,過4號篩,稱樣檢測梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ含量,每個樣品稱取3個重復,最后取平均值。
1.4" 各品系梔子樣品農藝性狀測定與描述
樣品采集后立即進行外觀形態特征描述,測定鮮質量和果實大小。
1.5" 指標成分檢測方法學考察及樣品測定
1.5.1" 色譜條件
梔子苷:色譜柱Diamonsi LC18 (4.6 mm×250 mm,5 μm) ;流動相乙腈-水 (15∶85) ;柱溫30 ℃;檢測波長238 nm;流速1. 0 mL·min-1,進樣量5 μL。
西紅花苷-Ⅰ和西紅花苷-Ⅱ:色譜柱Diamonsi LC18 (4.6 mm×250 mm,5 μm) ;流動相甲醇(色譜純)-水(45︰55) ;柱溫30 ℃;檢測波長440 nm;流速1. 0 mL·min-1,進樣量10 μL。
1.5.2" 對照品及供試品溶液的制備
對照品溶液的制備:精密稱取梔子苷和西紅花苷-Ⅰ和西紅花苷-Ⅱ對照品適量,用甲醇(分析純)溶解并定容,制得梔子苷質量濃度分別為0.404 g·L-1、0.189 g·L-1及西紅花苷-Ⅰ、西紅花苷-Ⅱ質量濃度分別為0.205 g·L-1、0.05 g·L-1的對照品溶液。
梔子苷供試品溶液的制備:取樣品粉末0.1 g,精密稱量,置具塞錐形瓶中,加入73%甲醇(分析純)15 mL,稱定質量,超聲處理30 min,待錐形瓶外表面干燥后,再稱定質量,用73%甲醇補足失重,搖勻,過濾,取續濾液,即得。
西紅花苷-Ⅰ及西紅花苷-Ⅱ供試品溶液的制備:取樣品粉末0.1 g,精密稱量,置具塞錐形瓶中,加入40%乙醇35 mL,稱定質量,超聲處理20 min,待錐形瓶外表面干燥后,再稱定質量,用40%乙醇補足失重,搖勻,過濾,取續濾液,即得。
1.5.3" 線性關系考察
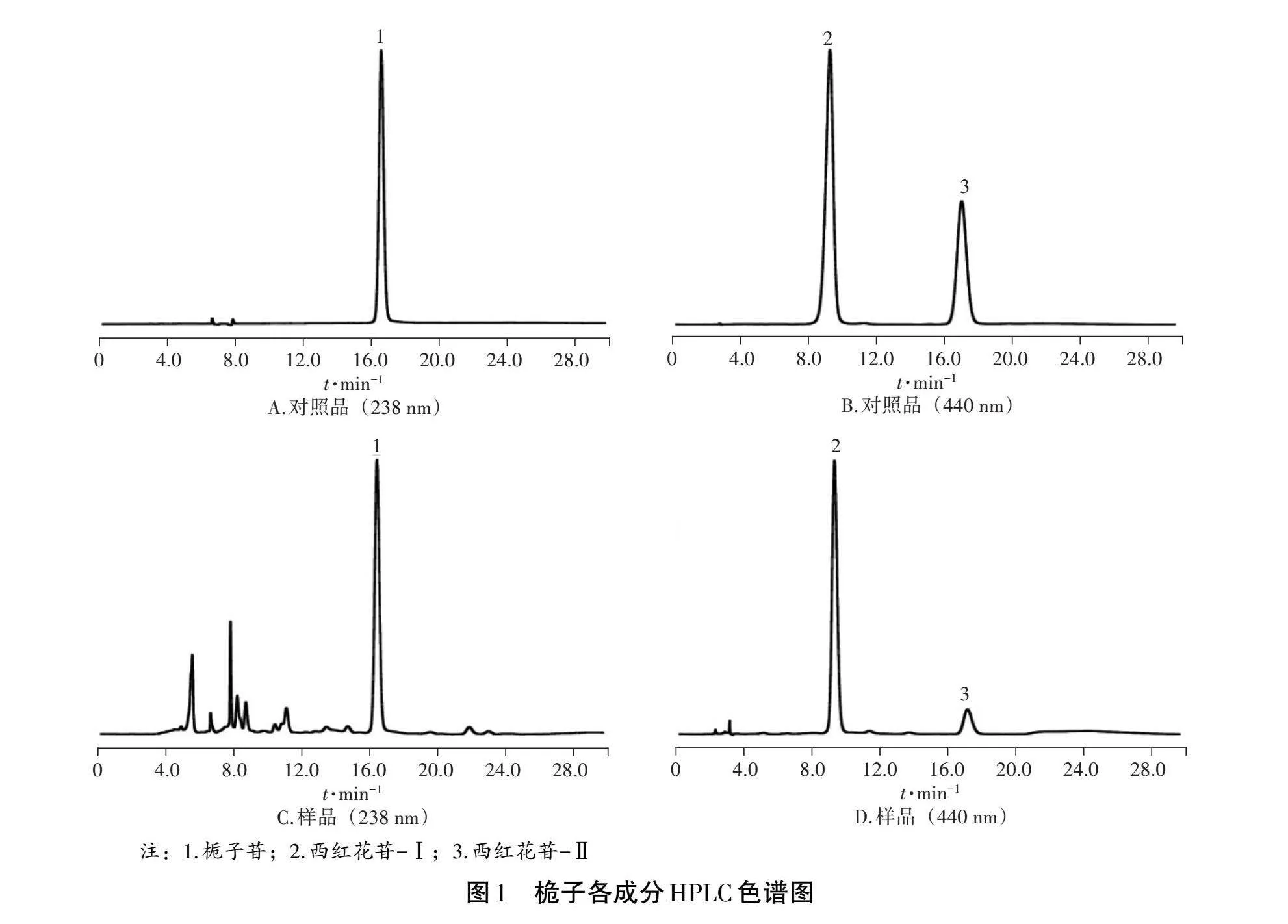
分別精密吸取不同質量濃度的混合對照品溶液10 μL,在1.5.1條件下測定,以峰面積為縱坐標,進樣量為橫坐標,進行回歸,得梔子苷、西紅花苷-Ⅰ、西紅花苷-Ⅱ的回歸方程分別為Y=1 393 826.904 1X-424 051.082 2(r=0.998 1);Y=6 427 572.142 9X +6 713.019 0(r=0.999 8);Y=7 517 001.428 6X-13 160.171 4(r = 0.999 6)。表明梔子苷、西紅花苷-Ⅰ、西紅花苷-Ⅱ分別在30~330、4~44、2~22 μg·mL-1范圍內線性關系良好。色譜圖見圖1。
1.5.4" 精密度試驗
分別吸取梔子苷對照品5 μL,西紅花苷-Ⅰ和西紅花苷-Ⅱ的混合對照品10 μL,重復進樣6次,記錄峰面積。梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ的峰面積RSD分別為0.21%、1.18%和0.74%,表明儀器精密度良好。
1.5.5" 重復性試驗
精密稱定同一樣品,按1.5.2制備供試品溶液6份。梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ樣品按1.5.1的色譜條件進樣檢測,記錄峰面積,梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ的含量RSD分別為1.54%、1.20%和1.73%,表明該方法重復性良好。
1.5.6" 穩定性試驗
分別取梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ供試品溶液1份,在0、2、4、8、12、24 h進行檢測,記錄峰面積。梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ的峰面積RSD分別為0.74%、0.39%和0.40%。表明三者供試品溶液在24 h內穩定。
1.5.7" 加樣回收率試驗
精密稱取已知梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ含量的梔子樣品0.05 g,共6份。根據其含量,分別等量加入梔子苷對照品0.404 mg,西紅花苷-Ⅰ對照品0.615 mg和西紅花苷-Ⅱ對照品0.120 mg,在1.5.1色譜條件下進行檢測,測得梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ的平均回收率分別為98.95%、99.92%、99.44%;RSD分別為1.02%、1.12%和1.33%。
1.5.8" 樣品含量測定
取各供試梔子樣品的供試品溶液,按1.5.1項條件進行檢測,梔子苷檢測進樣5 μL,西紅花苷-Ⅰ和西紅花苷-Ⅱ檢測進樣10 μL,測定相應的峰面積,計算含量。
1.6" 數據處理
采用IBM SPSS Statistics 21軟件對結果進行相關性分析和顯著性比較;采用LSD法在p<0.05水平上進行差異顯著性檢驗,并利用Excel繪圖。
2" 結果與分析
2.1" 各品系梔子樣品農藝特征描述
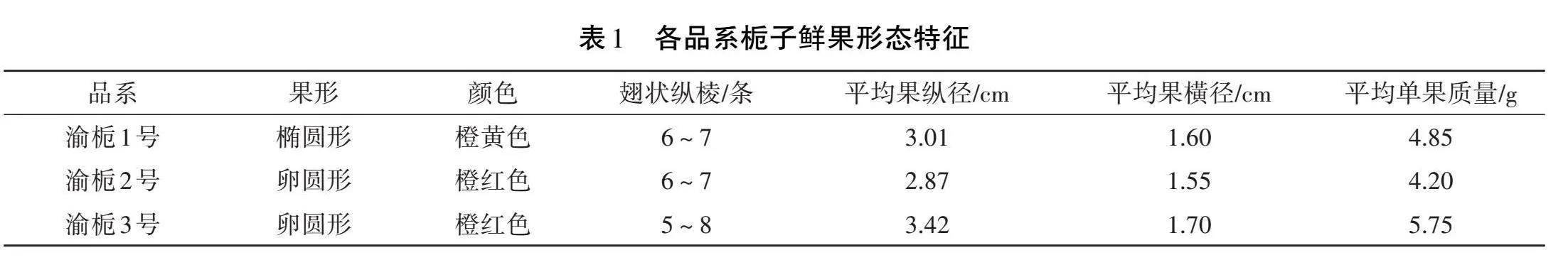
經檢測,各品系梔子鮮樣品形態特征存在一定差異,具體描述見表1。渝梔1號鮮果為橢圓形、橙黃色,渝梔2號、渝梔3號為卵圓形、橙紅色。平均縱、橫徑和單果質量趨勢一致,由大到小分別為渝梔3號>渝梔2號>渝梔1號。
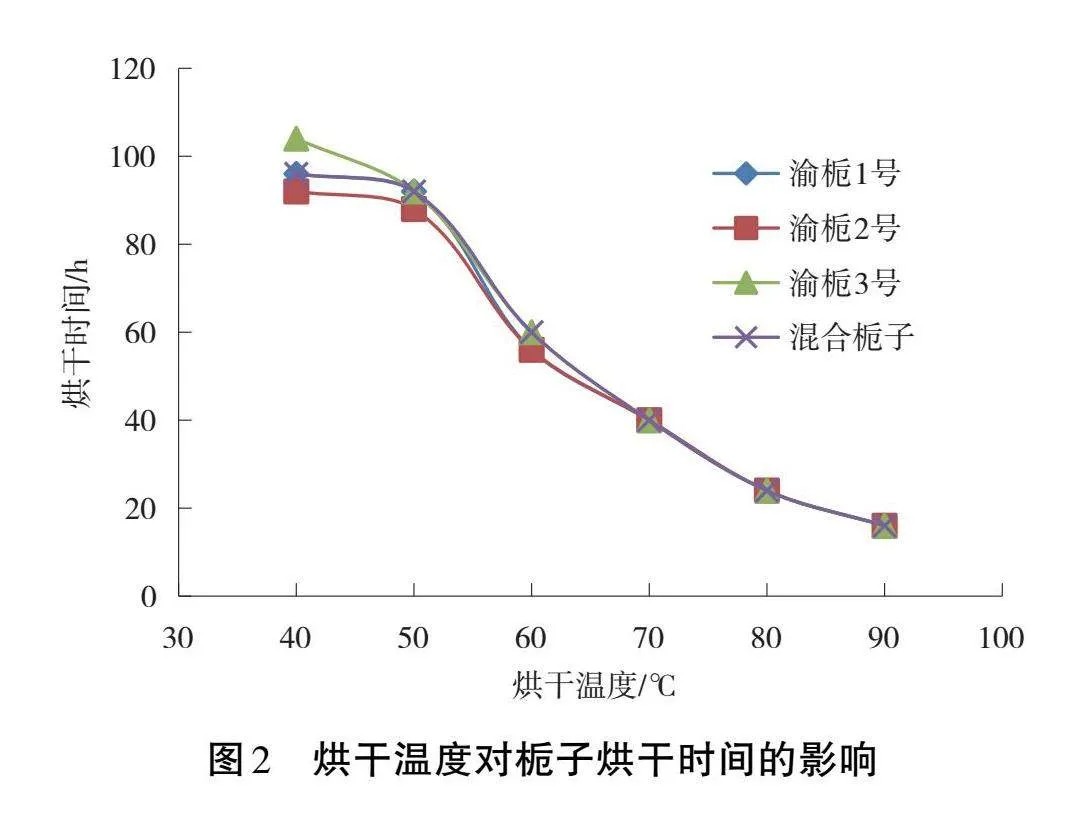
2.2" 烘干溫度對梔子烘干時間的影響
如圖2所示,各品系及混合梔子樣品烘干溫度與烘干所需時間變化趨勢基本一致。烘干時間與烘干溫度呈負相關,在40~90 ℃范圍內烘干溫度越高,烘干所需時間越短。渝梔1號、渝梔2號和混合梔子在40 ℃和50 ℃下烘干時間變化平緩,差異不大,而渝梔3號則差異較大。當烘干溫度由50 ℃逐漸升至90 ℃時,各樣品烘干所需時間急劇減少。
2.3" 烘干溫度對不同品系梔子的梔子苷含量影響
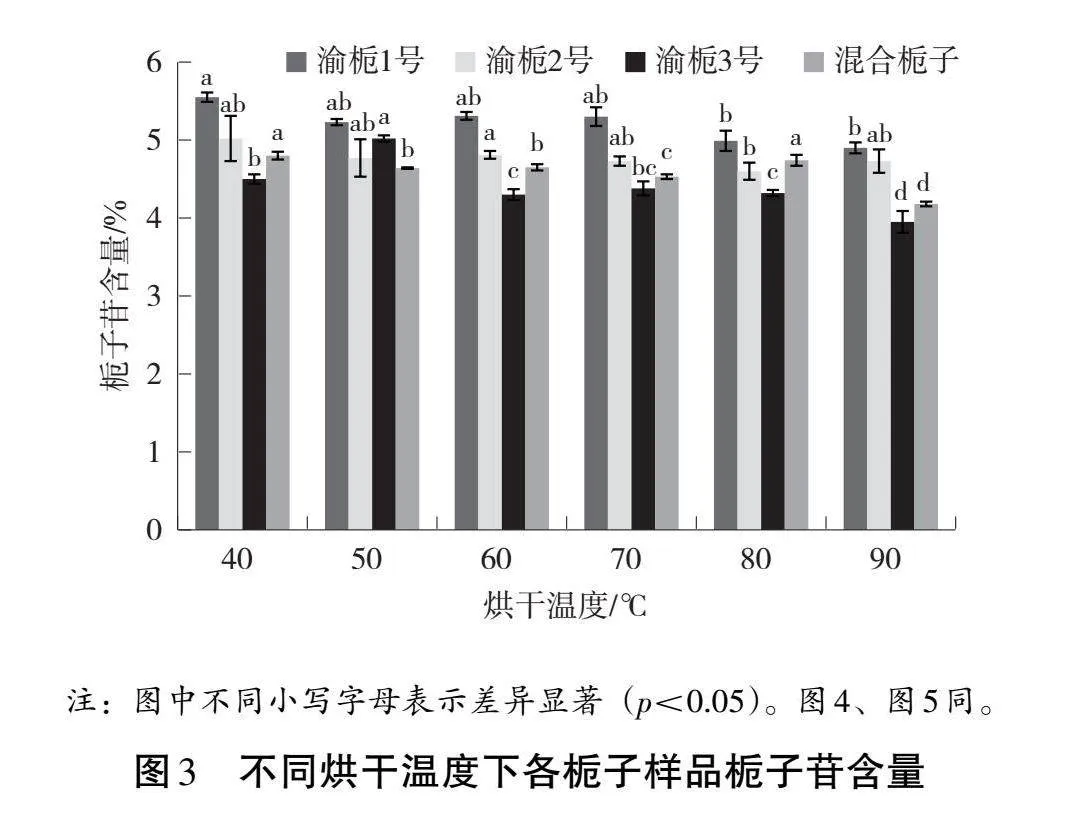
不同干燥溫度下不同品系梔子中梔子苷含量見圖3。結果顯示,試驗所用梔子品系渝梔1號、渝梔2號、渝梔3號及混合梔子樣品的梔子苷含量均符合藥典標準(>1.8%),不同品系梔子在不同的干燥溫度下其梔子苷含量差異顯著;不同品系梔子的梔子苷含量最高時烘干溫度不同,品系渝梔1號、渝梔2號、渝梔3號和混合梔子分別在烘干溫度40、40、50和40 ℃下烘干的梔子苷含量最高。
2.4" 烘干溫度對不同品系梔子西紅花苷-Ⅰ含量的影響
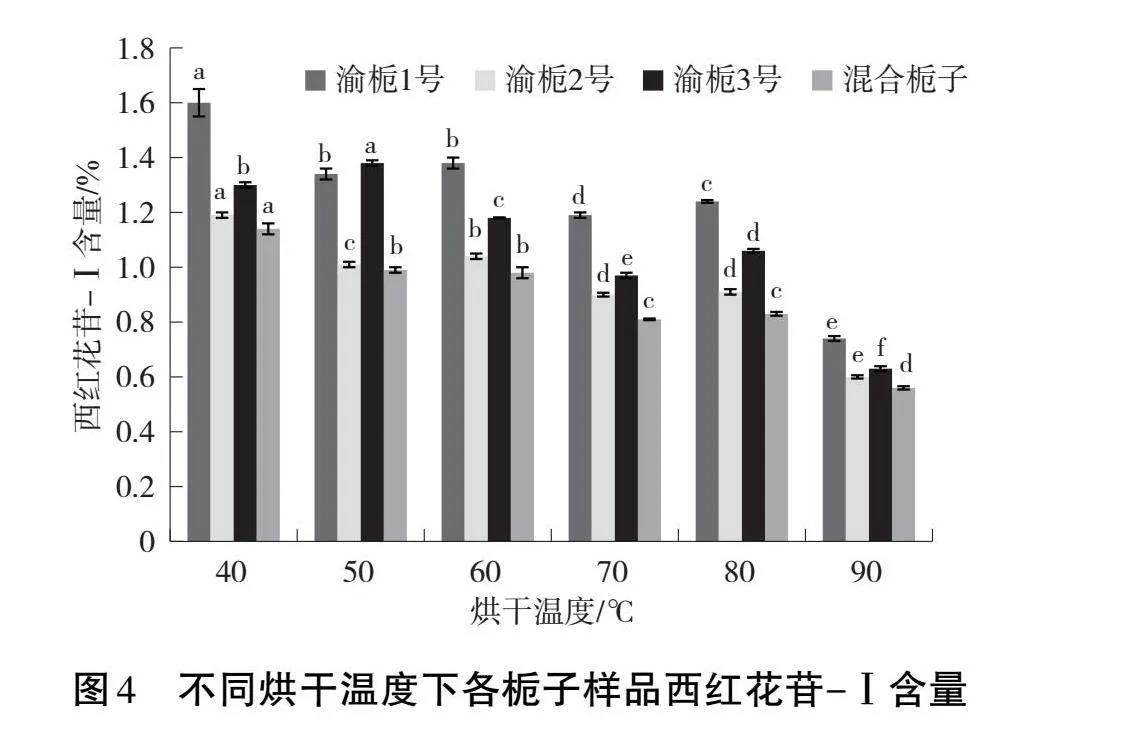
不同干燥溫度下不同品系梔子中西紅花苷-Ⅰ含量見圖4。結果顯示,不同品系梔子在不同的干燥溫度下其西紅花苷-Ⅰ含量差異顯著;品系渝梔1號、渝梔2號、渝梔3號和混合梔子分別在烘干溫度40、40、50和40 ℃下烘干西紅花苷-Ⅰ含量最高。隨著烘干溫度升高,西紅花苷-Ⅰ含量呈總體下降趨勢。說明高溫烘干可能會導致西紅花苷-Ⅰ揮發或降解。
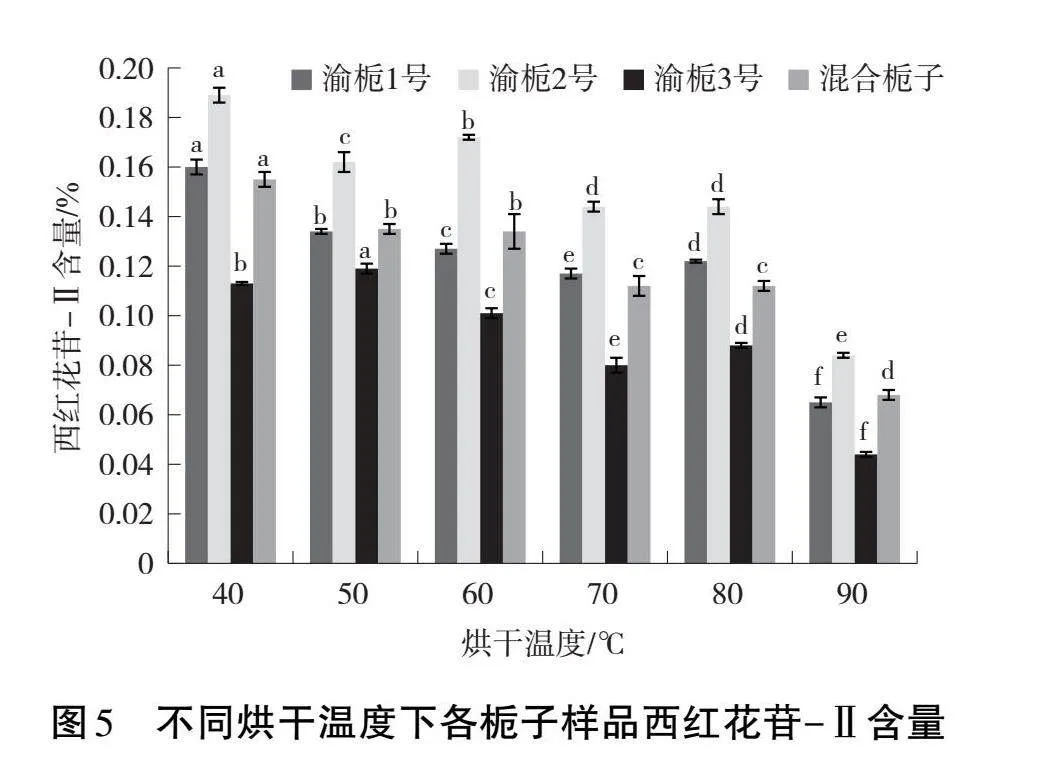
2.5" 烘干溫度對不同品系梔子西紅花苷-Ⅱ含量的影響
不同干燥溫度下不同品系梔子中西紅花苷-Ⅱ含量見圖5。結果顯示,與西紅花苷-Ⅰ含量變化趨勢一致,不同品系梔子在不同干燥溫度下其西紅花苷-Ⅱ含量差異顯著;品系渝梔1號、渝梔2號、渝梔3號和混合梔子分別在溫度40、40、50和40 ℃下烘干,西紅花苷-Ⅱ含量最高。隨著烘干溫度升高,西紅花苷-Ⅱ含量總體呈下降趨勢。說明高溫烘干可能會導致西紅花苷-Ⅱ揮發或降解。
2.6" 烘干溫度與梔子有效成分的相關性分析
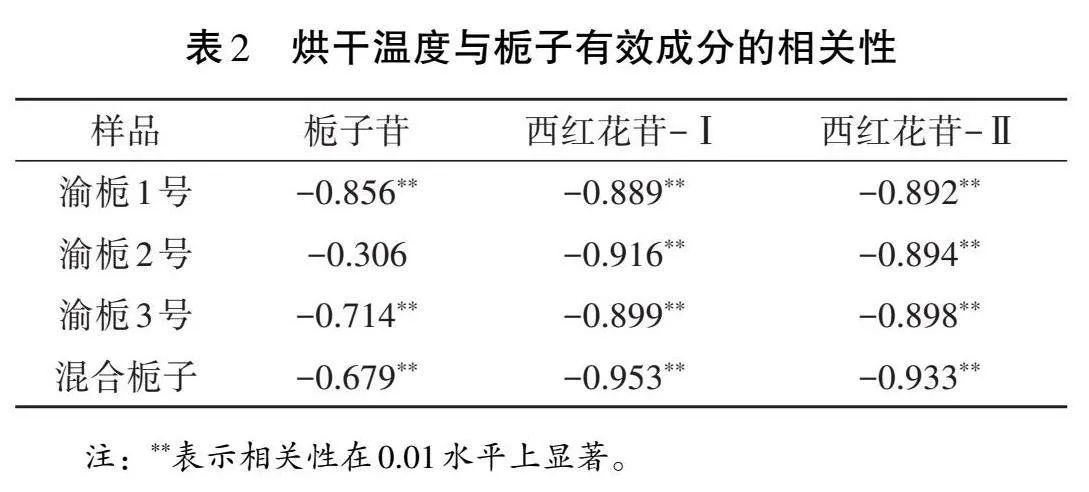
利用IBM SPSS Statistics 21軟件對烘干溫度與梔子有效成分含量做Pearson相關性分析,結果見表2。除渝梔2號的梔子苷含量與烘干溫度無顯著相關關系外,其余梔子樣品的梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ含量與烘干溫度均呈極顯著負相關(p<0.01)。
3" 討論與結論
3.1" 討論
梔子苷和西紅花苷是梔子的主要活性成分,其含量的高低直接影響梔子藥材品質。梔子產地初加工的主要目的是迅速脫水、殺酶保苷。前人研究表明,蒸制13 min是最佳的前處理方式[16]。本研究采用該方法進行殺酶處理,再研究烘干溫度對梔子有效成分含量的影響。結果表明,烘干溫度對梔子有效成分影響較大,不同品系梔子的最適烘干溫度存在差異。因此,在進行梔子品系間品質比較時應先進行預試驗,確定各品系梔子的最適烘干溫度,再進行各成分含量比較。
近年來關于梔子產地初加工方法的研究偶有報道,大多是關于混雜梔子炮制和干燥方法的研究[16-18],對單一品系梔子進行研究的報道鮮見。中藥材在干燥過程中受溫度影響極易引起外觀性狀和有效成分的轉變,直接影響到中藥材的藥用價值和經濟價值[19]。本研究首次以團隊優選出的優良單一品系梔子為樣品,探索烘干溫度對不同品系梔子有效成分的影響,發現各樣品的梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ含量與烘干溫度均呈極顯著負相關(p<0.01);不同品系梔子的最適烘干溫度存在一定的差異。其中渝梔1號、渝梔2號和混合梔子樣品的最適烘干溫度為40 ℃,這與《中國藥典》的規定一致;而渝梔3號則在50 ℃烘干時有效成分含量最高。各品系梔子樣品的最適烘干溫度不同與焦燕翔等報道的梔子果實的形態和大小與果內活性成分含量間存在顯著差異的結論一致[20]。結合本次研究梔子樣品的外觀形態特征來看,可能是由于渝梔3號比渝梔1號和渝梔2號的縱、橫徑和鮮質量都大得多,40 ℃烘干時,渝梔3號比另外3個樣品需要更多的時間才能烘干,增加了渝梔3號梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ的揮發或降解,從而降低了有效成分含量。而渝梔1號和渝梔2號及混合梔子樣品在40 ℃和50 ℃下烘干所需時間差異不大,因此,與在50 ℃下烘干相比,40 ℃下烘干的梔子苷、西紅花苷-Ⅰ和西紅花苷-Ⅱ的揮發量更少。本研究結果可為梔子的產地初加工提供一定參考。
3.2" 結論
烘干溫度對不同品系梔子有效成分含量影響較大,烘干溫度與各品系梔子有效成分呈極顯著負相關。不同品系梔子的最適烘干溫度存在一定差異,渝梔1號、渝梔2號及混合梔子的最適烘干溫度為40 ℃,而渝梔3號在50 ℃下烘干的有效成分含量最高。
參考文獻:
[1] 中國科學院中國植物志編輯委員會. 中國植物志[M]. 北京:科學出版社, 2019.
[2] 李海波, 馬金鳳, 龐倩倩,等. 梔子的化學成分研究[J]. 中草藥, 2020, 51(22):5687-5697.
[3] NI Y, LI L, ZHANG W Y, et al. Discovery and LC-MS characterization of new crocins in gardeniae fructus and their neuroprotective potential[J]. Journal of agricultural and food chemistry, 2017, 65(14):2936-2946.
[4] 付小梅, 王崢濤.梔子中的三萜類成分[J]. 中國實驗方劑學雜志,2011,17 (16):106-109.
[5] ZHOU X, CHEN C, YE X, et al. Study of separation and identification of the active ingredients in Gardenia jasminoides Ellis based on a two-dimensional liquid chromatography by coupling reversed phase liquid chromatography and hydrophilic interaction liquid chromatography[J]. Journal of chromatographic science, 2017, 55(1):75-81.
[6] 國家藥典委員會. 中華人民共和國藥典:一部[M]. 北京:中國醫藥科技出版社, 2020.
[7] ALI V, GHAIDAFEHh A, ALI S M, et al. Role of crocin in several cancer cell lines: An updated review[J]. Iranian journal of basic medical sciences, 2020, 23(1): 3-12.
[8] MEIOU D, Al-ODAINI A A, NADEGE F, et al. Erratum to: Cyclin D1 cooperates with p21 to regulate TGFβ-mediated breast cancer cell migration and tumor local invasion[J]. Breast cancer research, 2017, 19(1):43.
[9] E P N K, EIRINI C, NIKOLAOS K, et al. The cardiovascular-protective properties of saffron and its potential pharmaceutical applications: A critical appraisal of the literature[J]. Phytotherapy research, 2021,35(12):6735-6753.
[10] MOHAMMAD S, ALI R. Association between chronic stress and Alzheimer’s disease: Therapeutic effects of Saffron[J]. Biomedicine amp; Pharmacotherapy, 2021, 133: 110995.
[11] YARIBEYGI H, MOHAMMADI T M, SAHEBKAR A. Crocin potentiates antioxidant defense system and improves oxidative damage in liver tissue in diabetic rats[J]. Biomedicine amp; Pharmacotherapy, 2018, 98: 333-337.
[12] 趙淑杰, 魯靜, 陳德昌. HPLC法測定梔子產地加工炮制品酶解前后梔子甙含量[J]. 中草藥, 1995(4): 182, 192.
[13] 馬新, 陶巧鳳. 不同炮制方法對梔子有關成分的影響[J]. 中國現代應用藥學, 1998(3): 19-20.
[14] 王莉. 梔子最佳采收期及聯合干燥對其黃色素含量的影響研究[D]. 福州:福建農林大學, 2016.
[15] 羅靜玲, 張湘龍, 曾建國,等. 不同成熟度和產地初加工方法對梔子中4種活性成分含量的影響[J]. 食品工業科技, 2021, 42(13): 241-246.
[16] 梁獻葵, 王艷慧, 雷敬衛,等. 不同產地加工炮制方法對梔子質量的影響[J].中國中藥雜志, 2018, 43(16): 3285-3290.
[17] 劉濤, 郭曉恒, 徐玉玲,等. 不同采收時間及產地加工方法對梔子質量的影響[J]. 中國中藥雜志, 2012, 37(13): 1932-1934.
[18] 王小浩, 朱邵晴, 谷巍,等. 梔子藥材不同干燥方法水分動態過程模擬及其對多元活性成分的影響[J]. 食品工業科技, 2019, 40(12): 51-57,64.
[19] 喻芬, 萬娜, 李遠輝,等. 中藥材干燥過程中的理化性質變化規律與機制分析[J]. 中草藥, 2021, 52(7): 2144-2153.
[20] 焦雁翔, 唐正中, 唐玉琴,等. 不同葉果型梔子植株果內梔子苷和西紅花苷含量分析[J]. 經濟林研究, 2017, 35(3): 193-198.
(責任編輯:敬廷桃)

