血清HIF-1α、HO-1和sFlt-1對妊娠期肝內膽汁淤積癥患者胎兒宮內缺氧的診斷價值
陳芝逸,何雨婷,洪小丹
復旦大學附屬婦產科醫院產科,上海 200090
妊娠期肝內膽汁淤積癥(ICP)常發生在妊娠中晚期,患者可出現肝功能異常、皮膚瘙癢、惡心嘔吐和厭食等表現。如果沒有采取積極干預,ICP會導致胎兒宮內窘迫、早產和宮內胎兒生長受限等母嬰不良結局的發生[1]。早期發現母嬰結局不良的危險因素,如引起宮內胎兒缺氧的風險信號,可對早期相應干預措施的制訂起到積極作用。ICP具體發病機制仍不清楚,現已知缺氧誘導因子1α(HIF-1α)是調節氧平衡的關鍵轉錄調控因子,與胎盤的形成具有密切聯系,影響胎盤的血管重建[2]。血紅素加氧酶-1(HO-1)基因是HIF-1α基因下游的靶基因,在防止血管平滑肌過度增生、抑制血小板聚集和抗凋亡等方面具有重要作用[3]。缺氧狀態下滋養細胞表達的可溶性血管內皮生長因子受體-1(sFlt-1)水平明顯升高,導致胎盤血管形成異常和滋養細胞損傷[4]。本研究通過檢測ICP患者血清HIF-1α、HO-1和sFlt-1水平,觀察其在ICP胎兒宮內缺氧的診斷價值。
1 資料與方法
1.1一般資料 選擇2020年1月至2022年12月在本院診治的148例ICP患者納入ICP組,患者年齡23~43歲、平均(28.57±4.52)歲,孕周37~42周、平均(39.35±1.33)周,孕次1~3次、平均(1.39±0.50)次。納入標準:均符合ICP的診斷標準[5];單胎妊娠。排除標準:多胎妊娠;子宮先天畸形或者胎位不正;合并血液系統和免疫系統疾病;輔助生殖;合并心、肝、腎等重要臟器功能不全;臨床資料不完整;存在智力低下或者精神性疾病。選擇同期本院66例健康孕婦納入正常妊娠組,研究對象年齡23~43歲、平均(28.64±3.94)歲,孕周37~42周、平均(39.68±1.36)周,孕次1~3次、平均(1.30±0.50)次。兩組的年齡、孕周和孕次等基線資料比較,差異無統計學意義(P>0.05),具有可比性。所有患者均簽署知情同意書,本研究經醫院倫理委員會審核通過(審批號:1999-fccyy-00367)。
1.2方法
1.2.1血液標本留取和檢測 入院后抽取研究對象空腹清晨靜脈血約5 mL,采用血凝儀測定活化部分凝血活酶時間、凝血酶原時間和凝血酶時間。采用全自動生化儀測定天門冬氨酸氨基轉移酶(AST)、丙氨酸氨基轉移酶(ALT)、總膽紅素、直接膽紅素、間接膽紅素、總膽汁酸和甘氨酸。血清HIF-1α、HO-1和sFlt-1水平采用酶聯免疫吸附試驗進行測定。所有試劑盒購自上海聯祖生物科技有限公司,嚴格按照試劑盒說明書進行操作。分娩出嬰兒后,快速將臍帶鉗夾,用含肝素針管抽取臍動脈血,用軟木塞封閉后采用血氣分析儀測定pH值、二氧化碳分壓(PCO2)和氧分壓(PO2)。
1.2.2分組 ICP嚴重程度分組[6]:根據總膽汁酸水平將患者分為3組:孕婦的總膽汁酸水平10~<40 μmol/L為輕度組;總膽汁酸水平40~<100 μmol/L為重度組;總膽汁酸水平≥100 μmol/L為極重度組。胎兒宮內缺氧分組[7]:根據是否發生胎兒宮內缺氧分為宮內缺氧組和無宮內缺氧組。符合下列之一就可以診斷胎兒宮內缺氧:胎兒心率>160次/分或者<120次/分;基線胎兒心率無變異,反復出現晚期減速或者變異減速;胎心監護宮縮應激試驗或者縮宮素激惹試驗陽性;胎兒出生后1 min Apgar評分≤7分;頭皮血氣分析結果為酸中毒。
1.3觀察指標 觀察ICP組和正常妊娠組血清HIF-1α、HO-1和sFlt-1水平的變化,分析胎兒宮內缺氧的影響因素,分析血清HIF-1α、HO-1和sFlt-1水平變化與ICP患者嚴重程度的關系,比較宮內缺氧組和無宮內缺氧組臍帶血的血氣分析結果,分析血清HIF-1α、HO-1和sFlt-1對ICP患者發生胎兒宮內缺氧的診斷效能。
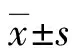
2 結 果
2.1ICP組與正常妊娠組血清HIF-1α、HO-1和sFlt-1水平比較 ICP組血清HIF-1α和sFlt-1水平明顯高于正常妊娠組(P<0.01),而血清HO-1水平明顯低于正常妊娠組(P<0.01)。見表1。

表1 ICP組與正常妊娠組血清HIF-1α、HO-1和sFlt-1水平比較
2.2不同ICP嚴重程度組血清HIF-1α、HO-1和sFlt-1水平比較 根據ICP嚴重程度將患者分為輕度組(76例)、重度組(56例)和極重度組(16例)。極重度組血清HIF-1α和sFlt-1水平明顯高于輕度組和重度組(P<0.01),重度組明顯高于輕度組(P<0.01);而極重度組血清HO-1水平明顯低于輕度組和重度組(P<0.01),重度組明顯低于輕度組(P<0.01)。見表2。

表2 不同ICP嚴重程度組血清HIF-1α、HO-1和sFlt-1水平比較
2.3宮內缺氧組和無宮內缺氧組臍帶血血氣分析結果比較 根據ICP患者是否發生胎兒宮內缺氧分為宮內缺氧組(62例)和無宮內缺氧組(86例)。兩組臍帶血pH值、PCO2和PO2水平比較,差異無統計學意義(P>0.05)。見表3。

表3 兩組臍帶血血氣分析結果比較
2.4宮內缺氧組和無宮內缺氧組臨床資料比較 內缺氧組的直接膽紅素、間接膽紅素、總膽汁酸、甘膽酸、HIF-1α和sFlt-1水平明顯高于無宮內缺氧組(P<0.01),凝血酶原時間、活化部分凝血活酶時間長于無宮內缺氧組(P<0.01),血清HO-1水平明顯低于無宮內缺氧組(P<0.01)。兩組年齡、孕周、分娩次數、體質量指數(BMI)、ALT、AST、總膽紅素和凝血酶時間比較,差異無統計學意義(P>0.05)。見表4。

表4 宮內缺氧組和無宮內缺氧組臨床資料比較
2.5ICP患者發生宮內缺氧影響因素的多因素Logistic回歸分析 將單因素分析中差異有統計學意義的指標直接膽紅素(≥11.27 μmol/L=1,<11.27 μmol/L=0)、間接膽紅素(≥30.40 μmol/L=1,<30.40 μmol/L=0)、總膽汁酸(≥53.30 μmol/L=1,<53.30 μmol/L=0)、甘膽酸(≥6.92 mg/L=1,<6.92 mg/L=0)、凝血酶原時間(≥20.27 s=1,<20.27 s=0)、活化部分凝血活酶時間(≥46.84 s=1,<46.84 s=0)、HIF-1α(≥71.54 ng/mL=1,<71.54 ng/mL=0)、HO-1(≥351.84 ng/mL=0,<351.84 ng/mL=1)和sFlt-1(≥27.58 μg/L=1,<27.58 μg/L=0)進行賦值,根據是否發生宮內缺氧進行多因素Logistic回歸分析。結果發現,直接膽紅素、HIF-1α和sFlt-1水平升高,HO-1水平降低是宮內缺氧的獨立危險因素(P<0.05)。見表5。

表5 ICP患者發生宮內缺氧影響因素的多因素Logistic回歸分析
2.6血清HIF-1α、HO-1和sFlt-1診斷ICP患者發生宮內缺氧的效能 根據ICP患者是否發生宮內缺氧進行多因素Logistic回歸分析,得方程Y=0.16×XHIF-1α-0.03×XHO-1+0.36×XsFlt-1-12.36為聯合檢測指標,其聯合檢測的靈敏度為96.8%,特異度為88.4%,曲線下面積(AUC)為0.969,明顯高于單個指標HIF-1α(Z=3.294,P<0.001)、HO-1(Z=4.841,P<0.001)和sFlt-1(Z=3.602,P<0.001)檢測,而3項指標之間AUC比較,差異無統計學意義(P>0.05)。見圖1、表6。

圖1 血清HIF-1α、HO-1和sFlt-1診斷ICP患者發生宮內缺氧的ROC曲線

表6 血清HIF-1α、HO-1和sFlt-1水平診斷ICP患者發生宮內缺氧的效能
3 討 論
ICP患者體內膽汁集聚導致干細胞損傷,直接影響母嬰的安全,該病最常見的并發癥是胎兒宮內窘迫,其發生率為3%~20%,明顯高于健康孕婦。胎兒出現輕度缺氧會導致體內兒茶酚胺水平升高,引起胎兒心率加快[8];如果缺氧持續存在會引起迷走神經興奮,導致心率減慢,同時無氧酵解增加體內酸中毒風險,導致大腦和心臟等器官的損傷[9]。因此,早期了解ICP患者是否發生胎兒宮內窘迫對于保障孕婦和胎兒的生命安全十分重要。雖然總膽汁酸異常對判斷新生兒結局有一定的價值,但由于其特異度較低,在臨床應用方面仍有局限性。血清學指標是近年來備受關注的檢測技術,對多種疾病診斷、預后判斷均有一定優勢,并且具有操作簡單、創傷性小和可以重復等優勢。本研究發現宮內缺氧組和無宮內缺氧組的血氣分析指標比較,差異無統計學意義(P>0.05),通過單因素分析發現,宮內缺氧組的直接膽紅素、間接膽紅素、總膽汁酸、甘膽酸、HIF-1α和sFlt-1水平明顯高于無宮內缺氧組,凝血酶原時間、活化部分凝血活酶時間長于無宮內缺氧組,血清HO-1水平低于無宮內缺氧組。多因素Logistic回歸分析發現,直接膽紅素、HIF-1α和sFlt-1水平升高,HO-1水平降低是宮內缺氧的獨立危險因素。
本研究結果顯示,ICP組血清HIF-1α水平明顯高于正常妊娠組,并且隨著ICP嚴重程度的升高而升高,說明HIF-1α參與了疾病的發生、發展過程,HIF-1α是反映ICP嚴重程度的指標。現已知HIF-1α是人體唯一能夠對氧濃度進行調控的亞單位,在機體缺氧應答中保持機體的正常功能[10]。HIF-1α在發生先兆子癇孕婦的胎盤中呈高表達,這種高表達可以通過誘導凋亡的方式來抵抗缺氧的發生。HIF-1α的高表達可能與HIF-1α的下游基因功能異常有關,導致機體無氧代謝增加,最終引起酸中毒的發生[11]。本研究結果顯示,宮內缺氧組血清HIF-1α水平明顯高于無宮內缺氧組,血清HIF-1α水平升高是宮內缺氧發生的危險因素,說明HIF-1α是宮內缺氧的重要影響因子。本研究結果顯示,血清HIF-1α為70.03 ng/mL時,診斷ICP患者發生宮內缺氧的靈敏度為90.3%,特異度為73.3%,AUC為0.878,說明血清HIF-1α對ICP患者發生宮內缺氧具有較高的診斷效能。
本研究結果顯示,ICP組血清HO-1水平明顯低于正常妊娠組,并且隨著ICP患者嚴重程度升高而降低,說明血清HO-1水平越低ICP病情越嚴重,HO-1與ICP的發生、發展具有一定的聯系。一項對ICP患者的胎盤組織進行免疫組化檢測的研究發現,胎盤組織的HO-1水平隨著ICP嚴重程度升高而降低,認為HO-1可能作為一種內源性的物質保護胎盤組織免受氧化損傷,對妊娠維持起到重要作用,其水平下降是ICP發病的重要原因[12]。本研究結果顯示,宮內缺氧組血清HO-1水平明顯低于無宮內缺氧組,多因素Logistic回歸分析發現血清HO-1水平下降是發生ICP的危險因素。HO-1在機體氧化應激的條件下表達明顯增加,是一種內源性細胞保護蛋白質,具有明顯的抗氧化應激和抑制炎癥的作用[13]。HO-1是血管內皮的保護因子,隨著ICP病情加重,HIF-1α表達顯著增高,而HO-1是HIF-1α下游的靶基因,其表達顯著降低,這可能與HIF-1α抑制HO-1表達有關,故二者均參與了血管內皮和滋養細胞損傷的過程[14]。本研究結果顯示,血清HO-1為357.06 ng/mL時,診斷ICP患者發生胎兒宮內缺氧的靈敏度為87.1%,特異度為67.4%,AUC為0.816,說明血清HO-1是診斷胎兒宮內缺氧的靈敏指標。
本研究結果顯示,ICP組血清sFlt-1水平明顯高于正常妊娠組,并且隨著ICP嚴重程度的升高而升高,說明sFlt-1也是反映ICP嚴重程度的重要指標。胎盤在缺氧的狀態下會產生多種細胞損傷因子,能夠引起血管內皮損傷和血管痙攣,其中sFlt-1是缺氧引起胎盤缺氧損傷的因子[15]。本研究結果顯示,宮內缺氧組血清sFlt-1水平明顯高于無宮內缺氧組,多因素Logistic回歸分析發現血清sFlt-1水平升高是發生宮內缺氧的危險因素,說明血清sFlt-1是能夠反映宮內缺氧程度的指標。sFlt-1的生物學作用是抑制血管內皮細胞因子的表達,導致血管內皮細胞激活,釋放大量的細胞因子,引起炎癥反應和血管內皮損傷[16],以及孕期各種并發癥如高血壓和蛋白尿等的發生。因此,研究認為sFlt-1是引起孕期子癇的始動因子[17]。本研究發現,血清sFlt-1為25.55 μg/L時,診斷ICP患者發生胎兒宮內缺氧的靈敏度為93.5%,特異度為68.6%,AUC為0.870,說明血清sFlt-1對ICP患者發生宮內缺氧具有較高的診斷效能。本研究還發現HIF-1α、HO-1和sFlt-1聯合檢測對ICP患者發生宮內缺氧具有更高的診斷效能,其靈敏度為96.8%,特異度為88.4%,AUC為0.969,明顯高于單個指標的AUC,說明3項指標具有某種互補性,聯合檢測能夠提高診斷效能,但指標之間的確切關聯仍需要進一步研究。
綜上所述,HIF-1α、HO-1和sFlt-1是反映ICP患者嚴重程度和胎兒宮內缺氧的指標,三者聯合檢測有利于提高對胎兒宮內缺氧的診斷效能。

