帕金森病患者外周鐵代謝與炎癥因子、臨床癥狀及病情嚴重程度的相關性研究
姚亞妮, 羅鑫宇, 馮婷婷, 王子豪, 夏 歡, 楊新玲
(1新疆醫科大學第一附屬醫院綜合內四科, 烏魯木齊 830011; 2新疆神經系統疾病研究重點實驗室, 烏魯木齊 830063;3新疆醫科大學, 烏魯木齊 830017)
帕金森病(PD)是一種中老年人常見的中樞神經系統錐體外系疾病。研究表明,鐵沉積可能與鐵代謝相關表達蛋白異常相關[1];鐵轉運蛋白二價金屬離子轉運體1(DMT1)在腦內黑質區表達升高,膜鐵轉運蛋白 1(FPN1)在腦內黑質區表達下降導致了該區域大量鐵沉積[2]。6-羥基多巴胺(6-OHDA)和1-甲基-4-苯基-1,2,3,6-四氫吡啶(MPTP)誘導的PD模型鼠中發現DMT1在黑質區表達增加,FPN1在PD模型鼠腦內黑質鐵異常部位表達下降導致了該區域鐵的選擇性聚集[1-2]。提示PD黑質鐵沉積與鐵代謝的關鍵調節蛋白DMT1和FPN1異常有關。PD尸檢結果顯示,鐵蛋白水平可反映小膠質細胞鐵儲存能力[3]。小膠質細胞在介導神經炎癥反應的同時也參與調節鐵代謝,炎癥刺激可調節DMT1和FPN1蛋白的表達;DMT1和FPN1蛋白也可激活小膠質細胞的活性,釋放白細胞介素-1β(IL-1β)、白細胞介素-6(IL-6)及腫瘤細胞壞死因子-α(TNF-α),對神經元細胞產生損害[4]。提示鐵代謝相關調節蛋白異常表達和神經炎癥交互作用可能引起了黑質鐵沉積,造成了DA能神經元的損傷。本研究通過檢測PD患者血清鐵、鐵蛋白(DMT1和FPN1蛋白)、炎癥因子(IL-1β、 IL-6 及TNF-α),分析鐵代謝與PD患者炎癥因子、臨床癥狀及病情嚴重程度的相關性,為后續鐵代謝和神經炎癥交互作用引起PD腦內鐵沉積發病機制研究提供臨床依據。
1 資料與方法
1.1 研究對象選擇2022年5月至2023年5月在新疆醫科大學第一、二附屬醫院就診50例PD患者(PD組)和50例健康體檢者(對照組)。納入標準:PD患者均由兩位神經內科副主任醫師根據英國PD協會腦庫和2016年中國帕金森病診斷標準[5]確診為PD,并進行PD相關運動癥狀評分[帕金森病量表III(UPDRSIII)]及非運動癥狀評分[Hoehn-Yahr(H-Y)分期、漢密頓焦慮量表(HAMA)、漢密頓抑郁量表(HAMD)、簡易精神狀態評價量表(MMSE)及蒙特利爾認知評估量表(MoCA)][6-7];對照組選擇年齡、性別、生活方式等與PD組相匹配健康體檢者。排除標準:帕金森病疊加綜合征及繼發的帕金森病綜合征;精神病史及其他神經系統疾病;各種原因引起的貧血,如缺鐵性貧血、遺傳性血色素沉著病;服用鐵補充劑患者;患有急性心衰、急性腦梗等嚴重心腦血管疾病、自身免疫性疾病、肝臟疾病、慢性腎臟疾病及惡性腫瘤的患者;過去6個月內嚴重失血或獻血者;合并急慢性感染者。
1.2 研究方法
1.1.1 血清制備 在普通真空采血管中從病例和對照中收集 5 mL空腹外周靜脈血。血樣在室溫下靜置 30 min,然后以 2 800 rpm 的轉速離心5 min。分離血清并于-20℃保存。
1.1.2 試劑盒 鐵試劑盒(武漢伊萊瑞特生物科技股份有限公司);DMT1試劑盒、FPN1試劑盒、IL-1β試劑盒、IL-6 試劑盒、TNF-α試劑盒測定(上海江萊生物科技有限公司)。
1.2.3 實驗方法 將血清梯度稀釋后采用酶聯免疫吸附試驗檢測血清鐵、DMT1、FPN1、IL-1β、IL-6、TNF-α確定最佳血清稀釋濃度。分別取50 μL和100 μL血清稀釋成2倍后進行IL-6、血清鐵水平測試。取20 μL血清稀釋成5倍后按照制造商的說明書進行DMT1、FPN1、IL-1β、TNF-α水平檢測。其中血清鐵在酶標儀593 nm波長處測定各孔OD值,DMT1、FPN1、IL-1β、TNF-α、IL-6在酶標儀450 nm波長處測定各孔OD值。
2 結果
2.1 兩組一般資料比較共納入研究對象100例,其中PD組50例,平均年齡(67.6±11.50)歲,男性28人(56%),女性22人(44%),對照組50例,男性20人(40%),女性30人(60%),平均年齡(66.4±8.90)歲。兩組一般資料比較,差異無統計學意義(P>0.05),見表1。
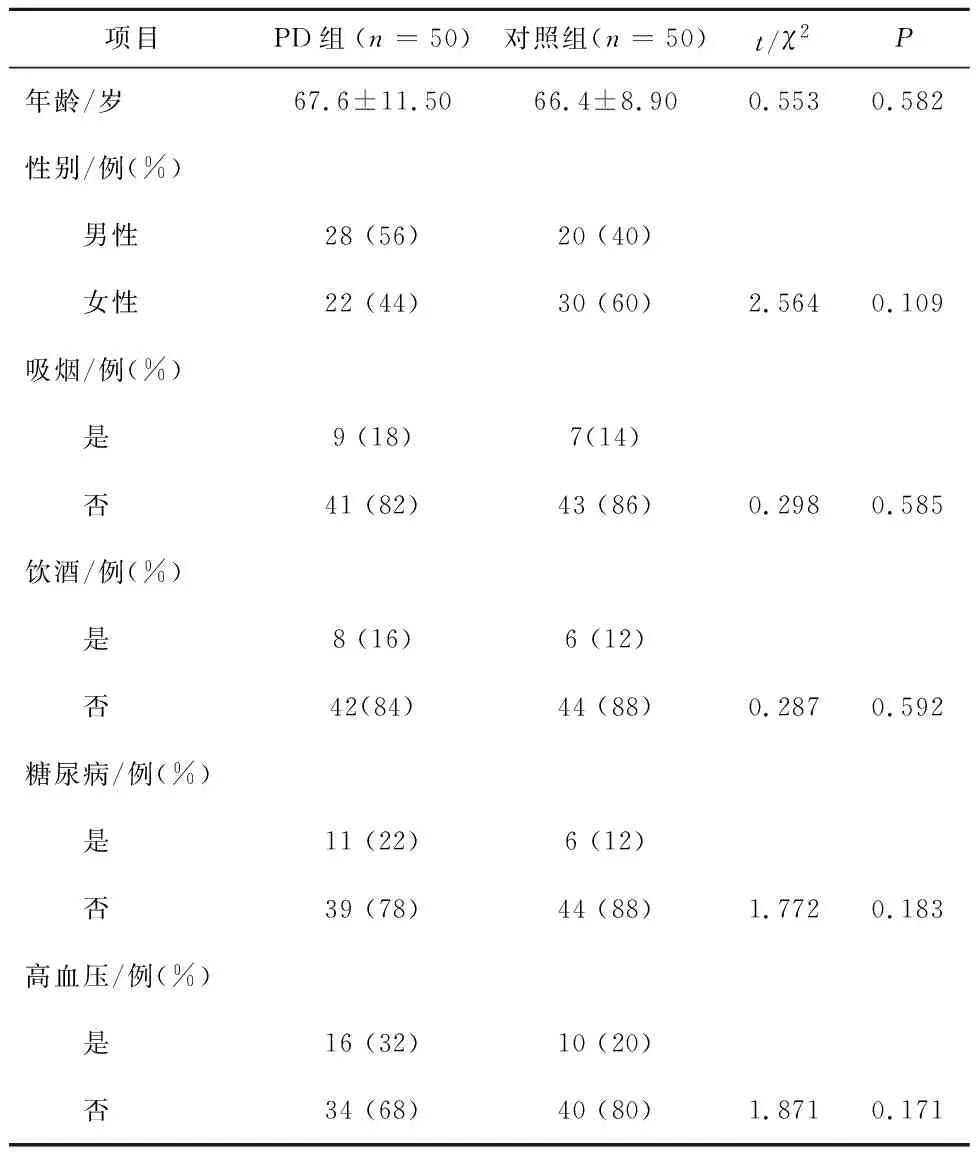
表1 兩組一般資料比較
2.2 兩組鐵及鐵相關蛋白水平比較PD組血清DMT1水平明顯高于對照組(t=4.979,P<0.001);PD組血清FPN1水平低于對照組(t=-2.532,P<0.05);PD組血清鐵水平中位數明顯高于對照組(Z=-3.867,P<0.001)。見表2。
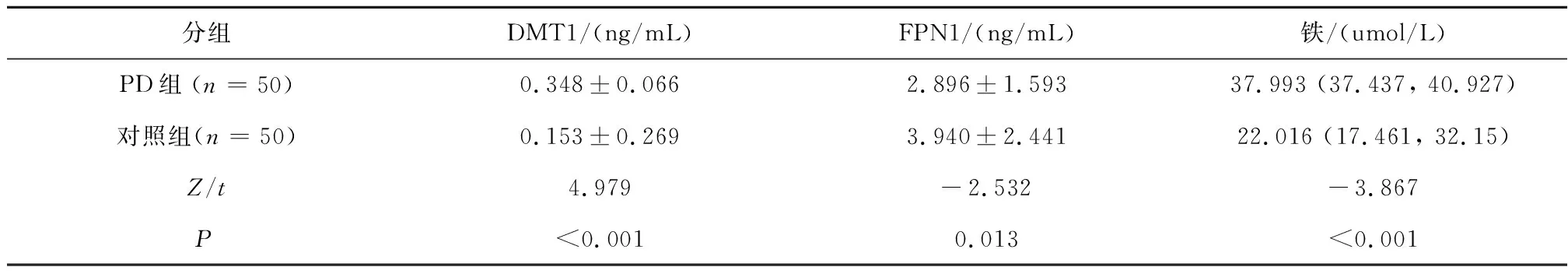
表2 兩組鐵及鐵相關蛋白水平比較
2.3 兩組炎癥因子水平比較PD組血清IL-6水平中位數明顯高于對照組(Z=-5.673,P<0.001)。PD組血清IL-1β水平中位數高于對照組(Z=-2.006,P=0.045)。PD組血清TNF-α水平中位數高于對照組(Z=-4.462,P<0.001)。見表3。

表3 兩組炎癥因子水平比較/(pg/mL)
2.4 PD患者鐵及鐵相關蛋白與炎癥因子的相關性分析PD患者血清DMT1水平與血清IL-6水平相關(r=0.282,P=0.047);PD患者血清DMT1水平與血清TNF-α水平相關(r=0.347,P=0.014);而PD患者血清DMT1水平與IL-1β水平無相關性(P>0.05);PD患者血清FPN1水平與炎癥因子(IL-6、IL-1β及TNF-α)無相關性。見表4。
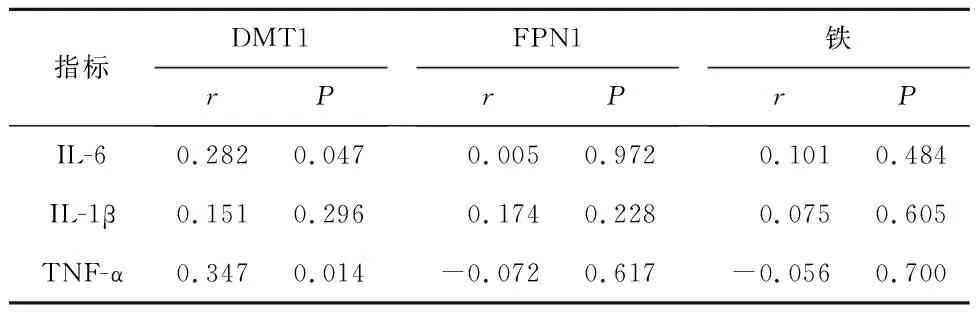
表4 PD患者鐵及鐵相關蛋白與炎癥因子的相關性分析
2.5 PD患者鐵及鐵相關蛋白、炎癥因子與臨床癥狀及病程的相關性分析PD患者DMT1與UPDRS III評分相關(r=0.454,P=0.001);PD患者IL-1β與UPDRS III評分相關(r=-0.288,P=0.043);PD患者IL-6與認知功能(MOCA)相關(r=0.420,P=0.002);PD患者中TNF-α與病程相關(r=0.294 ,P=0.038)。見表5、6。
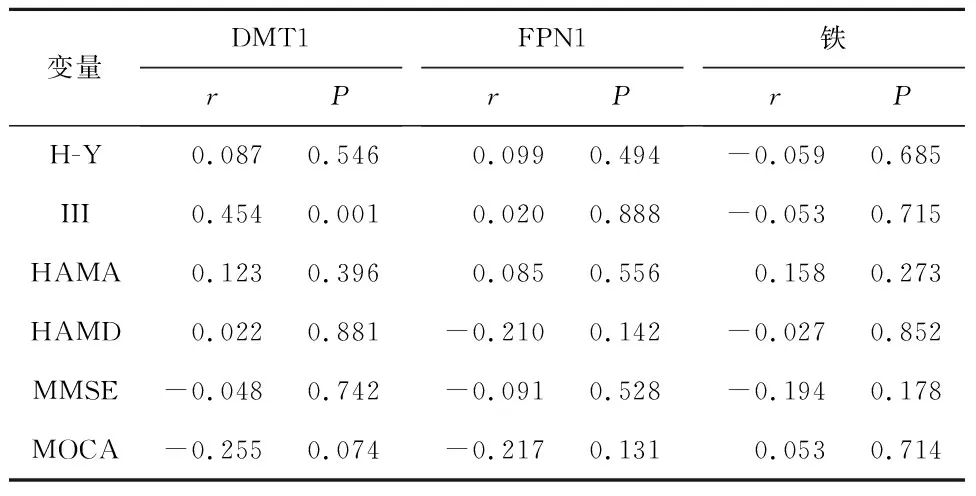
表5 PD患者鐵及鐵相關蛋白與臨床癥狀及病程相關性分析
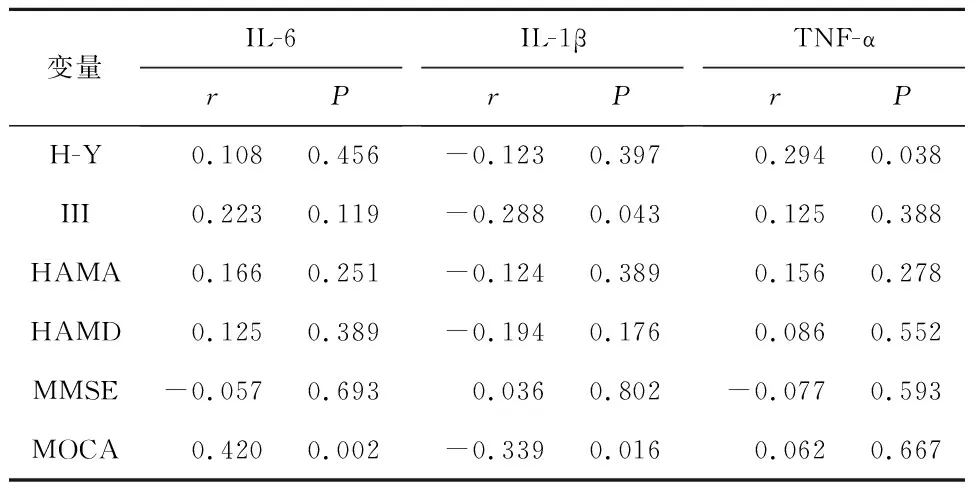
表6 PD患者炎癥因子與臨床癥狀及病程相關分析
3 討論
鐵代謝的平衡主要通過調節鐵轉蛋白受體1(TfR1)、DMT1(+IRE)以及FPN的合成來實現。鐵轉蛋白受體(TfR)分為TfR1、TfR2(鐵轉蛋白受體2)兩種類型,但對鐵代謝起調節作用的只有TfR1;DMT1根據其mRNA水平是否含有鐵調節元件(Iron regulatory element,IRE)分為DMT1(+IRE)與DMT1(-IRE)兩種類型,但對鐵代謝真正起調節作用的只有DMT1(+IRE)[12]。有研究報道,PD鐵沉積可能與鐵代謝關鍵調節蛋白表達失控有關[10]。本研究結果顯示PD組血清 DMT1水平明顯高于對照組;PD組血清FPN1水平低于對照組;PD組血清鐵水平明顯高于對照組。提示PD患者外周血清中發現鐵代謝紊亂。既往研究結果顯示,PD患者腦內TfR密度和正常人并無顯著差異;6-羥基多巴胺(6-OHDA)誘導的PD模型大鼠黑質中顯示正常對照組與PD模型組黑質內TfR表達差異無統計學意義,證明TfR可能與黑質內鐵沉積無關[11]。PD尸檢結果顯示在腦內黑質區DMT1水平升高和FPN1水平下降導致該區域鐵大量聚集[12-13]。6-OHDA和MPTP誘導PD模型鼠中,DMT1和FPN1在PD模型鼠腦內鐵異常沉積部位黑質、紅核、蒼白球、殼核表達異常[14]。本研究結果提示,PD患者存在鐵蛋白代謝紊亂。
神經系統炎癥反應是神經系統對外界刺激的一種防御性反應,也是中樞神經系統疾病損傷最常見的病理機制。PD神經系統炎癥反應主要涉及神經小膠質細胞激活、炎癥因子、趨化因子的釋放等,與PD的發生發展密切相關[15-16]。鐵代謝與神經系統炎癥之間存在相關性,鐵代謝相關蛋白(鐵調素、DMT1、TfR、鐵蛋白、FPN)在小膠質細胞內均有表達,IL-1β、 IL-6 及TNF-α炎癥刺激可增加神經元DMT1和 FPN1的表達,引起鐵聚集[17-18];DMT1和 FPN1表達增多可誘導小膠質細胞促炎性細胞因子(IL-1β、IL-6及TNF-α)進一步釋放,加重神經炎癥損傷。小膠質細胞作為神經系統重要的免疫炎癥細胞,通過介導炎癥反應激活鐵代謝途徑,引起細胞內鐵過載,導致神經元損傷;細胞鐵代謝紊亂亦可引起細胞促炎表型極化,加重炎癥反應[19-22]。本研究發現PD患者血清DMT1水平與血清IL-6、TNF-α水平相關;而PD患者血清DMT1水平與IL-1β水平無相關性;PD患者血清FPN1水平與炎癥因子(IL-6、IL-1β及TNF-α)無相關性。提示PD患者外周血中鐵代謝相關蛋白DMT1與炎癥因子存在交互作用。本研究結果顯示PD患者DMT1與UPDRS III評分相關;PD患者IL-1β與UPDRS III評分相關;PD患者IL-6與認知功能(MOCA)相關;PD患者中TNF-α與病程相關。
綜上,PD患者發病可能與血清中鐵代謝蛋白紊亂、炎癥因子和PD運動癥狀存在相關性。但本研究樣本量較小,今后應擴大樣本量,進一步驗證本研究結果。

