多面體型Fe基金屬有機框架材料(Fe-MOF)的調控制備及其性能?
黃韋穎,陶雪芬,石潤琪,賈藝陽,王玉新,金銀秀
(臺州職業技術學院,浙江臺州 310008)
水污染是中國當前面臨的最主要環境問題之一。膜生物反應器(MBR)法和高級氧化法是國內外廢水深度處理的常用技術[1-2],其中高級氧化法中的芬頓氧化在眾多相關的廢水處理技術中,被認為是較為有效、簡單且經濟的方法之一,目前廣泛應用于生物處理的預處理,降解有機污染物以提高廢水可生化性,或者作為生物降解后的深度處理,可提高出水的水質[3-4]。
金屬有機框架材料(MOFs)[5-7]由金屬離子及有機配體構筑而成,具有空間網狀結構、孔徑可調控、比表面積大、吸附位點豐富以及獨特的光電磁等性質,在污染物吸附[8-10]、催化[11-14]、負載[15-16]、分子磁體[17]等諸多方面具有良好的應用前景,其敞口貫通的孔道有利于吸附濃縮環境中的污染物分子到材料的表面和內部。MOFs材料的結構與金屬離子及有機配體種類有關,同時,不同的合成條件會產生不同的配位模式,進而得到不同的結構,具有不同的性能[18-19]。
作者選擇芬頓氧化法中常用的Fe3+作為中心離子,與雙齒配體鄰苯二甲酸、對苯二甲酸配位聚合,同時以單齒配體苯甲酸作為調節劑,制備出新型多面體Fe基金屬-有機框架化合物(Fe-MOFs)材料,借助X射線衍射(XRD)、電鏡掃描(SEM)手段對其形貌進行表征,以亞甲基藍為目標化合物研究其對有機污染物的吸附和催化降解能力。
1 實驗部分
1.1 試劑與儀器
FeCl3:西隴科學股份有限公司;鄰苯二甲酸(OXA)、對苯二甲酸(PTA)、苯甲酸:上海阿拉丁生化科技股份有限公司;N,N-二甲基甲酰胺(DMF):麥克林公司;亞甲基藍:上海潤捷股份有限公司;以上試劑均為分析純。
水熱反應釜:25 mL PTFE 內襯;光化學反應儀:XPA系列,南京胥江機電廠;場發射掃描電子顯微鏡:FE-1050,日本島津公司;X 射線衍射儀:DX-2700,紫外-可見光譜儀:UV-2550,日本島津公司;氣體吸附系統:ASAP2020,美國麥克公司;馬弗爐:SRJX-8-13 SX,上海本亭儀器有限公司。
1.2 實驗方法
1.2.1 溶劑熱法制備Fe-MOF
將1mmol FeCl3與1.5 mmol DXA/PTA、一定比例苯甲酸、DMF 溶液加入高壓反應釜中,密封后,加熱至120℃,分別反應10、24、36 h得到晶體粉末,過程見圖1。所得晶體粉末經馬弗爐500℃活化2 h,得到Fe-MOF[20]。
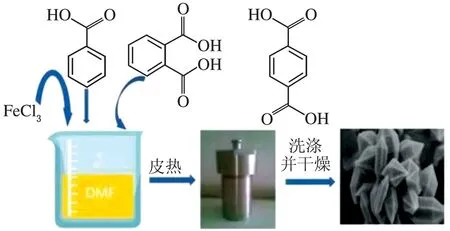
圖1 溶劑熱法制備Fe-MOF
1.2.2 物相分析
物相結構采用X 射線衍射儀分析Fe-MOF樣品的晶格結構,其輻射源為Cu-Kα射線,掃描范圍2θ=5°~70°,掃描速度1°/min;采用場發射掃描電子顯微鏡觀察樣品的形貌;采用氣體吸附系統分析樣品的比表面積及孔徑。
1.2.3 光降解實驗
取適量亞甲基藍(最大吸收波長為664 nm)配成質量分數為0.000 2%的待測試液,置于光化學反應儀中,以500 W 的金鹵燈(用420 nm 濾玻片濾掉紫外光)為光源,進行可見光催化降解染料實驗。
1.3 光催化性能的研究
在裝有30 m L 亞甲基藍溶液的燒杯中加入0.2 g/LFe-MOF晶體粉末,將燒杯放入光化學反應儀的恒溫水浴鍋中,t=25℃暗反應30 min使受試材料達吸附平衡后,打開可見光燈,繼續攪拌,進行光催化降解反應。反應過程中每隔一定時間取樣2 m L,離心,取上清液,用紫外-可見分光光度儀測定上清液中亞甲基藍的吸光度(A)變化。另取一個燒杯加入亞甲基藍溶液作為空白對照,其余操作同Fe-MOF的降解實驗。降解效果按照公式(1)計算。
式中:η為降解率,%;A為受試液可見光下經Fe-MOF降解一定時間后664 nm 處的吸光度;A0為受試液664 nm 處的初始吸光度。
2 結果與討論
2.1 溶劑熱時間對Fe-MOF催化性能的影響
取不同條件制備的Fe-MOF,以0.2 g/L 用量加入到質量分數0.000 2%的亞甲基藍溶液(p H=8)中,500 W 金鹵燈或自然光下連續照射240 min,每隔30 min取樣一次,檢測并計算亞甲基藍的降解率,結果見表1。
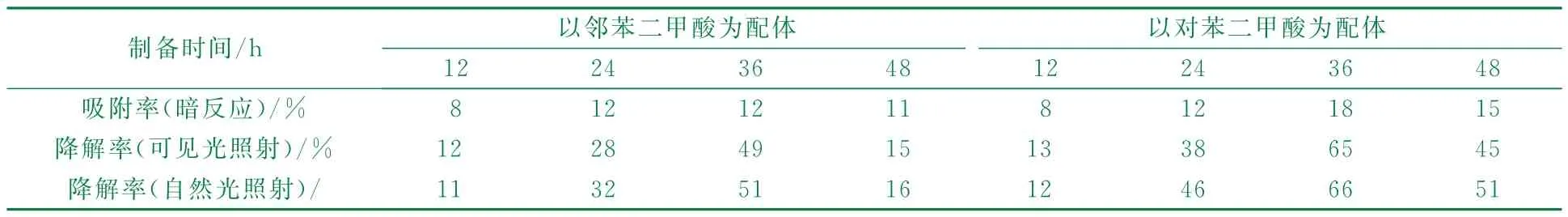
表1 不同制備時間Fe-MOF的吸附率、降解率
由表1可知,具有發達孔隙的Fe-MOF 本身對亞甲基藍有一定的吸附作用,溶劑熱法制備Fe-MOF,t=120℃,t=12 h,制得的化合物吸附率和催化降解率約為10%,由于反應時間過短,生成的粉末顆粒非常細小;t=24 h,制得的化合物吸附率為12%,催化降解率為46%(對苯二甲酸為有機配體);t=36 h,制得的化合物吸附率和催化降解率進一步提高,其中以對苯二甲酸為有機配體的化合物在自然光照射下對亞甲基藍的降解率達到66%;繼續延長反應時間,制得的化合物吸附率和催化降解率反而有所下降,t=48 h,對苯二甲酸為有機配體制得的Fe-MOF 對亞甲基藍的催化降解率為51%。因此,從節約能源降低生產成本及催化劑性能的角度出發,制備Fe-MOF的最佳t=36 h,該條件下制得的化合物吸附性能和催化降解性能均為最佳。
2.2 單齒配體調節劑對化合物催化性能的影響
取添加不同比例苯甲酸(單齒配體調節劑),120℃條件下反應36 h制得的Fe-MOF,以0.2 g/L的用量對質量分數為0.000 2%的亞甲基藍溶液(p H=8)在500 W 的金鹵燈或自然光下連續光照240 min,進行降解實驗,結果見表2。
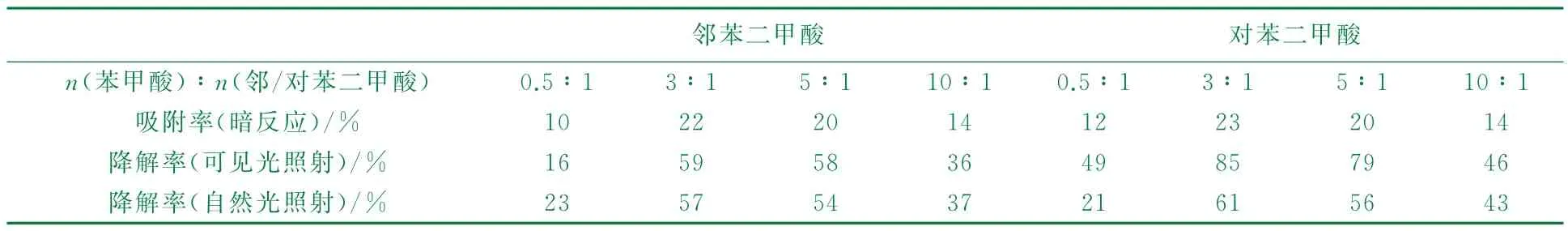
表2 添加不同比例單齒配體制得Fe-MOF的吸附率、降解率
由表2可知,t=120℃、t=36 h,單齒配體苯甲酸調節劑可以提高Fe-MOF 的吸附性能和光催化性能,其中n(苯甲酸)∶n(鄰/對苯二甲酸)=3∶1,吸附性能和催化降解性能最佳。雙齒有機配體為鄰苯二甲酸的Fe-MOF吸附率為22%,可見光下對亞甲藍藍的降解率為59%,自然光下降解率為57%;雙齒有機配體為對苯二甲酸的Fe-MOF吸附率為23%,可見光下對亞甲藍藍的降解率為85%,自然光下降解率為61%。
2.3 其他條件對降解性能的影響
由表1~2可知,Fe3+與有機配體對PTA 形成的Fe-MOF吸附和催化降解性能均優于Fe3+與有機配體OXA 形成的Fe-MOF。經氣體吸附系統測量,樣品Fe-MOF的比表面積、孔容、孔徑見表3。

表3 樣品Fe-MOF的比表面積、孔容、孔徑
由表3 可知,FeCl3-PTA-36 h(c)和FeCl3-OXA-36 h(e)的比表面積(BET),分別為45.15 m2/g和38.52 m2/g,平均孔徑(dp)分別為4.691 nm 和4.647 nm,其N2吸附-解吸等溫線見圖2。
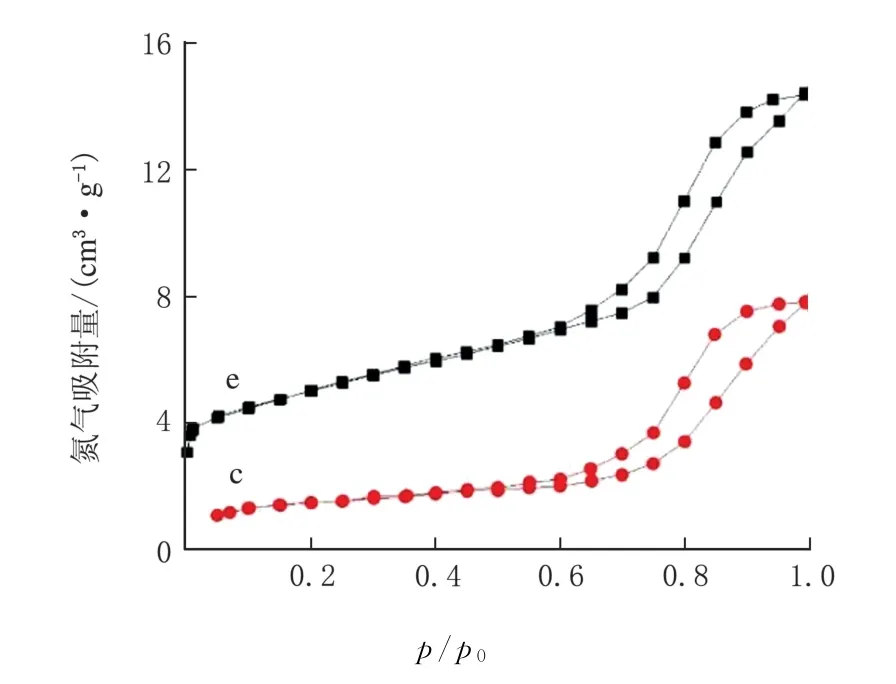
圖2 N2 吸附-解吸等溫線
這有可能是因為前者的有機配體PTA 結構中的2個羧基官能團在空間的間距較后者的有機配體OXA 的大,導致前者形成的多孔結構孔徑、比表面積均相對較大。該測量結果也印證了表1~表2中兩者的吸附和催化性能表現。由此可見,有機配體結構上的差異將對Fe-MOFs的性能產生一定影響。
對比表2的實驗數據可知,t<30 min添加了單齒配體調節劑苯甲酸得到的Fe-MOF 暗反應的吸附性能比未添加苯甲酸的好,這可能是因為在反應體系中加入的單齒配體苯甲酸與雙齒配體對苯二甲酸發生了配位競爭,從而延長配位過程,因而得到比表面積較大的晶體。
2.4 制備條件對化合物形貌的影響
Fe-MOF的XRD 譜圖見圖3。
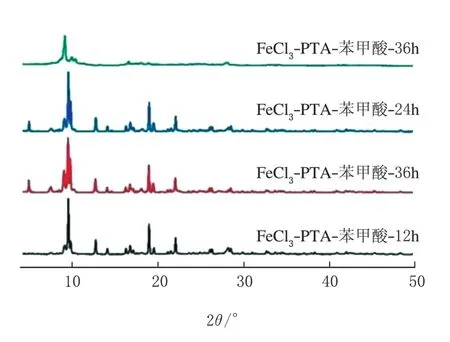
圖3 Fe-MOF的XRD譜圖
由圖3可知,在2θ≈10°有鐵的特征峰。
不同制備條件Fe-MOF的SEM 圖見圖4。

圖4 Fe-MOF的SEM 譜圖
由圖4可知,t=12~36 h均能得到多面體結構,而且隨著反應時間的延長得到的晶體結晶度更高、形貌更規整。t=12 h,得到邊沿不太規整的八面體結晶;t=24、36 h,得到正二十面體結晶;加入苯甲酸后得到的多面體結晶變得扁平,邊緣也變得更圓滑。
3 結 論
以Fe3+為中心離子制得的Fe-MOF 具有在可見光下催化降解有機化合物的作用,有機配體對Fe-MOF的性能有明顯影響,以對苯二甲酸為有機配體制得的Fe-MOF 在吸附性能和催化性能上均優于以鄰苯二甲酸為配體制得的Fe-MOF。反應時間對晶型和催化性能均有影響,以對苯二甲酸為例,隨著溶劑熱反應時間的延長,Fe-MOF的晶型由八面體逐漸變成二十面體,t=36 h得到以二十面體晶型為主的Fe-MOF,且其可見光下的催化性能最佳。以不同配比加入單齒配體苯甲酸為調節劑制得的Fe-MOF 吸附性能均有明顯提升,其中以n(苯甲酸)∶n(對苯二甲酸)=5∶1 制得的Fe-MOF 吸附和催化性能最佳。

